您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-07-23 20:10
【问】可见异物阳性样品的制作和管理有何要求?
【答】完成可见异物识别后,需要制作相应的缺陷样品用于人工目检考核或替代人工的方法比较,为保证制备的缺陷阳性样品具有代表性,缺陷阳性样品可来源于以下两种渠道:
·将实际生产过程中收集到的缺陷样品通过多名具有灯检资质的人员进行目检,每瓶合计灯检 30~50次,计算检出率,根据检出率将缺陷品进行分类。
·通过实验室制备,制备材料的材质与可能污染源对应,缺陷尺寸可量化。
参考USP 1790 VISUALINSPECTION OFINJECTIONS (《注射剂目视检查》)2.1项检查过程的能力:细长状异物一般长度要达到500um才能达到70%的检出率;粒状异物相对容易被检测到,在人工目检的可检出率如下表:
表1粒状可见异物直径与人眼可检出率关系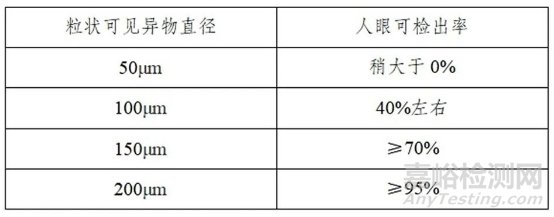
容器、药液性状及装量水平等均可能影响异物的检测,所以上述数据仅供企业在制定缺陷阳性样品剔除率时参考,具体检出率还应结合容器、药液特性合理制定。
缺陷阳性样品需入账严格管理,予以编号,上锁存放。缺陷阳性样品应设定有效期,并定期对缺陷阳性样品进行检查,及时更替失去代表性的缺陷阳性样品。另外在样品使用前,需由具备资质的人员进行样品有效性检查,确保样品满足使用要求。
来源:药品GMP指南第2版无菌制剂上册(P416-417)

来源:Internet


