您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-08-01 09:01
摘要
目的:探析国内外各主流药典中可见异物检查的分析方法,为《中国药典》中可见异物检查法的升版提出一些思路和建议。方法:通过查阅国内外各主流药典,分别从可见异物的定义、人工灯检法、可见异物的判定标准等方面进行分析比对,总结国内外各主流药典的异同点。结果:各主流药典对可见异物的定义、判定标准等方面均存在差异,对于人工灯检法的检验人员、光源、光照强度、检查数量的要求以及具体的操作方法等均有不同,各主流药典均有所长及所短,检验参数相辅相成,并相互制约。结论:建议《中国药典》结合各主流药典的优缺点和中国企业的现状,对可见异物检查法的内容进行完善,从而更好地保证药品的质量以及人民的用药安全。
关键词:可见异物;人工灯检法;检查人员;检验操作方法;判定标准
注射剂、滴眼剂中可见异物的存在会影响药品的质量,会影响临床使用的有效性和安全性。尤其是注射剂,当可见异物进入血管,会造成微循环障碍,可能引起静脉血管炎[1-2]、血栓[3]、变态反应等;也可能会间接带来细菌微生物,从而导致热原现象[4];亦或是血液中的纤维蛋白附着在可见异物上形成血栓,流经心脑血管时,对人体健康造成更严重的危害[5-7]。
可见异物的存在是注射产品召回的十大原因之一[8],美国食品药品管理局(U.S. Food and DrugAdministration,FDA)官网每年都会公布因可见异物产生的药品召回事件,我国注射剂的上市质量抽检发现可见异物问题也不鲜见,因此可见异物的检查与控制对保证注射剂、滴眼剂的质量有着重要意义。
《中华人民共和国药典》(以下简称《中国药典》)对于可见异物的检查收载在“通则0904可见异物检查法”中,其他各主流药典均收录了可见异物检查的相关内容,为了更好地研究可见异物检查法,本文通过对《中国药典》2020年版(ChP 2020)、《美国药典》2024年版(USP-NF2024)、《欧洲药典》第11.0版(EP 11.0)、《英国药典》2023年版(BP 2023)、《日本药局方》第18版(JP 18)和《国际药典》第11版(IP 11)中的可见异物检查相关规定进行分析比对,从科学性、合理性、可行性、必要性及对检验结果和药品质量影响的重要性等角度对各药典之间的异同点进行综合分析和评价,同时结合实际生产与质量控制中的经验,对ChP 2020中通则0904可见异物检查法的完善提出一些建议。
一、国内外各主流药典涉及可见异物的章节
ChP 2020中通则0904收载了可见异物检查法[9],USP-NF 2024中为<790>Visible Particulates inInjections(注射剂中的可见颗粒物)[10]和<1790>Visual Inspection of Injections(注射剂的目视检查)[11],EP11.0在通则2.9.20 中收载了ParticulateContamination:Visible Particles(微粒污染物:可见颗粒物)[12],BP 2023中为 Appendix XIII B.Particulate Contamination:Visible Particles(附录XIII B.微粒污染物:可见颗粒物)[13],IP 11中为5.7.2 Visible Particles(可见微粒物)[14],JP 18中为6.06 Foreign Insoluble Matter Test for Injections(注射剂中的外来不溶物检查)[15]和6.11 ForeignInsoluble Matter Test for Ophthalmic Liquids andSolutions(眼科制剂中的外来不溶物检查)[16]。上述各药典涉及可见异物的章节详见表1,后续文章中在描述各国药典时均指表1中提到的版本,不再赘述版本号。

二、可见异物的定义
ChP 2020中将可见异物描述为“是指存在于注射剂、眼用液体制剂和无菌原料药中的目视可以观测到的不溶性物质。其粒径或长度通常大于50 μm”;EP、BP、IP对于可见异物的定义相似,指出了可见异物“是不希望存在于溶液中的、移动的、不溶解的微粒”;JP除此之外还指出可见异物具有外来的属性。USP也指出了可见异物是不希望存在的、移动的、不溶解的,并根据来源将可见异物详细分为三类:固有异物(产品性所固有的颗粒)、内源性异物(来自生产设备、产品配方或容器系统的颗粒)和外源性异物(源自生产环境的颗粒,是生产工艺外的异物)。具体详见表2。


归纳起来,上述药典指出了可见异物具有以下特点:1)是不溶解于药液中的;2)在一定条件下目视可以观测到;3)是药品研发者或生产者不希望在药品溶液中出现的;4)可移动的;5)外来的。第一点所有药典均提到了。第二点只有ChP明确在定义中提到了。“3)和4)”只有ChP没有提到。“5)”只有JP和IP提到了。从科学性分析,可见异物用前3个特点来定义较为适宜,“4)和5)”则不是必须的,因为可见异物有时是从外界引入的,在一定条件下确实也可以移动,但如果说必须是外来引入的且具有移动性才是可见异物则是不够准确和全面的。
关于可见异物来源的详细分类,国内起草单位在历次药典宣贯中也有提及,甚至早于USP,只是分类方法有所不同。国内将注射液和滴眼液在货架贮存期间逐渐产生出的可见不溶性物质叫做内源性可见异物,是由于药品稳定性差导致发生成分降解、水解、蛋白变性,或处方组成存在问题,各成分间相互作用发生聚合、络合等,或由于药物与容器兼容性不好逐渐产生玻璃屑或不溶性物质。而凡是来源于外界带入,比如容器清洁度不够、滤膜纤维脱落、环境、人员和设备管道引入的不溶物,均视为外源性可见异物。因制剂学特点,药物自身的正常固有不溶物,比如混悬注射液中的药物粒子虽然可见,但不属于异物。ChP中目前没有详分可见异物的来源,也未明确指出可见异物是具有意外存在的这一特点,虽然通则起草单位在历次药典宣贯中都已提到,但将来药典通则修订时建议考虑将此进行补充明确。
此外,ChP中说明了可见异物的粒径或长度通常大于50 μm,USP则说明可见异物在50~250 μm区间被观察者目视捕捉到的几率会逐渐增大,其他药典没有明确可见异物的尺寸。这一点ChP比较明确,方便药检机构的法定检验,“通常大于50 μm”的描述,即给了人工目视一个参考指导(鉴于目视法的特点,也仅能作为一个参考指导),使仪器检测的校准有了具体可行的统一标尺,“通常”一词的使用也给予了一定的灵活度。USP则更贴近客观实际,事实上,可见异物的目视观察受到观察者、观察条件、异物形态等诸多因素影响,能否被观察到的确就是一个概率问题。
ChP还将可见异物分为明显可见异物和微细可见异物。明显可见异物是指金属屑、玻璃屑、长度超过2 mm的纤维、最大粒径超过2 mm的块状物以及静置一定时间后轻轻旋转时肉眼可见的烟雾状微粒沉积物、无法计数的微粒群或摇不散的沉淀,以及在规定时间内较难计数的蛋白质絮状物等。微细可见异物是指点状物、2 mm以下的短纤维和块状物等微细可见异物。这个划分对于实验室检验结果的判定和生产中对产品污染程度的判断,以及后续的处置措施都是有意义的。
三、可见异物的检查方法
上述各药典中关于可见异物的检查方法有人工灯检法和光散射法两大类。人工灯检法是上述各药典均采用的检查方法。光散射法是ChP通则可见异物检查法中的第二法。USP <1790>VisualInspection of Injections(注射剂的目视检查)中还介绍了半自动灯检法和全自动灯检机法。
3.1 人工灯检法
上述各药典对于人工灯检法的描述是基本一致的,即在合适的光源照度下,将待查物置于遮光板边缘处,在明视距离,手持容器颈部,轻轻旋转和翻转容器,使药液中可能存在的可见异物悬浮,分别在黑色和白色背景下目视观察。不反光的黑色背景用于检查无色和白色异物,不反光的白色背景用于检查有色异物。
人工灯检法由检验者目视观测,其结果受外界干扰的因素很多,例如检验者的视力条件、光源及其照度、检品放置的位置、环境、目视时间,以及检验者的经验水平,甚至情绪等均会影响检测结果,尤其对微细可见异物的判定影响更大。上述各药典对这些因素要求不同,这些不同也将导致检验结果的不同。
3.2 检查人员条件
ChP中规定了检查人员应符合的视力条件:远距离和近距离视力测验,均应为4.9及以上(矫正后视力应为5.0及以上);无色盲症。USP<790>、BP、EP、IP及JP中均没有明确检验人员的视力要求。USP<1790>中建议检查人员每小时休息一次;检验人员在培训前需要进行视力和颜色感知测试,允许使用矫正镜片来达到所需视力,检验人员应至少每年重新获得一次资质。各国药典对可见异物检验人员的要求详见表3。
鉴于可见异物检查目视法对于检查人员经验的要求比较高,培训后再上岗就显得非常必要。国内各实验室实际上也都会对可见异物检查员进行岗前培训,但培训方法和要求不尽相同,这将导致每位检验者对异物检出掌握尺度的不同,直接造成检验结果的差异。建议药典通则也将这部分内容进行补充,以尽量减少由于人员因素造成的影响。


3.3 检查用装置的光源和光照强度
目视检查的结果很大程度上会受到检查区域光源和光强的影响。
3.3.1 检查用装置的光源
ChP中明确规定为带有遮光板的日光灯光源;EP、BP、IP对于光源的要求一致,使用配有适宜的遮光白光源和灯光扩散器[例如包含2个13 W荧光灯管的观察照明器,每个波长525 mm,或一个适宜的发光二极管(LED)光源)];USP<1790>建议使用的光源是荧光灯(最好配备高频镇流器以减少可见闪烁)、白炽灯(会伴随有热量释放)或LED灯(节能、稳定且不放热),并同时指出这些光源均属于漫反射光源,能避免出现眩光,有利于直接观察。
3.3.2 光照强度
USP、EP、BP、IP对光源照度的规定基本一致,均要求光照范围应在2000~3750 lx之间,对于有色玻璃和塑料容器而言,需要更高的照度,但并未给出对这类样品建议的照明强度。JP规定对一般注射剂的照明强度同样在2000~3750 lx;对于塑料容器包装的含水注射剂,照明强度应在8000~10000 lx之间;对于眼用制剂,光照强度应在3000~5000 lx之间。USP写明对于半透明塑料容器或琥珀色容器,需要增加光照强度,比如8000~10000 lx,或从容器后定向照明,或转移到干净透明的容器中观察。ChP对不同检品也有不同的照度规定,1000~1500 lx适用于无色注射液和滴眼液;2000~3000 lx适用于透明塑料容器或有色注射液或滴眼液;4000 lx适用于混悬注射液和滴眼液中色块、纤维毛等外来污染物的检查。根据实践经验,ChP规定的1000~1500 lx光照度有些偏低,容易使检出率偏低。但其他药典规定的8000~10000 lx极易使人眼疲劳,检验人员连续工作时间比在2000~3750 lx光照条件下观察持续时间大幅缩短。各主流药典关于可见异物检查用装置的光源与光源强度的详细内容见表4。



3.4 取样原则或要求
检验用药品的取样要保证检验结果尽可能反映总体的情况[17]。所抽取的样品对全部样品要具有充分的代表性。BP、EP和JP均没有规定可见异物检测的取样支数;IP仅指出了需检测20支样品;ChP对实验室检验规定的比较详细,按照GMP附录的取样原则进行随机取样,并根据制剂的类型分别给出了取样支数:注射液取20支(瓶),注射用无菌制剂取5支(瓶),无菌原料药按各品种制剂项下的最大规格量取5份,眼用液体制剂取20支(瓶);USP的取样原则针对企业放行检验,取样量需根据产量的不同计算出不同的取样量,采用ANSI/ASQZ1.4(或 ISO 2859-1)标准进行抽样和检查。通常检查水平II,正常检查的单次抽样计划的接收质量限(Acceptable Quality Limit,AQL)为0.65%。另外,USP对于已售出的产品,取样数量为20支。具体详见表5。

3.5 检验操作方法
3.5.1 检验环境
EP、BP、IP、JP均没有明确可见异物检查的环境,ChP指出应在暗室中进行,并避免引入可见异物。USP<1790>指出检查点的设计和操作方式尽可能减少操作人员重复活动造成伤害的风险。
3.5.2 检验前准备
各药典对于检查前的处理基本一致:清洁外部标签以便于进行观察。同时EP、BP规定:如果无法在原容器中进行检查,则可以将内容物转移到没有可见颗粒的样品容器中进行检查,并采取预防措施防止在转移过程中被污染。ChP对于此方面的描述更加详细,要求在制备注射用无菌粉末和无菌原料药供试品溶液或供试品的容器不适于检查(例如透明度不够、不规则形状容器等)时,需转移至适宜容器中,该过程均应在B级的洁净环境(例如层流净化台)中进行。
3.5.3 检验时长
检查时长对于可见异物的检出率具有直接的影响。EP、BP、IP、USP对于检查时长具有统一的规定:均要求在黑白背景下各检查5秒,总检查时限为10秒;对于不易观测的样品,如有色玻璃或塑料容器及有色或混浊制剂,应适当延长检验时间。ChP相对于其他药典,要求的检测时限更长,总检查时间为20秒,这对检验光强度低有一定的弥补作用。根据长期实践的经验,检查时间的延长在一定范围内有助于提高检出概率,使检查结果更接近真实情况,但随着时间的增加,效果会逐步递减,从付出与收益比的角度考虑,并不是检测时间越长越好,特别是对于企业生产在线检验而言,过长的检测时长不具有可操作性。
3.5.4 操作方法
EP、BP、IP、JP、USP对于具体的操作方法基本一致,规定在黑色背景和白色背景下分别检查,每个背景检查约5秒,检查时应当轻轻地旋转或倒置,确保无气泡产生。ChP规定的较为详细:将供试品置遮光板边缘处,在明视距离(指供试品至人眼的清晰观测距离,通常为25 cm)下,手持容器颈部,轻轻旋转和翻转容器(但应避免产生气泡),使药液中可能存在的可见异物悬浮,分别在黑色和白色背景下目视检查,重复观察,总检查时限为20秒。ChP还规定了不同规格的供试品检查的具体细节:装量每支(瓶)在10 mL及10 mL以下的,每次检查可手持2支(瓶);50 mL或50 mL以上的大容量注射液按直、横、倒三步旋转检视。需要注意的是,如果用手同时握住较多容器,可能会影响可见异物的检出与判断,因为会影响容器表面和内容物的完整视野,同时检测1支以上对检验技术和经验的要求也更高。但由于生产在线检验的产品数量很大,对人工灯检检测速度的要求比较高,所以允许手持多支同时观察。为保证检测结果的准确性,ChP明确了实验室检测时小容量的才允许每次检查最多可手持2支(瓶)样品。
四、判定标准
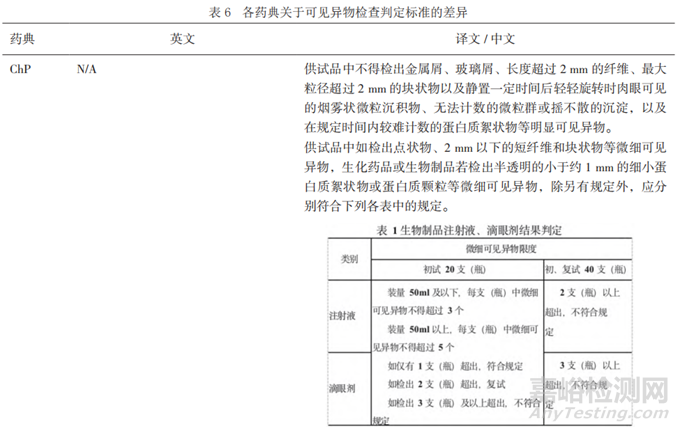
EP、BP只写明“记录存在的任何可见微粒”,未明确如何判定。JP中强调“不能检测到外来不溶物”,但未明确如果有内源性不溶物如何判定。IP的判定标准相对较为明确,即“如果在多于1个容器中发现1个或多个颗粒,则该制剂不符合规定。当该检验应用于需要用溶剂溶解的注射用粉末时,如果在2个以上的容器中发现颗粒,则该检验不通过。”USP要求检出可见异物的支数(按照取样原则)不超标准规定。ChP将可见异物分为明显可见异物和微细可见异物,不允许有明显的可见异物检出,允许每支产品检出的微细可见异物的数量不超标准规定。
USP中给出了生产后出厂放行与货架期产品的不同判定标准。放行标准是按照统计学的方式计算出不可以出现微细可见异物的数量,对货架期产品的要求是抽样检查20支,如果样品中没有检出可见异物,该批次则可视为基本上不含可见异物。
ChP中目前生物制品和非生物制品对于微细可见异物的复检要求有所不同,随机再抽取20支,根据制剂类型不同(注射液、注射用无菌制剂及无菌原料药)、给药方式的不同制定了不同的判定标准,详见表6。ChP 2020对生物制品和非生物制品进行分别规定是在没有进行充分评估调研和协调讨论之前的一种过渡处理,目前生物制品的标准规定相比于非生物制品稍宽松一些,但既然以同种剂型同途径给药,可见异物就应该制订相同标准。最终药典标准只应是根据给药途径的安全性风险不同,比如肌肉注射与静脉注射,才能适当制订不同的标准。



五、结果
通过上述比较发现,各药典对可见异物人工灯检法的规定存在不少差异,这些差异中不少会直接影响到检测结果。因此,对其进行深入分析及科学研判是非常必要的。
不同药典各有所长及所短,针对的检测对象也有不同,有些重点针对货架期产品的实验室检测,比如ChP;有些对出厂放行和货架期产品均有涉及,比如USP。相对来说,ChP因为需适用于监管部门的法定实验室检验,因此对检验方法和判定标准的规定更加细致明确,以获得各实验室检测方法尽可能的统一与检测结果的尽可能重现。USP则较为整体全面地从可见异物的分类、控制等角度指导实际生产与检验,其他药典相对较为简单。
关于ChP通则0904中有提及的一些长度单位,比如明显可见异物提到了2 mm的长度单位,在可见异物定义中也提到了可见异物通常大于50 μm的长度单位,在实际检验中不少检验人员纠结于这些长度的准确认定,其实对于人工目视法而言,这些长度单位都只能是大约的数字概念,不可能依靠人眼精密认定,若想精密认定异物的大小,只能是依靠正在迅速发展起来的全自动仪器检测方法。另外,从某种角度而言,可见异物检查的意义以及可见异物的风险也不仅仅由具体长度有所区分,所以应从可见异物检查与控制的实质去考虑问题,不必纠结于某个具体长度单位。
对各药典的对比分析不能仅仅根据单一条件,需要综合考虑各因素之间的关联影响,比如照度相对强的同时观察的时间又相对要求较短等对检测结果的影响;光照度高对检出率有利,但对检查员检测舒适性和持续检测时长又不利等。1000~1500 lx光照度偏低,容易使检出率偏低,8000~10000 lx光照度偏高,易使人眼疲劳,同时对伞棚灯提出了更高的要求,ChP是否可对光照强度进行合理设置,比如设置在2000~4000 lx,在考虑光照强度的同时,也要结合检查时长进行综合考虑。对ChP通则0904判定标准的一些建议:ChP2020对生物制品和非生物制品予以分别规定是在没有进行充分评估调研和协调讨论之前的一种过渡处理,目前生物制品的标准规定相比于非生物制品稍宽松一些,但既然以同种剂型同途径给药,可见异物就应该制订相同标准。所以建议将来药典通则标准只应是根据给药途径的安全性风险不同(比如肌肉注射与静脉注射)才适当制订不同的标准要求,同种给药途径或方式只能是同一标准要求。
六、讨论
通过比较分析,结合生产与检验实践经验,认为以下一些国外药典的优点值得将来ChP通则修订时学习借鉴:USP对于可见异物检查人员的经验要求内容;半自动灯检法描述内容,因为国内生产中也有这种仪器在使用;光照强度范围,以及从实验室延伸至生产过程的可见异物监控方法等。
可见异物检查是注射剂、滴眼剂等质量控制的重要项目,注射剂在生产制造、物流运输、储存、使用等环节均有可能引入可见异物,从另一个角度也可以反映出药品生产环境是否良好,药物稳定性是否良好,药品成分之间、主辅料之间、药品与容器之间的兼容性是否良好等问题,从可见异物的种类也可以对其来源或成因进行溯源推断。通常的解决方法是通过各种技术手段对可见异物进行定性鉴定,然后对其进行溯源研究,最后达到改善生产工艺,提高产品质量的要求。
可见异物的检出不是最终的目的,需持续加强对生产全过程和产品全生命周期的管控和监督,对各环节要严格把关,加大抽查力度,对质量进行控制,最终达到避免形成可见异物,以保证药品的质量和人民的用药安全。
参考文献
[1] Tran T,Kupies TK,Trissel LA. Quality-control Analytical Methods:Particulate Matter in Injections:What is It and What are the Concerns?[J]. International Journal of Pharmaceutical Compounding,2013,10(3):202-204.
[2] Kirkpatrick CJ,Rangoonwala R. Originator Antibiotic or Generic in Clinical Practice[J]. Journal of Applied Therapeutic Research,2009,7(2):52-57.
[3] Bukofzer S,Ayres J,Chavez A,et al. Industry Perspective on the Medical Risk of Visible Particles in Injectable Drug Products[J]. PDA Journal of Pharmaceutical Science and Technology,2015,69(1):123-139.
[4] 窦学杰,张丽宝,杨爱荣. 注射剂可见异物研究[J]. 药学研究,2013,32(11):673-675.
[5] Pittman JE,Zariwala M,Weck K,et al. Respiratory Failure as Cause oof Death in an Infant with Primary Ciliary Dyskinesia,American Thoracic Society International Conference[EB/OL]. [2024-01-05]. https://doi.org/10.1164/ajrccm-conference.2011.183.1_MeetingAbstracts.A1212.
[6] Bradley JS,Wassel RT,Lee L,et al. Intravenous Ceftriaxone and Calcium in the Neonate:Assessing the Risk for Cardiopulmonary Adverse Events[J]. Pediatrics,2009,123(4):e609-e613.
[7] Cant AJ,Lenney W,Kirkham N. Plastic Material from a Syringe Causing Fatal Bowel Necrosis in a Neonate[J]. British Medical Journal,1988,296(6627):968-969.
[8] Doessegger L,Mahler HC,Szczesny P,et al. The Potential Clinical Relevance of Visible Particles inParenteral Drugs[J]. Journal of Pharmaceutical Sciences,2012,101(8):2635-2644.
[9] 中华人民共和国药典:三部<0904>可见异物检查法 [S].2020:481-483.
[10] The United States Pharmacopeial Convention. The United States Pharmacopeia:General Chapters <790> Visible Particulates in Injections[EB/OL].(2016-05-01)[2024-01-05]. https://online.uspnf.com/uspnf/document/1_GUID-40E8EDAA-AF74-42B6-9F11-3EC14004300B_1_enUS.
[11] The United States Pharmacopeial Convention. The United States Pharmacopeia:General Chapters <1790> Visual Inspection of Injections[EB/OL].(2022-05-01)[2024-01-05]. https://online.uspnf.com/uspnf/document/1_GUID--C4739029-5BE7-4717-A2DD-E872411AF89F_6_enUS.
[12] The European Pharmacopoeia Commission. European Pharmacopoeia:General Notices <2.9.20> Particulate Contamination:Visible Particles[S]. 2024:385.
[ 1 3 ] B r i t i s h P h a r m a c o p o e i a C o m m i s s i o n . B r i t i s h Pharmacopoeia:Appendix XIII B. Particulate Contamination:Visible Particles[EB/OL]. [2024-01-05]. https://www.pharmacopoeia.com/appendices/appendix-13/ appendix-xiii-b--particulate-contamination--visible particles.html.
[14] World Health Organization. The International Pharmacopoeia:<5.7.2> Visible Particles[EB/OL]. [2024-01-05]. https://digicollections.net/phint/2022/index. html#d/b.7.5.8.
[15] The Pharmaceuticals and Medical Devices Agency. Japanese Pharmacopoeia:General Notices <6.06> Foreign Insoluble Matter Test for Injections[S]. 2021:165.
[16] The Pharmaceuticals and Medical Devices Agency. Japanese Pharmacopoeia:General Notices <6.11>Foreign Insoluble
Matter Test for Injections[S]. 2021:174-175.
[17] 孙煌,付璀莹,白政忠,等. 关于药品可见异物检查法抽样方案的探讨[J]. 中国药品标准,2012,13(2):88-90.

来源:中国药事


