您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-09 12:12
1、基毒杂质的定义
基因毒性杂质(Genotoxic Impurity,GTI):是指能直接或间接损伤细胞DNA,产生致突变和致癌作用的物质。
潜在基因毒性杂质(Potential Genotoxic Impurity,PGI ):是指具有警示结构,但尚未经实验证实具有遗传毒性的杂质。
此处,咱们简单延伸说下基毒杂质是如何损伤DNA,导致突变和致癌的。
首先基毒杂质的作用对象是DNA,即脱氧核糖核酸。它带有合成RNA和蛋白质所必需的遗传信息,是生物体发育和正常运作必不可少的生物大分子。
DNA 分子结构中,两条多脱氧核苷酸链围绕一个共同的中心轴盘绕,构成双螺旋结构。脱氧核糖-磷酸链在螺旋结构的外面,碱基朝向里面。两条多脱氧核苷酸链反向互补,通过碱基间的氢键形成的碱基配对相连,形成相当稳定的组合。如下图:
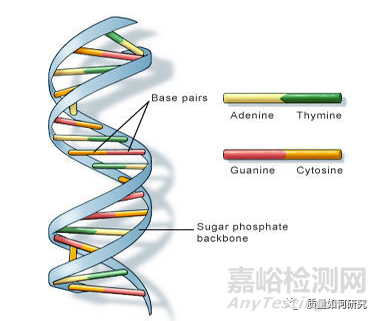
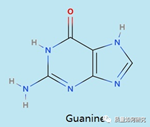
脱氧核苷酸由碱基、脱氧核糖和磷酸构成。其中碱基有4种:腺嘌呤(A)、鸟嘌呤(G)、胸腺嘧啶(T)和胞嘧啶(C)。四个碱基中有很多的亲核位点,比如嘧啶环和嘌呤上的N和O等,这些位点可以与亲电试剂(如烷基化试剂、酰基化试剂等)反应而产生不可逆的变化,从而引起基因突变。以鸟嘌呤为例,结构见下图:
事实上,DNA的反应种类除了只反应某一处位点外,还会有一些比较复杂的反应类型:
有的碱基上不仅含有一个亲核位点,如果一个致癌物有两处亲电位点,反应一处后,还会和碱基的另外一个位点反应,生成一些小环。
双亲电基团的另外一个基团也有可能和两个不同的碱基链接,甚至可以和两个螺旋上的不同碱基链接。
另外,DNA的反应活性除了亲核性之外,主要还受空间结构的影响。
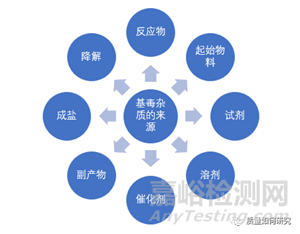
2、基毒杂质的来源
基因毒性杂质主要来源于原料药合成过程中的起始物料、中间体、试剂和反应副产物。此外,药物在合成、储存或者制剂过程中也可能会降解产生基因毒性杂质。
3、基毒杂质的分类
参考ICH M7,它将基毒杂质根据不同的控制措施分为了以下五大类。
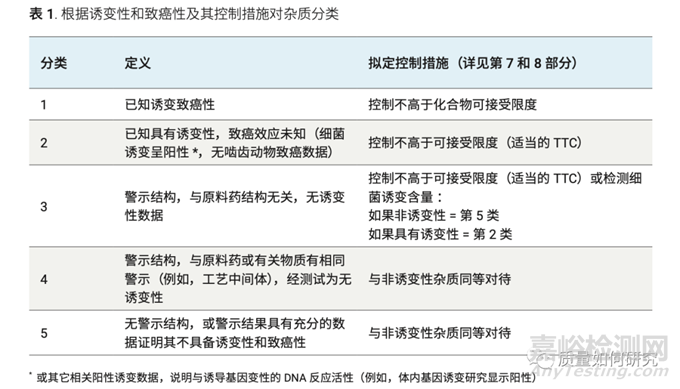
结合这个分类补充说明的两点就是:1)具有诱变性,不一定会致癌;2)具有警示结构,不一定具有诱变性。因此,通常1、2类是根据具体的实验数据来确认,而3、4、5类则根据科学的定量构效关系(Q)SAR或Ames细菌试验来确认。

4、基毒杂质的评估
目前基毒杂质的评估,主要采用两个互补的(Q)SAR 预测方法。一个方法基于专家知识规则,另一个方法基于统计学。
如果经两种互补的(Q)SAR方法预测均没有警示结构,则足以得出该杂质没有致突变性担忧的结论,可不做进一步的检测,归为第5类杂质。
基于专家知识规则的方法:规则来源于专家系统的知识和毒理学试验的结果,如DEREK。
基于统计学方法:由一组化合物的生物学和毒理学数据进行统计学分析预测,建立模型,再自动生成化学结构及所引发毒性作用的量化关系,预测待测物毒性。如Sarah Nexus。
5、基毒杂质的控制策略
基毒杂质的控制的基本策略是A-C-E(Avoid-Control-Expel),即避免基毒杂质生成、控制基毒产生和将基毒清除出产物。
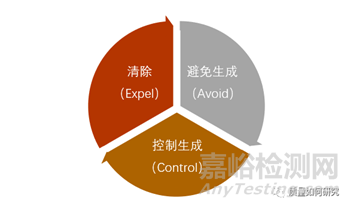
1、通过改变原料、试剂及投料顺序可以避免生成基毒杂质;
2、通过反应机理的研究(如温度、时间、pH等)可以控制基毒杂质的生成;
3、通过后处理(如萃取、结晶、干燥等)可以去除已生成的基毒杂质。
在ICH M7中主要列举了以下四种控制策略:
原料药质量标准中控制在可接受限度以下,即终点控制。
起始物料或中间体标准或中控过程中控制在可接受限度以下,即原料或过程控制。
起始物料或中间体标准或中控过程中控制在可接受限度以上,明确杂质去向,结合加标试验的清除率,确保在成品中残留量小于可接受限度的30%以下。
充分理解工艺参数和影响杂质残留因素,能确保在成品原料药中的残留在可接受限度以下,无需检测,也不订入任何标准。如基于理化性质(反应活性,溶解性、挥发性等)的分析。
6、基毒杂质的控制方法
杂质控制的目的是为了保障患者的安全。同时杂质的毒性是与剂量息息相关的,基毒杂质也不例外。由于生物系统存在自我修复和纠正的功能,使得我们无法直接通过试验(如剂量从低到高,对其影响性进行线性推断)获得某个杂质的毒性阈值。
因此,对于基毒杂质的控制需要确定一个可接受其风险的摄入量------毒理学关注阈值(Threshold of Toxicological Concern,TTC)
TTC的定义是针对所有化学物质的一个暴露水平,当低于该水平时,无论是否获得化学特异性的毒性数据,在终生服用的情况下对人体健康都不会产生明显的危害。换句话说就是每天摄入1.5微克的基因毒性杂质,被认为对于大多数药品来说是可以接受的风险。因为它使得人一生的致癌风险小于十万分之一。而现实生活中,人一生得癌症的概率是四分之一。
对于TTC,我们需要说明的是:
1)TTC它是一个风险管理工具,采用的是概率的方法,不能被理解为是绝对无风险的保障。
2)致癌性明确的杂质需进行特殊的风险评价,TTC 法并不适用。有几个结构基团被认定为具有非常高的基因毒性,它们即使被摄入低于TTC值的量也会面临非常高的基因毒性风险。如黄曲霉毒素类、N-亚硝胺类、烷基偶氮化合物类等。
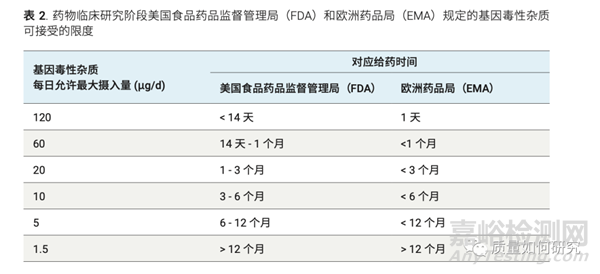
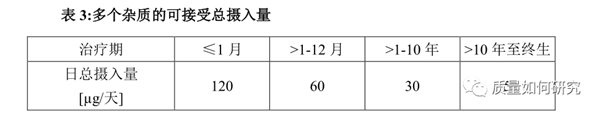
3)结构不同的单个杂质的限度应该小于1.5微克/天。有相同作用机制、结构相似的杂质,其含量总和的限度仍应该参考1.5微克/天的限量进行评估(见表2)。而多个作用机制不同的基因毒性杂质可摄入总量则可应参考表3。

4)在某些特定情况下,TTC值高于1.5微克/天也是可以接受的。例如:
药物的短期接触,即治疗某些生命预期在5年以下的某些严重疾病。
它是一种已知物质,人类在其他方式上对它的摄入量会更高(如食品、环境中)。
它是一种体内代谢物,对它的评价也要以代谢物的可接受程度为基础。
7、基毒杂质的限度计算
第一种:具有阳性致癌数据的诱变杂质。如半数致癌剂量TD50,线性外推来计算可接受摄入量(AI,acceptable intake)
计算公式:

第二种:基于TTC控制的杂质限度计算。TTC=1.5ug/day,短期暴露可适当提高。
计算公式:

第三种:有实际阈值证据的诱变性杂质。使用不确定因子,参考ICH Q3C计算允许日暴露量 (Permit Daily Expourse,PDE)。
计算公式:

其中,公式中各校正因子的规定如下:
F1是考虑物种间差异的因子
F1=5,适用于从大鼠外推到人
F1=12,适用于从小鼠外推到人
F1=2,适用于从犬外推到人
F1=2.5,适用于从家兔外推到人
F1=3,适用于从猴外推到人
F1=10,适用于从其他动物外推到人
F2=10,考虑个体差异的因子
所有有机溶剂一般取因子10。
F3是考虑短期暴露的毒性研究的可变因子
F3=1. 研究时间至少为动物寿命一半(啮齿动物或兔为1年,猫、狗和猴为7年)
F3=1. 涵盖整个器官形成期的生殖研究
F3=2,为期6个月的啮齿动物研究,或为期3.5年的非啮齿动物研究
F3=5. 为期3个月的啮齿动物研究,或为期2年的非啮齿动物研究
F3=10. 持续时间更短的研究
在所有情况下,对研究时间介于上述时间点之间的研究应用较大的因子,如对为期9个月的啮齿类动物毒性研究采用因子2。
F4是在诸如非遗传毒性致癌性、神经毒性或致畸性等严重毒性的情况下可应用的因子。
在生殖毒性研究中采用以下因子:
F4=1,与母体毒性有关的胎儿毒性
F4=5, 无母体毒性的胎儿毒性
F4=5, 有母体毒性的致畸反应
F4=10,无母体毒性的致畸反应
F5是未确定无反应水平时可应用的可变因子
在只有LOEL可用时,根据毒性的严重程度,可以使用高达10的因子。
体重调整假设任何成年人的体重为 50kg(不论性别)。
相对于这类计算中常用的60kg 或70kg 标准体重,较小的体重提供了额外的安全因子。有些成年患者体重小于50kg。在确定PDE时,对这些患者应考虑对固有的安全因子进行调整。
最后,补充一张ICH M7中公布的有特定阈值的杂质列表。
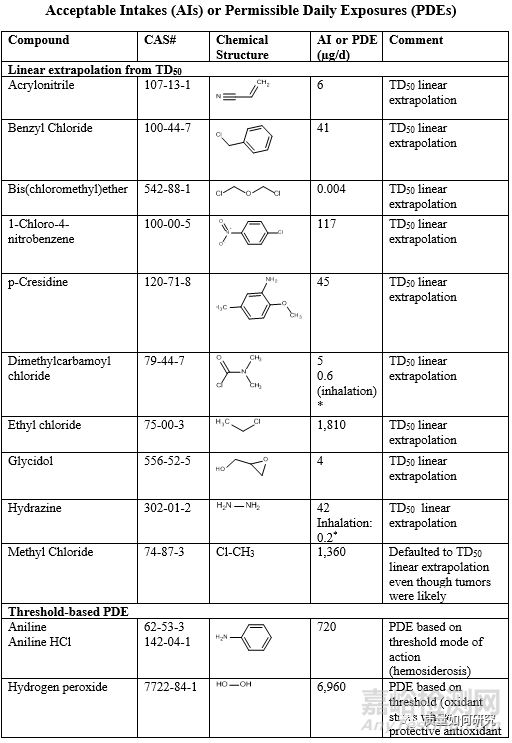
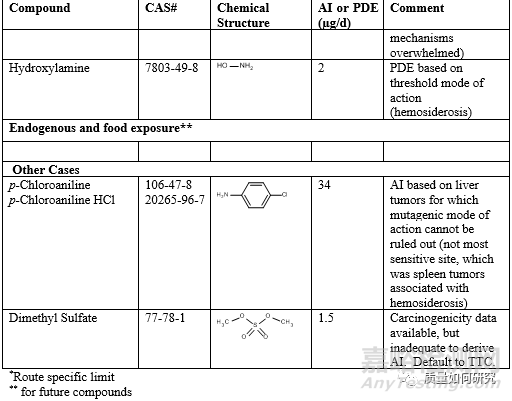

来源:Internet


