您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-18 08:17
引言
药物中的基因毒性杂质(Genotoxic Impurities, GTI)因其可能直接损伤DNA并诱发突变或癌症,成为药物安全监管的核心问题。其中,肼类化合物(如肼、酰肼、腙)因具有明确的基因毒性警示结构(图1),被国际监管机构列为高风险致突变杂质。本文将从肼类杂质的来源、风险评估方法、控制策略及分析技术进展等方面展开综述,结合国际指南与最新研究进展,为药物研发与质量控制提供科学依据。
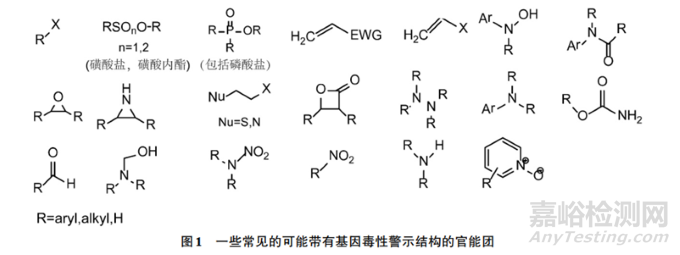
一、肼类致突变杂质的特性与来源
1. 化学特性与致突变机制
肼类化合物(结构见图2)具有强亲核性和还原性,易与DNA碱基发生烷基化反应,生成稳定的加合物。研究表明,肼在体内代谢可产生活性甲基中间体(如碳正离子、自由基),直接攻击DNA的鸟嘌呤位点,导致碱基错配或链断裂。例如,抗结核药物异烟肼的水解产物肼,已被证实可通过氧化应激和DNA甲基化双重机制诱导肝细胞癌变。
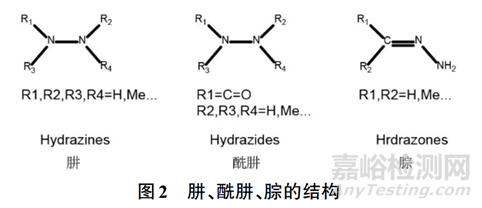
2. 主要来源
肼类杂质的产生途径多样:
合成工艺引入:如抗糖尿病药物西格列汀的合成需肼作为缩合剂,抗肿瘤药舒尼替尼的生产中肼作为还原剂;
降解产物:异烟肼、肼屈嗪等药物在储存过程中易水解生成游离肼;
交叉污染:起始物料或溶剂中残留的肼类试剂可能迁移至终产品。
二、风险评估框架与监管要求
1. 毒理学关注阈值(TTC)的阶段性应用
国际监管机构(EMA、FDA)基于致癌风险理论,提出阶段性TTC标准(表1),允许短期用药时杂质摄入量适度放宽。例如,用药周期≤1个月时,肼类杂质的日摄入限值为60 μg,而长期用药(>12个月)需严格控制在1.5 μg/天以下。
表1 EMA与FDA对基因毒性杂质的阶段性控制标准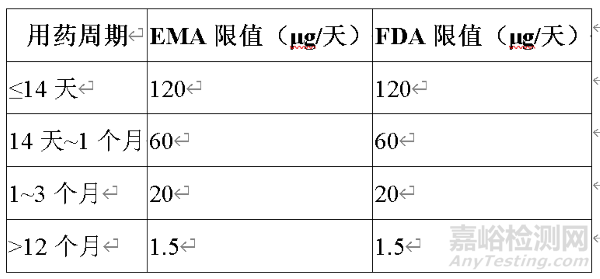
2. “高关注队列”的特殊处理
FDA在ICH M7指南中明确,肼类化合物属于“高关注队列”(Cohort of Concern),其致癌风险显著高于普通GTI,需采用更低限值或完全避免。例如,N-亚硝基肼类杂质(如NDMA)的TTC需降至0.096 μg/天。
三、控制策略与技术进展
1. 工艺优化与替代试剂开发
替代合成路线:采用非肼类试剂(如硼烷络合物)替代肼参与缩合或还原反应,从源头减少杂质生成。例如,西格列汀的绿色合成工艺通过酶催化避免了肼的使用;
纯化工艺强化:利用肼类化合物的极性特性,通过结晶、离子交换色谱等手段提高去除效率。研究表明,阳离子交换树脂对游离肼的去除率可达99.5%以上。
2. 分析技术的突破
肼类杂质因极性大、无紫外吸收等特点,传统HPLC检测灵敏度不足。近年来,衍生化结合LC-MS/MS成为主流方法:
苯甲醛衍生法:将肼转化为强紫外吸收的苯甲醛腙,检测限低至0.02 ppm;
丙酮衍生-GC/MS法:适用于挥发性肼类杂质,灵敏度达0.1 ppb。
案例:塞来昔布中痕量肼类杂质的检测采用C18柱与乙酸铵缓冲体系,成功分离4-氨磺酰基苯肼(SHH)与API,定量限为0.06 ppm,回收率95%~104%。
四、挑战与未来方向
1. 检测灵敏度的瓶颈
当前技术对痕量肼类杂质(<1 ppm)的检测仍依赖高分辨率质谱,设备成本高昂。微型化传感器与人工智能算法的结合可能成为突破方向。
2. 监管协调与标准统一
各国对肼类杂质的限值要求存在差异(如EMA允许阶段性TTC,而日本PMDA更强调工艺验证),需推动ICH M7指南的全球实施。
3. 绿色化学的整合
开发无肼合成工艺(如光催化、电化学合成)是根本解决方案。例如,辉瑞公司通过流动化学技术实现了抗HIV药物沙奎那韦的肼解工艺替代。
结语
肼类致突变杂质的控制是药物安全的核心挑战之一。通过工艺优化、高灵敏度分析技术及国际化监管协作,可有效降低其致癌风险。未来,随着绿色合成与精准检测技术的进步,药物中基因毒性杂质的管理将迈向更高水平。
参考文献
[1] 刘爱赟,袁永兵,靳文仙,等.药物中肼类基因毒性杂质分析研究进展[J].药物评价研究, 2020, 43(2), 356-360.
[2] 胡克荣,陈瑞,班玉娟,等.基因毒性杂质的控制策略及其在HPLC-MS中的应用[J].药物化学, 2022, 10(3), 247-256.
[3] M7(R2) Assessment and Control of DNA Reactive (Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk Guidance for Industry.
[4] Nagato, Yusuke , et al. "Meeting Report of the Technical Education Committee Symposium: Management of DNA reactive (mutagenic) impurities in drug development." PDA Journal of GMP and Validation in Japan 23.1(2021):1-12.

来源:药事纵横


