您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-14 19:58
冷冻电镜在生物医学中的应用
冷冻电镜技术在生物医学中发挥了很大的作用,利用该技术能够得到生物大分子的原子解析度结构,从而能够对其进行解析,这对于了解生命体的微观活动具有重要意义。具体来说,冷冻电镜主要用于对病毒、细胞及细胞内的微观结构、大分子复合物进行高解析度剖析,如对病毒进行三维重建。
对病毒进行三维重建的研究有很多,其中一个范例是利用冷冻电镜对哺乳动物呼肠孤病毒(mammalian orthoreovirus ,MRV)MPC/04株进行三维重建。MRV可从很多哺乳动物身体里得到,是无囊膜病毒的范例,对该病毒进行研究能够对病毒入侵、复制的过程和其致病的原理有一个更深入的了解。近年来由于生物科学尤其是冷冻电镜单颗粒重构技术快速成熟,实现了能够得到天然状态下有着超高解析度的病毒的空间结构,有关研究者通过冷冻电镜技术中的单颗粒三维重构的方法剖析了一株分离于果子狸的3型呼肠孤病毒的空间结构。第一步要探究该种病毒主要结构蛋白的彼此影响方式,而后与已知的同源病毒结构信息进行对比分析探讨病毒结构的主要构成,深入探究病毒的入侵过程和病毒疫苗的研制。经过艰苦的努力,研究者得到了具有完整结构和较高纯度的均一性良好的呼肠孤病株病毒粒子,利用冷冻电镜单颗粒重构的方法第一次得到了解析度为9 Å的该病毒的空间结构ꎮ并推断出了该病毒σ1蛋白的二级结构,初次剖析了其N端部分结构。该项研究还发现MPC/04株病毒和人源MRVT3D有着十分显著的相似性。
冷冻电镜技术在药物筛选中的应用
技术进步使得冷冻电镜能够分辨包括小分子的复合物等体积更小、分辨率更高的物体,大型动态复合物和膜蛋白等不适合结晶的蛋白也得益于单颗粒冷冻电镜的发展而有了其高分辨结构。
1、膜蛋白GPCRs的研究
(1)G蛋白偶联受体
G蛋白偶联受体(G protein-coupled receptors,GPCRs)是最丰富的细胞表面受体蛋白,并且被市场上30%的药物所靶向2。尽管GPCR 的X射线晶体学研究取得了重大进展,但由于需要获得高质量晶体和纯化过程中相对较低的稳定性,X射线对该家族的一些成员仍然难以应付3。冷冻电镜解决了以前构象不稳定且不能结晶的大复合物无法成像的问题,并且可以确定 GPCRs的不同构象以及与G蛋白复合物的结构,从而用于配体筛选或设计药物。2016年,单颗粒冷冻电镜解析了第一个 GPCR的冷冻电镜结构(4.1 Å),确定了激活状态下鲑降钙素、G蛋白和人降钙素受体(B类 GPCR)的异源三聚体结构4。此后不久,结合兔胰高血糖素样肽(glucagon-like peptide 1, GLP1)、G蛋白和 GLPI受体(B类GPCR)4.1 Å 的冷冻电镜结构被解析,解释了B类受体如何通过激素活化结合。人类GLPI受体结合的激动剂和G蛋白异源三聚体的3.3 Å的冷冻电镜结构,给出了偏向激动作用(biased agonism)的见解。最近这些 GLP1 受体结构也被解析出来,打破了分子量为150kD时这种重要的药物靶点几乎不可能在近原子分辨率下使用冷冻电镜成像的假说。这些侧链清晰可辨的结构可帮助解决更高分辦率 GPCR 蛋白复合物的解析,同时也可帮助设计治疗 II 型糖尿病和肥胖症的新药。
(2)Y-分泌酶
科学家尝试将 Y-分泌酶作为潜在的药物靶标,因为Y-分泌酶不仅是早发性阿尔茨海默病患者身体中促进患者大脑中淀粉样斑块形成的原因,同时在癌症的形成方面扮演 Notch 信号传导的关键介质。在分辨率3.4 Å的y-secretase的冷冻电镜结构中发现,四跨膜束内核的两个热点突变削弱了蛋白酶活性,从而引起早发性阿尔茨海默病,这个原子模型可以帮助设计更具选择性的化合物。值得注意的是,Y-secretase 糖基化对冷冻电镜数据集的结构重建几乎没有影响,而它却可能妨碍X射线的结晶5。
(3)离子通道
在过去的4年里冷冻电镜约解析出50个感受器电位(transient receptor potential, TRP)通道蛋白的冷冻电镜结构。TRP通道晶体由于其在细胞中基因表达水平低和对物化刺激敏感的特性,在历史上获得良好衍射的TRP通道晶体非常困难。结合激动剂的瞬时受体电位香草受体 1(transient receptor potentical vanilloid subfamily member 1, TRPV1)(2.9 Å)6,TRPMI3(2.9 Å)7和 TRPM4(2.9 Å)8结构是目前为止由冷冻电镜解析的膜蛋白的最高分辨率结构。与此同时,冷冻电镜在研究大离子通道复合物方面也同样做出巨大贡献,如Ryano-dine 受体(RyRs)910 。这些解析出来的离子通道蛋白结构,将成为药物设计的重要靶点,同时也再次证明了冷冻电镜技术的强大。
(4)ATP 结合蛋白(ABC)转运蛋白
X射线衍射难以处理的其他膜蛋白复合物,冷冻电镜同样能够给出其结构。例如,解析并阐明真核 ABC转运蛋白多药耐药相关蛋白1(multi-drug resistance-associated protein 1, MRP1)识别底物以及底物结合如何刺激 ATP 水解的机制11。ABC转运蛋白在多种药物的吸收、分布、代谢和消除中发挥关键作用,可导致药物相互作用,因此,有关其结构的信息可能对药物开发同样具有重要价值。
2、抗体和疫苗
近年来,负染和冷冻电镜已用于抗体的线性和构象表位作图以分析阐明单克隆抗体(mAb)的活性从而理解潜在生物治疗剂作用机制。最近,Long12等使用冷冻电镜阐明了病毒中和人 mAb 是如何结合病毒样颗粒,并阻断病毒和宿主膜融合的机制。Ciferri13等使用负染技术研究与 HTRA1(一种与年龄相关的黄斑变性有关的丝氨酸蛋白酶)形成独特复合物并抑制其酶活性的抗体的结构。该研究突出了IgG-HTRA1复合物的笼状结构,其较不紧凑的螺旋桨状排列,具有比 Fab 对应物更高的效力。最新的冷冻透射电镜技术更可以通过表位作图的方式对mAb 设计的辅助功能更上一层楼,冷冻电镜技术关于促进抗体和疫苗研究的报道还有很多,由此可见这类技术在药物筛选方面的巨大推力。
冷冻电镜在化工方向(锂电池材料)中的应用
锂离子电池由正极、负极、集流体、电解质组成,内部存在各种界面,了解这些界面纳米结构如何随电池工况的演变是电池研究中的难题,冷冻电镜技术正好可以进行应用。
在快速冷冻下,电池材料就能保持原始的电化学状态。斯坦福大学崔屹等人利用这一技术发现在两种不同的电解质中,锂金属表面上会形成两种不同的界面纳米结构。Men等人利用冷冻电镜观察到了非晶态的锂金属结构,Kourkoutis等人将冷冻电镜与EELS相结合,发现电池运行过程中会产生大量的LiH,并成功绘制出电解质中Li的液/固界面。固态电解质薄膜对锂离子电池的安全运行至关重要,从正极溶解的金属离子(例如Ni2+、Mn2+)会造成容量损失,借助冷冻电镜和EELS技术,研究者就可以精确定位SEI中这些金属离子的空间分布,并揭示负极相间结构和化学成分的局部变化。锂硫电池中的穿梭效应会造成容量衰减,Nazar和崔毅等人利用冷冻电镜技术研究了多硫化物在正极处的溶解过程,建立了SEI的结构-性能的关系。
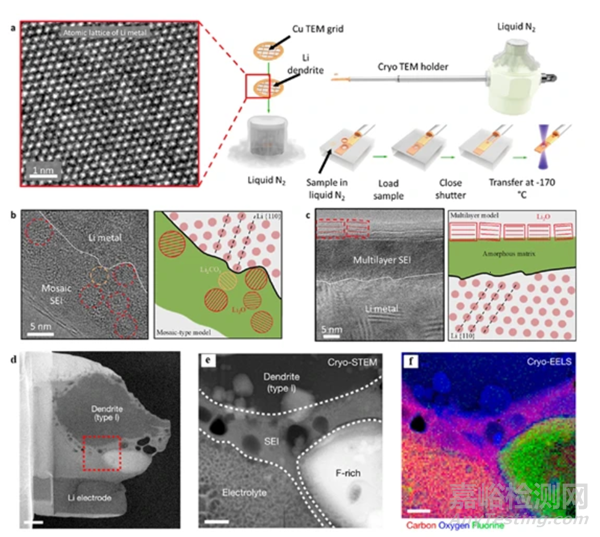
图. 冷冻电镜在电池材料中的应用。(a)锂金属原子分辨率冷冻电镜图像和低温传输过程示意图;在不同电解质中观察到的(b)固态电解质膜(SEI)和(c)多层SEI的冷冻电镜图像;(d)电子透明的低温聚焦离子束抬升;(e)电池内部固液界面处的冷冻电镜图像;(f)电子能量损失谱(EELS)显示出界面处碳、氧和氟元素分布15
资料来源:
[1] 张晓凯,张丛丛,刘忠民,刘力嘉,夏蕾.冷冻电镜技术的应用与发展[J].科学技术与工程,2019,19(24):9-17
[2]Zhang Y, Sun B F, Feng D, et al. Cryo-EM structure of the activated GLP-1 receptor in complex with a G protein J. Nature, 2017,546(7657) : 248-253
[3]Renaud J P, Chari A, Ciferri C. CryoEM in drug discovery:Achievements, limitations and prospects [J]. Nature Reviews Drug Discovery, 2018, 17: 471-492
[4]Liang Y L, Khoshouei M, Radjainia M, et al. Phase-plate cryo-EM structure of a class B GPCR-G-protein complex|JJ. Nature, 2017,546(7656) : 118-123
[5]Bai X C, Yan CY, Yang G H, et al. An atomic structure of human gamma-secretase |J]. Nature, 2015, 525(7568) : 212-217
[6]Gao 1, Cao E, Julius D, et al. TRPV1 structures in nanodises re-veal mechanisms of ligand and lipid action [J]. Nature, 2016, 534(7607) : 347-351
[7]Hirschi M, Herzik Jr M A, Wie J H, et al. Cryo-electron microsco-py structure of the lysosomal calcium-permeable channel TRPML3[JJ. Nature, 2017, 550 (7676) : 411414
[8]Guo JT, She J, Zeng W Z, et al. Structures of the calcium-activa-ted, non-selective cation channel TRPM4_JJ. Nature, 2017, 552(7684) : 205-209
[9]Yan Z, Bai X C, Yan CY, et al. Structure of the rabbit ryanodine receptor RyR1 at near-atomic resolution [J]. Nature, 2015, 517(7532) : 50-55
[10]Georges A, Clarke O B, Zalk R, et al. Structural basis for gating and activation of RyR1[J]. Cell, 2016, 167(1) : 145-157
[11]Johnson Z L, Chen J. Structural basis of substrate recognition by the multidrug resistance protein MRP1 LJJ. Cell, 2017, 168 (6) :1075-1085
[12]Long F, Rachel H, Austin F S K, et al. Cryo-EM structures elucidate neutralizing mechanisms of anti-chikungunya human monoclonal antibodies with therapeutic activity [C]// Proceedings of the [13]National Academy of Sciences of the United. Washington DC, USA: National Academy of Sciences, 2015, 112(45) : 13898-13903
[14]Ciferri C, Lipari MT, Liang W C, et al. The trimeric serine protease HtrAl forms a cage-like inhibition complex with an anti-HtrAl antibody | J]. Biochemical Journal, 2015, 472(2) : 169-181
[15]崔屹《ACS Nano》综述:教你玩转“冷冻电镜”_腾讯新闻 (qq.com)

来源:和义广业创新平台


