您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-23 20:14
摘 要: 建立高效液相色谱-质谱法测定淡水鱼中地西泮。样品用乙腈提取,采用Florisil填料和氨基填料净化,当Florisil填料和氨基填料的质量比为2∶3时,能够有效地吸附淡水鱼基质中的脂肪、脂质和蛋白质等杂质,降低基质效应,提高质谱响应的信噪比。地西泮的质量浓度在0.05~20 ng/mL范围内与色谱峰面积线性关系良好,相关系数为0.999 6,检出限为0.15 μg/kg,定量限为0.5 μg/kg。空白样品加标回收率为84.2%~95.5%,测定结果的相对标准偏差为5.25%~6.83%(n=6)。该方法快速准确,基质效应小,能够满足水产品中地西泮的测定要求。
关键词: 高效液相色谱-质谱法; 淡水鱼; 地西泮; 基质效应
地西泮又名安定,属抗焦虑药,常用于治疗焦虑、失眠、癫痫等疾病,具有致癌性,被世界卫生组织列入3类致癌物清单中[1‒2]。在渔业养殖中,地西泮可以降低鱼类对外界的感知能力,减轻鱼体的环境压力,降低新陈代谢,保证其经过长时间运输后仍然鲜活,但是地西泮在鱼体内的残留会通过食物链传递给人类[3]。地西泮会引起人体嗜睡疲乏、行为失调,严重者还可能出现心律失常、昏迷等症状,具有一定的依赖性[4‒5]。
早在2002年,农业部第235号公告《动物性食品中兽药最高残留限量》规定,地西泮可以作为治疗用药,但在动物性食品中的质量分数不得大于0.5 μg/kg,2020年,GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》也作出了同样的规定,但是近年来地西泮的非法使用情况呈现上升势头,鉴于地西泮的毒性,国家和各省市的水产品监管部门也将地西泮列入了重点监控的药物。
水产品中地西泮测定的国家标准方法主要有SN/T 3235—2012《出口动物源食品中多类禁用药物残留量检测方法 液相色谱-质谱/质谱法》和GB 29697—2013《食品安全国家标准 动物性食品中地西泮和安眠酮多残留的测定 气相色谱-质谱法》,上述两个标准方法的检出限均为0.5 μg/kg,能够满足动物性食品中地西泮的判定要求,但是样品处理步骤均较为繁琐,且在质谱测定时存在基质效应,特别是水产品中的脂肪、蛋白质等共提取物在质谱分析时会对地西泮的色谱峰形和响应值造成较大影响,从而影响了最终的准确定量[6]。为了全面考察质谱法测定淡水鱼过程时地西泮的基质效应,笔者采用目前主流的高效液相色谱-质谱仪,针对不同的净化填料,系统研究了不同种类淡水鱼中的基质效应,并筛选出最优的净化填料组合,建立了快速准确、基质效应干扰较小的水产品中地西泮的测定方法,为水产品中地西泮的有效监管奠定了技术基础。
1、 实验部分
1.1 主要仪器与试剂
高效液相色谱-三重四极杆质谱仪:ExionLC AD,Triple Quad 4500型,美国爱博才思公司。
电子天平:(1) SQP型,感量为0.01 mg,赛多利斯科学仪器(北京)有限公司;(2) ME204E型,感量为0.1 mg,瑞士梅特勒-托利多仪器有限公司。
乙腈、甲醇:均为色谱纯,德国默克公司。
NaCl、无水MgSO4:均为分析纯,国药集团化学试剂有限公司。
乙酸铵、甲酸:均为质谱纯,中国迪马科技有限公司。
C18填料、PSA填料、氨基填料、Florisil填料、GCB填料:粒径均为50 µm,中国迪马科技公司。
MWCNTs、COOH-MWCNTs、NH-MWCNTs、OH-MWCNTs填料:粒径均为50 nm,江苏先丰纳米材料科技有限公司。
氮气:纯度(体积分数)为99.999%,昆明泰瑞佳气体有限公司。
地西泮标准溶液:100 μg/mL,坛墨质检标准物质中心。
鲤鱼、草鱼、罗非鱼等淡水鱼样品:市售。
1.2 仪器工作条件
1.2.1 色谱仪
色谱柱:ACQUITY UPLC BEH C18柱(50 mm×1 mm,1.7 µm,美国沃特世科技有限公司);流动相:A相为甲醇,B相为含0.1% (体积分数,下同)甲酸的1 mmol/L乙酸铵溶液;洗脱方式:梯度洗脱;洗脱程序:0~3.0 min 时A相体积分数由5%变为40%,3.0~6.0 min 时A相体积分数由40%变为95%,6.0~8.0 min 时A相体积分数保持为95%,8.0~8.2 min 时A相体积分数由95%变为5%,8.2~11.0 min 时A相体积分数保持为5%;流动相流量:200 μL/min;柱温:35 ℃;进样体积:1 μL。
1.2.2 质谱仪
监测模式:ESI正离子多反应监测(MRM)模式;气帘气:氮气,流量为20 L/h;雾化气:氮气,流量为55 L/h;辅助气:氮气,流量为55 L/h;辅助加热气温度:550 ℃;喷雾电压:5 500 V。
地西泮的质谱参数参照SN/T 3235—2012,并根据实验室仪器条件进行相应的优化,地西泮的定量离子对为m/z 285.2/154.0,去簇电压为30 V,碰撞电压为37 V;定性离子对为m/z 285.2/193.0,去簇电压为30 V,碰撞电压为38 V。
1.3 样品处理
淡水鱼样品经高速匀浆机充分粉碎匀浆均匀后,准确称取2.00 g样品于50 mL离心管中,加入20 mL乙腈,涡旋提取5 min,加入5.0 g NaCl,涡旋1 min,以5 000 r/min转速离心3 min,取上清液2 mL于10 mL离心管中,加入200 mg无水硫酸镁、20 mg Florisil填料和30 mg 氨基填料,涡旋提取10 s,以5 000 r/min转速离心3 min,上清液经0.22 μm微孔滤膜过滤,作为样品溶液。同法制备阴性样品溶液。
1.4 基质效应
基质效应的测定方法和评判标准参照文献[7]中的方法,其计算公式如下:
EM=图片%
式中:EM——基质效应;
Sm——基质校准曲线线性方程斜率;
Ss——溶剂标准曲线线性方程斜率。
当基质效应小于0时,表示基质抑制效应;当基质效应大于0时,表示基质增强效应;当基质效应的绝对值为0%~20%时为弱基质效应;当基质效应的绝对值为20%~50%时为中等基质效应;当基质效应的绝对值大于50%时为强基质效应[7]。
1.5 溶液配制
地西泮标准储备溶液:10 μg/mL,吸取地西泮标准溶液1 mL,用甲醇稀释、定容,于4 ℃避光保存,有效期为6个月。
地西泮标准中间液:100 ng/mL,吸取地西泮标准储备溶液0.1 mL,用甲醇稀释、定容,于4 ℃避光保存,有效期为3个月。
地西泮系列标准工作溶液:取适量地西泮标准储备溶液,用乙腈稀释、定容,制得质量浓度分别为0.5、1.0、5.0、10.0、20.0 ng/mL的系列标准工作溶液。
样品基质系列校准溶液:分别吸取地西泮标准中间液0.005、0.01、0.05、0.1、0.2 mL,用氮气吹干,分别加入1 mL阴性样品溶液,混匀后过0.22 μm滤膜,制得质量浓度分别为0.5、1.0、5.0、10.0、20.0 ng/mL的系列校准溶液。
1.6 样品测定
按照1.2仪器工作条件,分别测定样品基质系列校准溶液和淡水鱼样品溶液,根据基质校准曲线计算样品中地西泮的含量。
2、 结果与讨论
2.1 色谱条件优化
地西泮化学结构中含有1,4-苯二氮的环状结构,质谱电离时,苯二氮基团易在正离子模式下产生M+H峰[8]。为了提高正离子模式下的电离强度,通常在流动相中加入一定比例的H+以促进化合物的电离,NH₄⁺的加入可以将流动相环境调整为弱酸性,也能够抑制M+K和M+Na峰的产生,促进M+H峰的产生[9‒10]。在色谱分析时,出峰较早的物质中常含有蛋白质、氨基酸等强极性物质,对地西泮的响应值会产生较大的影响[11],通过优化色谱系统条件,在0~3.0 min时,采用5%~40% (体积分数,下同)的甲醇溶液进行洗脱,可以有效地将强极性的干扰物质充分洗脱,在3.0~6.0 min时,将甲醇体积分数从40%缓慢升至95%,地西泮在5.5 min左右出峰,可有效避免大极性杂质以及后续出峰的小极性物质的干扰。色谱条件优化结果见1.2.1。
2.2 净化填料类型选择
不同净化填料对地西泮及共提取物的净化作用不同,为了系统地研究地西泮测定时的基质效应,根据淡水鱼的类型,选取具有代表性的草鱼、鲤鱼和罗非鱼作为研究对象,分别选取C18、氨基、PSA、GCB、Florisil 5种常见填料,以及MWCNTs及其修饰后的NH-MWCNTs、COOH-MWCNTs、OH-MWCNTs填料,按照1.4中基质效应评价方法,考察使用不同净化填料时的基质效应[12‒14],草鱼、鲤鱼和罗非鱼的基质效应如图1所示。由图1可以看出,氨基填料和Florisil填料的效果相对较好,基质效应均小于20%,达到了较好的净化效果。
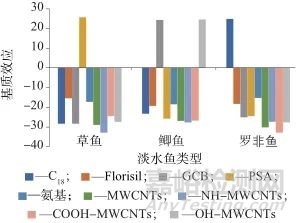
图1 不同净化填料时的基质效应
Fig. 1 Matrix effect of different purification fillers
通过对氨基填料和Florisil填料化学结构进行分析,氨基填料中具有强氢键碱和弱氢键酸,偶极相互作用较弱,能够有效地吸附脂肪等低极性的物质[15],Florisil填料是一种硅镁吸附剂,对脂肪、脂质和蛋白质等杂质具有较好的去除效果[16‒17],氨基填料和Florisil填料对水产品中的杂质干扰物质均有较好的吸附效果,但是对于地西泮却没有明显的吸附作用,图2为草鱼样品提取液净化前后的色谱图。
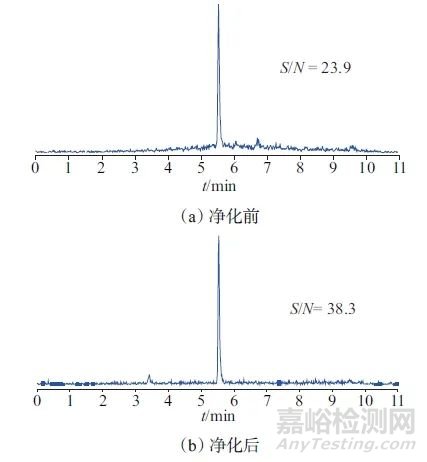
图2 草鱼样品提取液净化前后的色谱图
Fig. 2 Chromatograms of grass carp sample extract before and after purification
由图2可以看出,未净化的提取液地西泮出峰位置的基线较高,而净化后的提取液基线较低,且净化后的信噪比提高1.5倍左右,有效提高了检测的灵敏度。综上所述,选择氨基填料和Florisil填料组合作为净化填料。
2.3 净化填料配比选择
为了达到较好的净化效果,将上述净化效果较好的Florisil填料和氨基填料进行不同比例的混合,考察其净化效果。当Florisil填料和氨基填料的总质量为50 mg时,比较Florisil填料和氨基填料的质量比分别为1∶4、2∶3、1∶1、3∶2、4∶1时的净化效果,结果如图3所示。由图3可以看出,在草鱼和鲤鱼样品中,当Florisil填料和氨基填料的比例为2∶3时其基质效应均最小;在罗非鱼样品中,随着氨基填料含量的减小,基质效应呈现出不断增加的趋势。综合考虑,选择Florisil填料和氨基填料的质量比为2∶3。
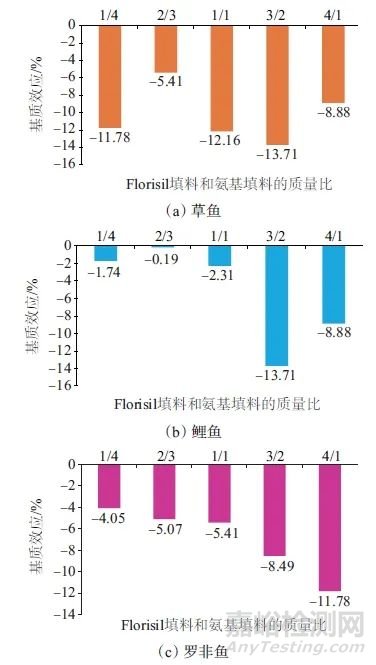
图3 Florisil填料和氨基填料不同质量比时的基质效应
Fig. 3 Matrix effect of Florisil filler and amino filler at different mass ratios
2.4 线性方程和检出限
在1.2仪器工作条件下,测定样品基质系列校准溶液,以地西泮的质量浓度为横坐标(x),以对应的色谱峰面积为纵坐标(y),绘制校准曲线,计算得线性方程为y=15 300x-1 440,相关系数为0.999 6,表明地西泮的质量浓度在0.05~20 ng/mL范围内与色谱峰面积线性关系良好。
采用不含地西泮的空白样品,添加一定量的地西泮标准储备溶液,按照1.3方法进行样品处理,在1.2仪器工作条件下测定,并逐级降低地西泮的质量浓度,分别以3倍和10倍信噪比对应的质量浓度作为方法检出限和定量限,根据称样质量和定容体积换算成样品中的含量,以质量分数表示,得检出限为0.15 μg/kg,定量限为0.5 μg/kg,满足水产品中地西泮残留的检测要求。
2.5 加标回收与精密度试验
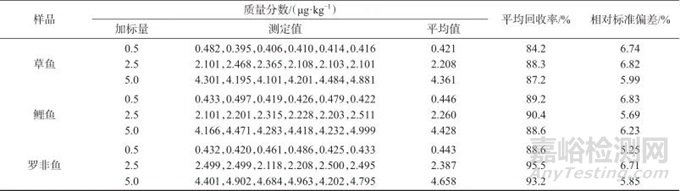
根据地西泮的定量限结果,分别以0.5、2.5、5.0 μg/kg作为低、中、高3种加标水平对空白样品进行加标回收与精密度试验,每个加标水平分别进行6次平行测定,结果见表1。由表1可知,地西泮的平均回收率为84.2%~95.5%,测定结果的相对标准偏差为5.25%~6.83%,表明该方法准确度和精密度均较高,满足实验室日常检测要求。
表1 加标回收与精密度试验结果
Tab. 1 Results of spiked recovery and precision testing
3、 结语
选取草鱼、鲤鱼和罗非鱼作为代表性水产品,采用氨基填料和Florisil填料能够有效地吸附脂肪、脂质和蛋白质等杂质,建立了高效液相色谱-质谱法测定淡水鱼中地西泮。该方法可以降低基质效应并提高质谱响应值,操作简便,灵敏度高,可为地西泮的有效监管提供方法支撑。
参考文献:
1 白淑艳,黄丽,李晨辉,等.地西泮在鲫鱼不同组织中的残留消除规律研究[J].食品安全质量检测学报,2023,14(15):71.
BAI Shuyan,HUANG Li,LI Chenhui,et al. Study on the elimination of diazepam residues in different tissues of Carassius auratus[J]. Journal of Food Safety and Quality,2023,14(15):71.
2 KAWANO T,OSHIBUCHI H,KAWANO M,et al. Diazepam suppresses the stress-induced dopaminergic release in the amygdala of methamphetamine-sensitized rat[J]. European Journal of Pharmacology,2018,833:247.
3 宿书芳,孙立臻,薛霞,等.通过式固相萃取-超高效液相色谱-串联质谱法测定水产品中地西泮[J].色谱,2020,38(7):791.
SU Shufang,SUN Lizhen,XUE Xia,et al. Determination of diazepam in aquatic products by ultra performance liquid chromatography-tandem mass spectrometry with pass through solid phase extraction[J]. Chinese Journal of Chromatography,2020,38(7):791.
4 孙娟,沈媛,杨静,等.超高效液相色谱串联质谱法快速测定水产品中地西泮[J].中国渔业质量与标准,2023,13(4):1.
SUN Juan,SHEN Yuan,YANG Jing,et al. Determination of diazepam in aquatic products by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Fishery Quality and Standards,2023,13(4):1.
5 ABBASI F A,KUMAR V,ANWAR F. Biochemical and toxicological effect of diazepam in stress-induced cardiac dysfunctions[J]. Toxicology Reports,2020(7):788.
6 ARAUJO F G,BAUERFELDT G F,MARQUES M,et al. Development and validation of an analytical method for the detection and quantification of bromazepam,clonazepam and diazepam by UPLC-MS/MS in surface water[J]. Bulletin of Environmental Contamination Toxicology Reports,2019,103:362.
7 许晓敏,李凌云,林桓,等.基质效应对液相色谱串联质谱分析农药残留的影响研究[J].农产品质量与安全,2019(6):11.
XU Xiaomin,LI Lingyun,LIN Huan,et al. Influence of matrix effects on determination of pesticide residue by LC-MS/MS[J]. Quality and Safety of Agro-products,2019(6):11.
8 NAKAMURA M. Analyses of benzodiazepines and their metabolites in various biological matrices by LC-MS(/MS)[J]. Biomedical Chromatography,2011,25(12):1 283.
9 刘柏林,谢继安,赵紫微,等.固相萃取-超高效液相色谱-串联质谱法同时测定动物源性食品中11种禁限兽药及代谢物[J].色谱,2021,39(4):406.
LIU Bolin,XIE Ji′an,ZHAO Ziwei,et al. Simultaneous determination of 11 prohibited and restricted veterinary drugs and their metabolites in animal-derived foods by ultra performance liquid chromatography-tandem masss pectrometry coupled with solid phase extraction[J]. Chinese Journal of Chromatography,2021,39(4):406.
10 徐小民,张京顺,蔡增轩,等.在线液相色谱-二极管阵列检测器-串联质谱法检测野生菌中鹅膏毒肽和鬼笔毒肽[J].色谱,2017,35(6):613.
XU Xiaomin,ZHANG Jingshun,CAI Zengxuan,et al. Determination of amanitins and phallotoxins in wild mushrooms by online liquid chromatography-diode array detector-tandem mass spectrometry[J]. Chinese Journal of Chromatography,2017,35(6):613.
11 LALOUP M,RAMIREZ FERNANDEZ MDM,WOOD M,et al. Detection of diazepam in urine,hair and preserved oral fluid samples with LC-MS/MS after single and repeated administration of Myolastan® and Valium®[J]. Analytical and Bioanalytical Chemistry,2007,388(7):1 545.
12 WANG Sheng,LI Ming,LI Xiuqin,et al. A functionalized carbon nanotube nanohybrids based QuEChERS method for detection of pesticide residues in vegetables and fruits[J]. Journal of Chromatography A,2020,1631:461 526.
13 SUN Peng,GAO Yuling,XU Chong,et al. Determination of seven pyrethroid pesticide residues in vegetables by gas chromatography using carboxylated multi-walled carbon nanotubes as dispersion solid phase extraction sorbent[J]. Food Additives & Contaminants:Part A,2017,34(12):2 164.
14 CASTILLO M,GONZÁLEZ C,MIRALLES A. An evaluation method for determination of non-polar pesticide residues in animal fat samples by using dispersive solid-phase extraction clean-up and GC-MS[J]. Analytical and Bioanalytical Chemistry,2011,400(5):1 315.
15 CHUA S C,TAN C P,LAI O M,et al. Effect of absorbent in solid phase extraction on quantification of phospholipids in palm pressed fiber[J]. European journal of lipid science technology,2008,110(4):334.
16 XIANG Leilei,SONG Yang,BIAN Yongrong,et al. A purification method for 10 polybrominated diphenyl ethers in soil using accelerated solvent extraction-solid phase xxtraction[J]. Chinese Journal of Analytical Chemistry,2016,44(5):671.
17 ZHOU Huimin,HU Xialin,LIU Meichuan,et al. Benzotriazole ultraviolet stabilizers in the environment:A review of analytical methods,occurrence,and human health impacts[J]. TrAC Trends in Analytical Chemistry,2023,166:117 170.
引用本文: 林涛,蔡苇,王志飞,等 . 高效液相色谱-质谱法测定淡水鱼中地西泮[J]. 化学分析计量,2024,33(9):28. (LIN Tao, CAI Wei, WANG Zhifei, et al. Determination of diazepam in freshwater fish by high performance liquid chromatography-mass spectrometry[J]. Chemical Analysis and Meterage, 2024, 33(9): 28.)

来源:化学分析计量


