您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-12 09:56
生物负载,即初始污染菌,是指产品和(或)无菌屏障系统表面或内部存活微生物的总数。暴露于一个合理确认和精确控制的灭菌过程并不是保证产品无菌以符合其预期用途的唯一要素。为了灭菌过程的有效确认和常规控制,需要了解灭菌过程中存在的生物负载情况,包括微生物数量、特点和性质,从而为制定有效的微生物控制措施提供依据。
《医疗器械生产质量管理规范 附录 无菌医疗器械》对产品的生物负载控制给出了明确规定,要求根据产品质量要求确定产品的初始污染菌控制水平并形成文件,明确中间品的存储环境要求和存放时间,按文件要求定期检测并保持相关记录,同时要求定期对检测记录进行汇总和趋势分析。同时,也要求根据产品质量要求确定所采购初包装材料的初始污染菌可接受水平并形成文件,并对采购的初包装材料进行进货检验并保持相关记录。
为满足《医疗器械生产质量管理规范 附录 无菌医疗器械》的要求,无菌医疗器械生产企业宜制定产品生物负载的监测计划,并按照规定取样量和取样频率进行生物负载的常规测定。同时,应基于产品生物负载历史数据和数据使用目的规定产品的生物负载水平,包括警戒限和行动限,并确定生物负载超限时应采取的措施。另外,还应通过在一段时间内获得的生物负载数据来确认生物负载的变化趋势。
生物负载测定方法学层面,主要参照ISO 11737-1、GB/T 19973.1和YY/T 1737等标准进行方法开发和确认。在完成方法确认后,采用经确认的方法进行生物负载的常规测定。在方法开发时,可采用图1所示的决策树进行生物负载测定方法的选择。在方法确认时,首先应参考药典等文件进行方法适用性试验;其次,当生物负载测定法包括从产品中采集微生物时,应对采集和培养过程的生物负载回收率进行确认。应视产品上微生物数量的情况选择重复回收法或者产品接种法进行生物负载回收率确认试验。
图1 生物负载方法开发、确认和常规测定流程图
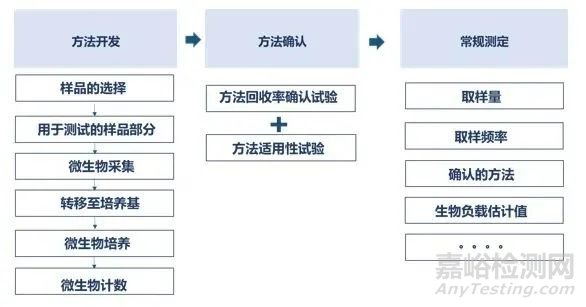
图2 生物负载测定方法选择决策树

来源:山东省器械检验院


