您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-30 09:43
摘 要: 通过高分辨质谱的测定与密度泛函理论方法的计算,揭示咖啡酸电喷雾负离子模式质谱的奇电子离子产生过程与机理。咖啡酸去质子分子裂解产生3个奇电子离子,分别为咖啡酸质谱裂解的第三代产物离子m/z 134 (C8H6O2)、第四代产物离子m/z 108 (C6H4O2)和m/z 106 (C7H6O)。m/z 134离子来自于其前体离子m/z 135 (3,4-二羟基苯乙烯离子)羟基O—H键的直接均裂,因其裂解过程较m/z 135的其他裂解相对简单并且所需能量相对较少,使质谱中m/z 134峰强度较大。m/z 108与m/z 106离子的前体离子可以是偶电子离子m/z 109 (邻苯二酚离子)和m/z 107 (2-羟基环戊二烯离子),也可以是奇电子离子m/z 134。m/z 108与m/z 106离子来自于偶电子离子时,m/z 109的O—H键直接发生均裂,m/z 107离子的O—H键经过渡态发生均裂。
关键词: 咖啡酸; 质谱裂解; 量子化学计算; 奇电子离子
咖啡酸的化学结构为3,4-二羟基苯丙烯酸,又称作3,4-二羟基肉桂酸。咖啡酸以单体、多聚体或脂和苷的形式存在在于咖啡、茶,葡萄酒及蜂胶中[1‒2]。咖啡酸具有显著的抗氧化作用[3],同时还具有免疫调节、抗菌、神经保护、抗焦虑、抗增殖和抗炎等多种生物活性[4‒6]。质谱分析技术由于其对各种复杂体系的突出的检测能力,近年来应用愈加广泛和丰富。现今在多样质谱分析技术中,软电离质谱技术占有主要地位,其中尤以电喷雾质谱最为突显。虽然软电离质谱较经典的硬电离质谱即电子电离质谱具有一些优点,但在化合物质谱裂解规律的成熟与完善方面与电子电离质谱相比存有很大的差距,大量的化合物软电离质谱裂解的机理还有待发现。
咖啡酸的电喷雾多级质谱的分析多年来一直受到关注[7‒9]。虽曾运用量子化学计算探索过咖啡酸质谱裂解机理,但也只就低分辨质谱数据通过相对易行的结构优化与键断裂能计算来解释其部分质谱特征[10]。多数化合物电喷雾质谱,由于“偶电子规则”的作用,通常产生的是偶电子离子碎片。咖啡酸的电喷雾负离子模式质谱中有3个奇电子离子碎片,与相邻的偶电子离子质量仅相差1个氢原子。质谱碎片离子违反“偶电子规则” (即电子离子经碰撞活化后发生自由基碎裂反应,产生奇电子离子)的现象,虽然有多个化合物的报道[11‒12],但偶电子离子失去1个氢原子生成奇电子离子的质谱裂解却较为罕见[13]。为了揭示咖啡酸质谱这一特征的成因,笔者运用量子化学密度泛函方法,通过对咖啡酸的高分辨多级质谱有关裂解反应过渡态与碎片离子结构的计算来解读咖啡酸负离子模式相应的裂解机理,展现咖啡酸质谱奇电子离子碎片的生成途径与其质谱特征的来源。
1、 实验部分
1.1 主要仪器与试剂
四级杆-轨道阱高分辨质谱仪:Thermo ScientificTM Q-ExactiveTM组合型,美国赛默飞世尔科技公司。
氮气发生器:TMO-NM-35C型,英国PerMuta科技有限公司。
咖啡酸对照品:质量分数为99.0%,大连美仑生物科技有限公司。
甲醇:色谱纯,天津科密欧化学试剂有限公司。
高纯氮气:体积分数为99.999%,哈尔滨黎明气体有限公司。
氮气:体积分数为99.9%,由氮气发生器制备。
咖啡酸溶液:1 μg/mL,称取咖啡酸对照品适量用甲醇溶解、稀释。
1.2 仪器工作条件
离子源:电喷雾离子源(ESI);扫描方式:负离子模式;喷雾电压:3.2 kV;气化温度:350 ℃;离子传输管温度:320 ℃;鞘气:氮气,压力为206.85 kPa,流量为5 L/h;辅助气体:氮气,压力为68.95 kPa,流量为5 L/h;吹扫气压力:68.95 kPa;源内诱导解离(SID)能量:0~100 eV;碰撞气体:高纯氮气;碎裂模式:高能碰撞诱导解离(HCD);碰撞能量:10~200 eV;离子扫描范围:m/z 50~185;循环记录数:3次;四级杆隔离窗:m/z 1。
1.3 实验步骤
取预先制备的1 μg/mL咖啡酸溶液,通过注射泵注入ESI源,注射流量为15 μL/min。于设定的质谱参数下,根据咖啡酸的分子质量获取咖啡酸电喷雾负离子模式的二级质谱,在测得的二级质谱中确定质荷比最大的碎片离子作为目标离子。获取三级质谱时,先对样品进行不同能量的SID并记录相应的质谱数据。然后根据测定结果,在目标离子强度最大的裂解能量下重复实施SID,选取目标离子进行HCD,记录相应数据。
1.4 计算与分析
密度泛函理论方法采用的交换关联泛函/基组为RB3LYP/6-311G,轻、重原子均加极化函数与弥散函数。结构优化、振动频率与其他计算均通过高斯09软件完成。前体离子、中间体离子,产物离子和脱除的中性分子结构判定的标准为结构优化后,结构振动频率无虚频。闭壳电子结构的偶电子离子O—H键断成开壳电子结构的奇电子离子时,或以前体离子键伸长过程单线态基态与三线态激发态的交叉点作为过渡态[14],或是以前体离子与总产物的热焓差作为O—H键的键断裂能[15‒16]。偶电子离子之间的过渡态结构要求仅有单一的振动虚频,并经内禀反应坐标(IRC)计算分别能够与前体离子及产物离子相连接。能量计算时采用电子与吉布斯自由能总和,能量单位选用kJ/mol。
依据质谱测定结果计算各离子间的质量与化学组成的差值,并结合相应的中性丢失明确离子间可能的联系,即确定各可能的中性丢失时相应的前体离子与产物离子。以咖啡酸最稳定的去质子分子为起点[10],根据质谱的中性分子丢失、计算所有能发生途径的过渡态与相应过渡态下的中间体和产物离子,进而通过比较分析选出最为可能的裂解路径与产物离子。以选出的产物离子作为前体离子按上述方法计算分析优选出下一级裂解路径与下一级产物离子,直至得到咖啡酸质谱裂解的全部的奇电子离子。
2、 结果与讨论
2.1 质谱与奇电子离子
咖啡酸的电喷雾负离子模式多级质谱见图1。图1(a)为m/z 179的二级质谱,图1(b)为m/z 135于SID 42 eV,HCD 100 eV时获取的三级质谱。
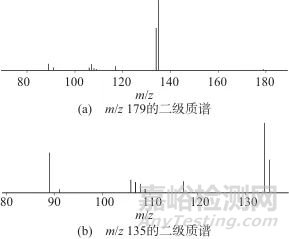
图1 咖啡酸质谱图
Fig. 1 Mass spectrums of caffeic acid
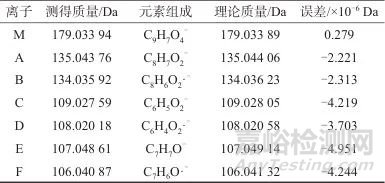
由图1(a)可知,咖啡酸的负离子模式质谱主要由强度较大的碎片离子m/z 135、134及89离子和多个强度很小的离子组成。其中m/z 135离子强度最大;强度小的离子中有4个离子质荷比数值(109、108,107、106)依次相差接近于1。由图1(b)可知,除m/z 135离子外,咖啡酸二级质谱中的其他碎片离子均直接或间接来自于m/z 135的碎裂。值得注意的是,在测定条件下碎片离子中有3个奇电子离子,即m/z 134、108、106离子,它们与邻近的偶电子离子间在元素组成仅相差1个氢。咖啡酸的电喷雾负离子模式质谱中与奇电子离子生成相关的离子与元素组成见表1。表1中,去质子分子记为M,碎片离子按质量由大到小分别记为A至F;各离子测得的质量与理论质量的差值均小于5×10-6 Da。
表1 咖啡酸质谱中离子质量与元素组成
Tab. 1 The mass data and elemental compositions of each ion in caffeic cid mass spectrometry
2.2 裂解途径与机理
2.2.1 裂解路线
图2为负离子模式下咖啡酸的质谱裂解产生奇电子离子的路线示意图。在图2中,质谱裂解过程中脱除的中性部分与所需的最低能量值标注在前体离子与产物离子的连线两侧。咖啡酸质谱裂解的过程如下:去质子分子M先脱羧生成第二代产物离子A (3,4-二羟基苯乙烯负离子),而后,A分别脱氢原子,脱乙炔和脱一氧化碳裂解成咖啡酸质谱的第三代产物离子B、C和E。第三代产物离子B可分别脱乙炔和脱一氧化碳生成第四代产物离子D和F;第三代产物离子C和E也可失去氢原子分别生成四代产物离子D和F。
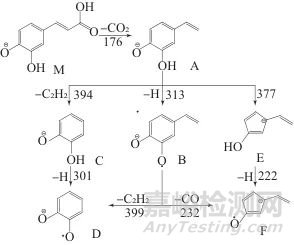
图2 咖啡酸质谱裂解路线示意图
Fig. 2 Proposed mass fragmentation pathway for caffeic acid
2.2.2 去质子分子的脱羧
图3为去质子分子M的脱羧反应示意图(图3及后面的裂解机理示意图中括号内的数值为过渡态、中间产物离子及总产物分别与各自前体离子之间的相对能量值)。去质子分子M的脱羧的具体过程如下。先是M通过过渡态TSM-M1其羧基氢迁移到羧基的另一个氧原子上,生成中间离子M1,随后M1羧基O—H键旋转经过渡态TSM1-M2生成中间离子M2,接下M2经过渡态TM2-A羧基氢与负电荷分布较多的羧基α碳结合,连接α碳与羧基的C—C键断裂脱去二氧化碳生成产物离子A。M的这一脱羧反应为连续反应、历经3个过渡态得以完成。脱羧反应的前两个过渡态的能垒较低,质子迁移与键旋转极易进行。脱羧的最后一个过渡态的能垒最大(176 kJ/mol),在动力学上为反应的决定步骤。
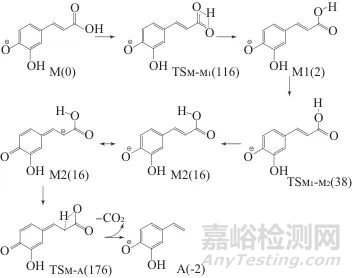
图3 去质子分子的脱羧反应示意图
Fig. 3 Decarboxylation reaction of deprotonated molecule
2.2.3 A(m/z 135)离子的裂解
咖啡酸质谱中来自于去质子分子的产物离子A (m/z 135)可分别按不同的路径发生裂解,其中生成咖啡酸的第三代产物离子B (m/z 134)、C (m/z 109)和E (m/z 107)的3条路径如图4所示。
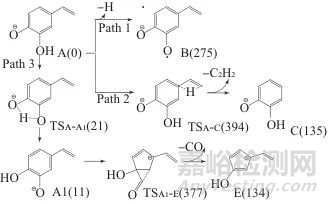
图4 产物离子A的裂解路径示意图
Fig. 4 The scheme of product ion A dissociation routes
图4所示路径1下的产物B为奇电子离子,由其前体离子A的酚羟基O—H键直接均裂脱除氢原子后产生。路径2是由A侧链端的氢通过1,3迁移经过渡态TSA-C脱除乙炔后成产物离子C (邻苯二酚离子)的过程,其能垒为394 kJ/mol。路径3存在两个过渡态,最高能垒为377 kJ/mol。路径3中,先由A经过渡态TSA-A1酚羟基氢通过1,3迁移生成中间离子A1,然后A1经过渡态TSA1-E脱去一氧化碳由六元环收缩成五元环结构的产物离子E (2-羟基-环戊二烯离子)。3条路径中,路径1裂解过程不仅最为简单,而且所需能量(313 kJ/mol)最低,使得其产物离子B在质谱中的强度较大。
2.2.4 D(m/z 108)离子的生成
咖啡酸质谱裂解的第四代产物离子E (m/z108)为一奇电子离子,可通过两种方式生成,见图5。
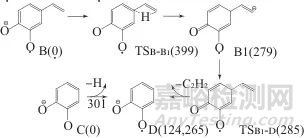
图5 产物离子D的生成示意图
Fig. 5 Formation scheme of the product ion D
生成离子D的第一种方式的前体离子为奇电子离子B。该方式的过程与由A生成C的过程相似,仅是有中间离子的产生。具体的过程如下。先是B侧链端上的氢经过渡态TSB-B1向苯环进行1,3迁移产生中间离子B1,随后B1经过渡态TSB1-D脱除乙炔生成产物离子D。该过程D生成的最大能垒为399 kJ/mol,总产物离子与前体离子B的能量差为124 kJ/mol。产物离子D的第二种生成反式的过程相对简单,其前体离子为偶电子离子C;产物离子D由离子C的酚羟基O—H键直接发生均裂后生成。方式二的能垒为301 kJ/mol,总产物离子与前体离子C的能量差为265 kJ/mol。如将离子D的生成上溯到离子A时,这时产物离子D的生成过程可分别看作是离子A先均裂再脱炔的过程或离子A先脱炔再均裂的过程。由于产物离子D的前体离子B较另一前体离子C易于生成,而C却较B更易裂解,所以难以断定哪个过程比较容易进行。
2.2.5 F (m/z 106)离子的生成
咖啡酸的第四代产物离子F (m/z 106)同碎片离子E一样,也为一奇电子离子,也可由两种方式生成,见图6。
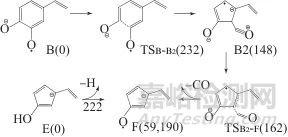
图6 产物离子F的生成示意图
Fig. 6 Formation scheme of the product ion F
离子F的第一种生成方式的前体离子也是奇电子离子B。当离子B苯环上氧自由基碳的相邻的两个碳原子发生结合经过渡态TSB-B2生成五元环结构的中间离子B2,随后B2经过渡态TSB2-F脱除一氧化碳生成产物离子F。该方式的最大能垒为232 kJ/mol,总产物离子与前体离子B的能量差为59 kJ/mol。离子F第二种生成方式的前体离子E为偶电子离子,产物离子F是由前体离子E的酚羟基O—H键均裂脱除氢原子后产生。方式二的能垒为222 kJ/mol,总产物离子与前体离子E的能量差为190 kJ/mol。当上溯到离子A时,碎片离子F的生成过程分别是由A先均裂失氢再脱一氧化碳或由A先脱一氧化碳再均裂失氢。也同碎片离子D的生成一样,难以推断哪个过程更易生成产物离子F。
需要指出的是,在对E的羟基O—H键均裂计算时,可获得单线态基态与三线态激发态的交叉点,因而E生成F的能垒值选用交叉点对应结构的能量。同为由偶电子离子O—H键均裂脱氢原子生成奇电子离子,离子B与离子D的生成不存在着单线态基态与三线态激发态的交叉点,而离子F的生成却能获得相应的交叉点。这一差别的原因是由于离子B的前体离子A与离子D的前体离子C的酚羟基的邻位都具有苯氧负离子,当前体离子的O—H键伸长氢原子离去时易与邻近的苯氧负离子结合,从而难以形成单线态基态与三线态激发态的交叉点。
3 、结语
咖啡酸的电喷雾负离子质谱中的m/z 135离子为咖啡酸质谱裂解的第二代产物离子,m/z 134、109、107碎片离子为质谱裂解的第三代产物离子,m/z 108、106碎片离子为裂解第四代产物离子。第二代产物离子m/z 135离子化学结构为3,4-二羟基苯乙烯负离子,来自于咖啡酸的4位酚羟基失去质子形成的去质子分子的脱羧反应。第二代产物离子m/z 135离子可经多个途径继续裂解,其中的第三代产物离子m/z 134是由m/z 135离子的酚羟基O—H键均裂所产生。作为奇电子离子的m/z 134离子其质谱峰强度大的原因是其生成的过程相对简单并且所需的能量较低。第四代产物离子的奇电子离子m/z 108与m/z 106碎片离子,它们的前体离子可是偶电子离子也可是奇电子离子。碎片离子m/z 135与m/z 109的O—H键均裂失去氢原子时不存在单线态基态与三线态激发态的相交点。
参考文献:
1 GUAN H Q,LUO W B,BAO B H,et al. A comprehensive review of rosmarinic acid:from phytochemistry to pharmacology and its new insight [J]. Molecules,2022,27(10):3 292.
2 PATRAS M A,JAISWAL R,KUHNERT N,et al. Profiling and quantification of regioisomeric caffeoyl glucoses in berry fruits[J]. Journal of Agricultural and Food Chemistry,2018,66(5):1 096.
3 GÜLÇIN İ. Antioxidant activity of caffeic acid (3,4-dihydroxycinnamic acid)[J]. Toxicology,2006,217(2/3):213.
4 PAVLÍKOVÁ N. Caffeic acid and diseases-Mechanisms of action[J]. International Journal of Molecular Sciences,2022,24(1):588.
5 ESPÍNDOLA K M M,FERREIRA R G,NARVAEZ L E M,et al. Chemical and pharmacological aspects of caffeic acid and its activity in hepatocarcinoma[J]. Frontiers in Oncology,2019,9:541.
6 MUHAMMAD ABDUL KADAR N N,AHMAD F,TEOH S L,et al. Caffeic acid on metabolic syndrome:A review[J]. Molecules,2021,26(18):5 490.
7 CLIFFORD M N,WU W,KIRKPATRICK J,et al. Profiling the chlorogenic acids and other caffeic acid derivatives of herbal Chrysanthemum by LC-MSn [J]. Journal of Agricultural and Food Chemistry,2007,55(3):929.
8 WU Z J,MA X L,FANG D M,et al. Analysis of caffeic acid derivatives from Osmanthus yunnanensis using electrospray ionization quadrupole time-of-flight mass spectrometry[J]. European Journal of Mass Spectrometry,2009,15(3):415.
9 刘静,霍志鹏,田介峰,等.迷迭香酸及咖啡酸的ESI 四级杆飞行时间高分辨质谱裂解规律研究[J].化工与医药工程,2023,44 (3):29.
LIU Jing,HUO Zhipeng,TIAN Jiefeng, et al. Study on the fragmentation patterns of rosmarinic acid and caffeic acid by ESI quadrupole time-of-flight mass spectrometry[J]. Chemical and Pharmaceuticl Engineering,2023,44(3):29.
10 YIN Z H,SUN C H,FANG H Z. Fragmentation characteristics of hydroxycinnamic acids in ESI-MSn by density functional theory[J]. Journal of Mass Spectrometry,2017,52(7):427.
11 CHAI Y F,SUN H Z,PAN Y J,et al. N-centered odd-electron ions formation from collision-induced dissociation of electrospray ionization generated even-electron ions:single electron transfer via ion/neutral complex in the fragmentation of protonated N,N'-dibenzylpiperazines and protonated N-benzylpiperazines[J]. Journal of the American Society for Mass Spectrometry,2011,22 (9):1 526.
12 ZHANG X P,ZHU P X,ZHANG H R,et al. The competing radical eliminations in the tandem mass spectrometry of the OH deprotonated benzyl vanillate [J]. Journal of Mass Spectrometry,2015,50(2):432.
13 ATTYGALLE A B,RUZICKA J,VARUGHESE D,et al. Low energy collision induced fragmentation of negative ions derived from ortho,meta,and para hydroxyphenyl carbaldehydes,ketones,and related compounds[J]. Journal of Mass Spectrometry,2007,42(9):1 207.
14 KHURSAN S L. Homodesmotic method of determining the O—H bond dissociation energies in phenols[J]. Kinet Catal,2016,57:159.
15 ZHANG X P,LI F,LV H Q,et al. On the origin of the methyl radical loss from deprotonated ferulic and isoferulic acids:electronic excitation of a transient structure[J]. Journal of the American Society for Mass Spectrometry,2013,24(6):941.
16 TRUNG N Q,MECHLER A,HOA N T,et al. Calculating bond dissociation energies of X—H (X=C,N,O,S) bonds of aromatic systems via density functional theory:a detailed comparison of methods[J]. Royal Society Open Science,2022,9(6):220 177.
引用本文: 方芳,方舟,孙长海 . 咖啡酸负离子模式质谱奇电子离子碎片的解析[J]. 化学分析计量,2024,33(10):34. (FANG Fang, FANG Zhou, SUN Changhai. Analysis of odd electron ion fragments in caffeic acid negative ion mode mass spectrometry[J]. Chemical Analysis and Meterage, 2024, 33(10): 34.)

来源:化学分析计量


