您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2024-11-30 10:56
摘要: 为推动高风险药品生产企业持续符合药品生产质量管理规范( GMP) ,对近3 年安徽省开展的高风险药品生产企业依职责GMP 符合性检查的缺陷项目进行统计分析。共汇总缺陷项目1 408 项,包括严重缺陷7 项、主要缺陷88 项、一般缺陷1 313 项,主要分布于质量控制与质量保证、文件管理、无菌药品附录等方面。高风险药品生产企业应从落实主体责任、强化污染控制策略、建立长效培训机制、严格供应商管理、完善确认与验证、加强产品质量回顾分析等方面着手持续保障药品质量安全。
2019 年新修订的《中华人民共和国药品管理法》[1] 将药品上市许可持有人( marketingauthorization holder,MAH) 制度以法律的形式颁布实施,重点强调了MAH 应当依照规定,对药品的非临床研究、临床试验、生产经营、上市后研究、不良反应监测及报告与处理等承担责任。《药品上市许可持有人落实药品质量安全主体责任监督管理规定( 2022 年第126 号文) 》[2]则进一步明确,MAH 应树立药品质量安全主体责任意识,依法对药品研制、生产、经营、使用全过程中药品的安全性、有效性、质量可控性负责。MAH 制度推行赋予了我国药品高质量发展强大的力量源泉,也给药品的监管模式带来了巨大的变革。传统的《药品生产质量管理规范》( Good Manufacturing Practice,GMP) 认证已随时代淘汰,以品种为中心的监管模式正形成时代主流。
在众多药品中,疫苗、血液制品、放射性药品、医疗用毒性药品、无菌药品等高风险药品因生产工艺、复杂、生产过程控制要求严格、原材料质量标准高、设施设备技术复杂、从业人员专业资质限制等诸多品种特性,且存在应用范围广、用药途径特殊、用药时机危急、与人民群众的身体健康和生命安全息息相关等社会属性,一直以来都是药品监督管理部门的监管重心。《药品生产监督管理办法》[3]等法规中更是对高风险药品MAH 及生产企业的监管频次、方式作出了更高、更严格的要求。
本研究基于药品检查实践,对2021 年至2023年期间安徽省高风险药品生产企业依职责GMP 符合性检查中发现的缺陷进行统计分析,针对薄弱环节提出对策与建议,为高风险药品生产企业持续完善质量管理体系提供参考和借鉴。
1、 研究对象与方法
2021 年至2023 年期间,安徽省药品审评查验中心组织对省内在产的40 家高风险药品生产企业开展了117 家次依职责GMP 符合性检查。检查范围涉及小容量注射剂、大容量注射剂、冻干粉针剂、粉针剂、滴眼剂、无菌原料药、粉液双室袋等,品种包括疫苗、血液制品、生物制品、中药注射剂、生化药品、放射性药品等。
2、 研究结果
2.1 缺陷项目分析
通过对117 家次高风险药品生产企业现场检查报告进行技术审核,共发现缺陷1 408 项,包括严重缺陷7 项、主要缺陷88 项、一般缺陷1 313 项。按涉及的GMP 章节及附录对缺陷项目进行归类,分布情况见表1。
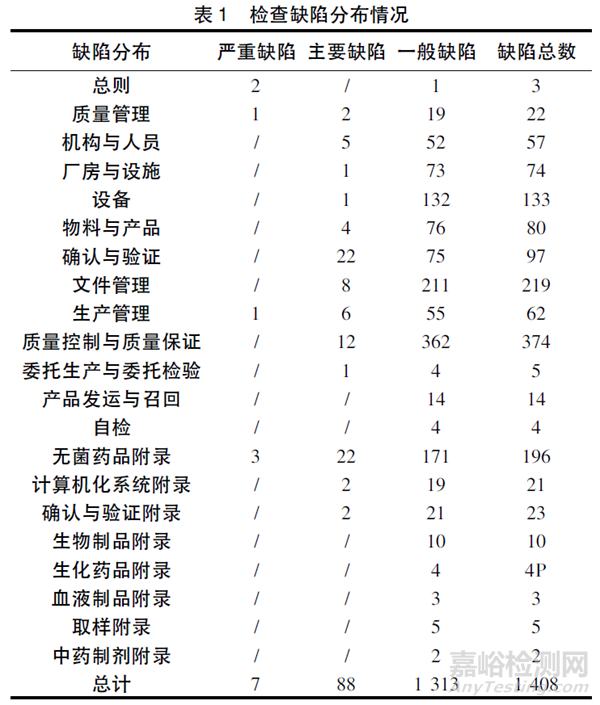
严重缺陷主要涉及部分生产检验记录不真实、无菌保证能力严重不足、生产中存在较高污染和交叉污染的风险、未完成产品全检即已批准放行等。
主要缺陷主要分布于确认与验证( 如确认或验证的范围和程度) 、无菌药品附录( 如过滤除菌工艺) 、质量控制与质量保证( 如纠正与预防措施) 、文件管理( 如工艺规程) 以及生产管理等方面,分别占全部主要缺陷的25.00%、25.00%、13.64%、9.09%和6.82%,总占比约80%。具体分布情况如图1 所示。
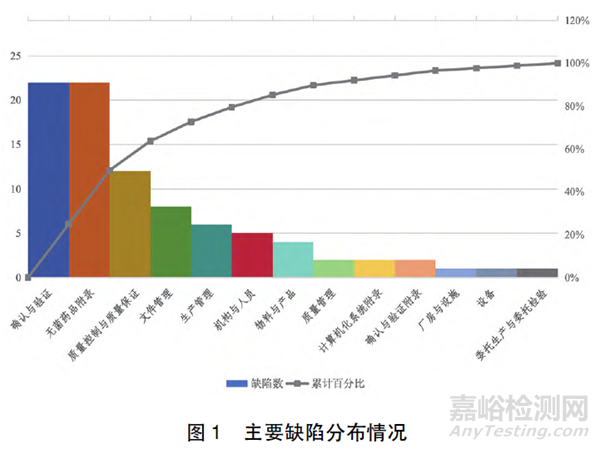
一般缺陷主要集中于质量控制与质量保证( 如药品检验) 、文件管理( 如批生产记录) 、无菌药品附录( 如培养基模拟灌装) 、设备、物料与产品以及确认与验证( 如设备确认) ,分别占全部一般缺陷的27.57%、16.07%、13.02%、10.05%、5.79%和5.71%,总占比约80%。具体分布情况如图2 所示。
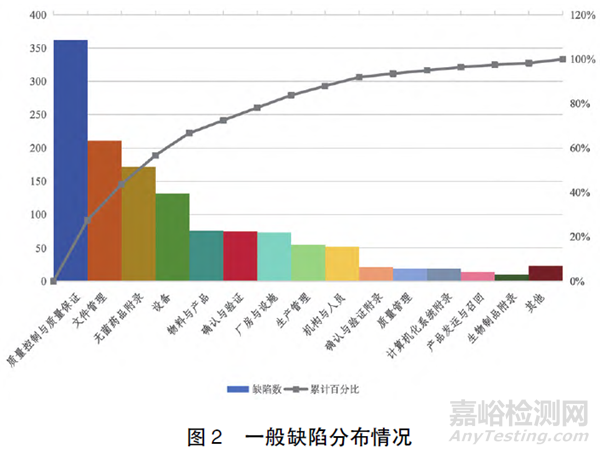
2.2 高频次缺陷条款分布
对发现的缺陷条款进行统计,频次超过15 次的条款如图3 所示。结合缺陷条款分布看,频次最多的条款是第223 条( 药品检验) ,其次是第150 条( 文件管理) ,排第三位的是第175 条( 批生产记录) ,第四位的是第27 条( 人员培训) ,第五位的是第226 条( 试剂、试液管理) 和第266 条( 产品质量回顾) 。此外,无菌药品附录中第47 条( 培养基模拟灌装) 和第75 条( 非最终灭菌产品的过滤除菌) 也是高频缺陷项目。
2.3 典型缺陷分析
综合分析检查发现的缺陷项目,高风险药品生产企业在无菌保证、确认与验证、人员履职能力、物料及供应商管理、质量保证、质量控制等方面问题频发。
2.3.1 无菌保证水平不足
①人员方面: 操作不规范,如“无菌装配人员操作时在A 级和B 级间来回移动且未消毒”; 无菌更衣资质认证不合格,如“缺少关键操作人员更衣效果确认记录”。②厂房设施设备方面: 厂房设施设计不合理,如“C 级整衣间未设置层流装置无法满足B 级洁净服的微粒控制要求”; 设备清洁不彻底,如“设备表面有污渍”; 未对仪器设备定期确认或检定,如“未对过滤器完整性测试仪进行定期校准”。③物料方面: 储存条件超出规定,如“环境湿度超出某物料规定要求且无保护措施”; 物料传递方式未确认,如“未对某物料从冷库领出转运至洁净区过程中的防止污染和交叉污染措施以及对产品质量的影响进行评估确认”; 公用介质质量标准不全面,如“未对灭菌用纯蒸汽监测过热度、干燥度、不凝结气体等指标”; 供应商审计不严格,如“未在现场审计时考察供应商生产过程对微生物污染、热原/细菌内毒素污染和微粒污染的控制措施”。④产品和工艺方面: 非最终灭菌产品除菌过滤验证不完善,如“未提供除菌滤芯验证资料”; 最终灭菌产品灭菌工艺验证频次不符合要求,如“制定的灭菌工艺再验证周期为5 年依据不足”; 包装系统密封性研究不足,如“未开展产品密封性验证”; 培养基模拟灌装试验设计不合理,如“未结合实际生产情况对干预措施进行评估、分类,最差条件设置不合理或不充分”。⑤环境监测方面: 采样位置或频率未经评估,如“B 级区沉降菌监测碟未放置在标示的点位”; 气流模型建立不充分,如“烟雾试验录像未评估发烟量、压力、光线和背景影响,无法有效证明A 级气流流型”。
2.3.2 人员履职能力不佳
①岗位职责方面: 部分关键岗位人员承担职责过多,如“生产负责人兼任采购负责人及车间主任”。②人员能力方面: 部分生产和质量管理人员专业能力较弱,如“技术人员不熟悉除菌过滤、培养基模拟灌装试验等技术指南”等。③人员培训方面: 人员培训缺乏针对性,如“缺乏微生物知识等内容”; 培训考核方式单一,如“未对灯检岗人员进行实操培训考核”。
2.3.3 物料及供应商管理不到位
①物料管理方面: 标识管理不到位,如“部分物料无货位卡及物料标识”; 物料信息不具体,如“合格供应商名单未注明经销商名称、登记号、执行标准”。②供应商管理方面: 未签订质量协议或协议内容不完整,如“与经销商签订的协议中未明确原料药的生产商”; 未定期开展现场审计或审计内容不完整,如“审计报告缺少生产工艺流程图、检验报告等”。
2.3.4 确认与验证不完善
①设施设备确认方面:未按计划进行再确认,如“未按规定定期对配液系统、提取罐、醇沉罐等进行再确认”; 验证方案设计不全面或内容不完整,如“某设备再验证方案未明确性能确认的项目、方法及可接受标准”。②共线生产评估和清洁验证方面: 共线生产风险评估不合理,如“未进行毒理学评估或基于健康的暴露限度评价”; 清洁验证不完善,如“未基于科学评估选择化学残留的目标物,残留物的可接受标准选择不科学”。
2.3.5 质量保证措施不充分
①质量回顾方面: 质量回顾内容不全,如“质量回顾分析报告中回顾的项目少于规定的项目且未说明”。②变更控制方面: 变更分类分级不明确,如“管理规程中对变更分级管理程序的描述不清楚”; 变更评估不充分,如“未进行充分评估即将某品种放宽中间体含量控制标准评定为微小变更”。③偏差处理与纠正预防措施方面: 偏差处理流程不明确,如“未明确偏差调查主体责任部门”; 偏差调查不深入,如“某年偏差台账中根本原因归为人员占比38%”; 纠正预防措施不到位,如“在采取纠偏措施后仍发生数十起同类型的偏差”。
2.3.6 质量控制存在欠缺
①检验方法方面: 未按规定进行检验,如“某原料药残留溶剂检查未按《中国药典》通则要求进行系统适用性试验”。②检验记录方面: 部分检验记录内容不完整,如“缺少仪器编号、型号信息、签名日期等信息”; 记录不及时,如“某产品的中间产品检验报告单已签发,但原始记录未及时填写”。
3、 讨论与建议
结合无菌药品等高风险药品的固有特殊属性,剖析典型缺陷,为高风险药品生产企业能够持续稳定地生产出符合预定用途和注册要求的药品提出以下建议和对策。
3.1 自觉落实主体责任,提升质量责任意识
自2015 年MAH 试点工作启动,到2019 年MAH 制度正式实行,再到2022 年第126 号文、2023 年第132号文[4]接连发布,我国MAH 制度已逐步构建成型。MAH 制度的引入,在一定程度上激发了医药产业创新活力、优化了行业资源配置、推动了产业转型升级[5],但也使很多企业“水土不服”。不同于过去药品监督管理部门“全包式”“保姆式”的监管理念,新制度下,企业是药品质量安全的根本责任主体。企业在追求发展时,应认识到自律是本质要求,主体意识、主体责任是做大做强的内生动力[6]。企业必须依法在药品生产环节建立质量管理体系,以保证生产全过程持续合法合规。一方面,要全面加强质量管理水平,围绕GMP 要求建立质量管理各要素,保障质量管理体系持续有效运行; 另一方面,建立内部审核机制并定期开展自查自纠,以点及面、由浅入深逐步挖掘质量安全风险点; 同时,通过激励、惩戒等措施强化全员自律责任意识,健全责任落实机制。企业应树立“第一道关口”意识,以确保实现药品全程可控管理,促进核心竞争力提高[7]。
3.2 强化污染控制策略,完善无菌保证管理体系
污染控制是GMP 的关键要求,更是药品质量安全的第一要素。对于无菌药品等高风险药品而言,污染控制的重点是关注对微生物、颗粒、热原/内毒素的管控[8]。药品检查合作计划( Pharmaceutical InspectionCo-operation Scheme,PIC /S) 无菌附录中提出的污染控制策略( contamination control strategy,CCS)是基于对现有产品和工艺的理解,源于并确保工艺性能和产品质量,针对微生物、内毒素/热原和微粒的一系列有计划的控制措施。我国2010 版GMP、2010 版GMP 无菌药品附录、2020 版药品GMP 指南无菌制剂分册等规范、指南性文件中均对无菌药品的污染控制作出了管理要求,但将CCS 的要求贯穿至药品生产全过程仍是制药企业进一步提高无菌保证管理体系的有力支撑。CCS 是系统性工程,包括但不限于人员、工厂设计、厂房和设备、公用设施、物料污染控制、工艺风险管理、工艺设计、灭菌工艺验证等[9]。CCS 的制定也并非一劳永逸的工作,需将其融入到企业质量体系中并定期回顾、持续更新/改进,以保证现有CCS 的整体有效性和前沿性[10]。结合我省高风险药品生产企业检查缺陷来看,大部分企业尚不能形成系统性的无菌保证策略,尚未充分基于产品对关键工艺控制点、厂房设施设备、环境监测、清洁消毒、物料转运、原辅包、人员操作与培训等影响产品无菌性的核心要素和微生物日常监测情况对所有可能的污染风险开展定期/不定期梳理、识别和评估。检查中发现部分企业缺乏对无菌生产核心区域污染控制细节的关注,仅停留在制定单点污染控制措施层面,但无菌保证绝不是某一技术在单一环节的应用[11]。高风险药品生产企业应对标欧盟、WHO、PIC /S 等标准,从源头控制、过程控制、终端控制等方面提高自身无菌保证能力,加强高风险药品的全面质量安全控制策略。
3.3 建立长效培训机制,持续提高人员能力
人是药品生产过程中最大的污染源,人员管理亦是最大的挑战。国内外的主要法规和指导原则均对制药企业的人员,尤其是直接从事无菌药品等高风险药品生产及控制的人员作出了详细的要求及规定[12]。GMP 第二十七条、无菌药品附录第二十条、生物制品附录第六条、血液制品附录第九条、放射性药品附录第六条、生化药品附录第六条等均对从事药品生产、质量保证、质量控制及其他相关人员的培训管理进行了规定。制药领域法律法规、技术规范和标准等更新速度快,无菌药品等高风险药品更应对从业人员的专业背景、工作经历、行为规范等提出更加严格的要求。一方面,从业人员必须熟悉并严格遵守相关法规,以高度的责任意识和自律意识,严格按照经核准的处方工艺、质量标准生产药品[13]; 另一方面,抓住“人”这个关键因素,树立全员质量安全责任意识,强化全员培训和考核也是企业切实提升综合竞争力的重要举措[14]。如何保证培训达到预期效果,是目前大多数企业亟须解决的关键问题。以人员无菌更衣培训为例,大部分药企在培训时仅开展理论讲解,辅以理论考试及人员表面微生物采样结果作为判定培训是否合格的指标,而忽视更衣操作过程的规范性。同样,在人工灯检、关键区域行为操作、取样等环节也存在显著突出的人员培训效果问题。因此,企业需要通过完善培训计划、制定针对性培训内容、重视实际操作培训、注重评估培训效果、建立培训档案等系列工作,才能达到高效、长效、全面、深入的预期培训效果。
3.4 严格供应商管理,加强物料生命周期管理药
品的原料、辅料及包装材料的质量决定着最终成品的质量。与普通药品相比,高风险药品在物料全过程管理中对微生物负荷、细菌内毒素及微粒要求更严格。首先,在供应商资质审查时,应聚焦供应商的质量保证体系,重点关注供应商生产过程中对微生物污染、细菌内毒素污染和微粒污染风险的控制措施。其次,与关键物料供应商特别是制剂用物料的供应商签订质保协议时,应明确对微生物、细菌内毒素污染水平、微粒等做出规定,此外,应定期对主要物料供应商的质量管理体系进行现场审核,并定期再评估,如发现不良趋势应及时采取增加现场审计频率、更严格的抽样方案等必要的措施。最后,还需要关注关键物料储存、运输与转移过程的风险控制措施,例如取样环节防止粉末物料的交叉污染,以及包装材料、容器、工器具等进入洁净区的灭菌、清洁方式等。不同类型的高风险药品对物料的管理各有侧重。例如,多组分生化药品需严格把控原材料的动物来源、种属、年龄、采集部位及方法、采集后的保存方法与有效期[15]; 血液制品关注供血浆者的筛选和病原体检测,以及原料人血浆病原体去除或灭活[16]; 生物制品严格控制活菌、病毒及工程细胞/菌体的生物学活性,防止生产过程的交叉污染并做好生物安全防护[17]; 中药注射剂关注使用药材的基原、药用部位、产地、采收期等[18]。
3.5 完善确认与验证,保持持续受控状态执行
GMP 是MAH 及生产企业的基本要务,而GMP 中很大一部分工作在于实施并维持药品生产质量过程的“确认与验证”状态。确认与验证涉及范围广泛,包括厂房与设施、设备、检验仪器等硬件方面,以及生产工艺、操作规程、清洁方法和检验方法等软件方面,任何一方面确认或验证工作做得不全面或不充分,都会对药品生产质量管理全过程受控产生影响[19]。结合检查缺陷来看,企业在确认与验证方面存在的主要缺陷项目数占全部主要缺陷项目数的比例为25%,这反映出“确认与验证”既是制药企业易产生系统性风险的关键所在,也是监管部门重点关注的环节。高风险药品生产企业应结合品种特点,充分开展风险评估,以产品生产工艺关键控制点与风险点为基础,重点开展无菌生产工艺验证、包装系统密封性验证、灭菌柜确认、除菌过滤系统适应性验证、清洁验证等工作。例如,非最终灭菌的无菌产品培养基模拟灌装试验中无菌起点选择、干扰设计,最终灭菌产品灭菌过程的热分布、热穿透和生物指示剂挑战试验[20],清洁验证清洁目标物的选择、限度的确定及“脏/净”设备贮存时限等[21]。同时,企业需以设施设备的预防性维护保养、设备仪表的校准、生产过程监控、变更控制、产品质量回顾、趋势分析与评估、再确认或再验证等有效手段保证经确认或验证过的核心硬件及软件持续保持相对稳定的受控状态,从而达到“确认和验证不是一次性的行为”的要求。
3.6 加强产品质量回顾分析,持续提高产品可控性
产品质量回顾是客观评价产品趋势、确保产品生产工艺与核准一致、持续保证并提升药品质量符合产品质量标准要求的核心工具。药品GMP 第二百六十六条、第二百六十七条、第二百六十八条对质量回顾的情形、结果评估、委托生产时的责任划分等进行了规定。年度产品质量回顾必须以产品为主线进行,其内容需紧密围绕产品质量而开展,反映出企业在数据管理、质量保证、文件管理、统计分析技术、资源匹配、质量文化等多个方面的能力和可能存在的问题,更是企业质量保证系统中证实性、预防性和系统性的汇集点[22]。但从检查情况来看,部分企业在产品质量回顾方面不够重视。例如,程序文件规定不具体、回顾频次缺乏合理依据、回顾内容不全面、统计分析方法应用不科学、回顾分析不深入、质量回顾报告的审核与管理资源配备不足等。企业应建立产品质量回顾操作规程并按规程实施,采用文件信息化等措施完善产品质量回顾以持续提高产品质量可控性。
4、 结语
与普通药品相对而言,高风险药品既是对生产工艺要求更高、质量控制要求更严格的产品,也是社会关注度广、人民群众生命危急亟需的产品,更是药品监管部门需要予以重点关注、投入更多监管力量和资源的产品。不论是从保护患者利益角度,或是保障企业自身利益角度,高风险药品MAH 和生产企业都需要不断强化质量风险意识,满足不断更新的法律法规/技术指导原则要求,增强及时识别、化解潜在的风险隐患能力,将风险管理系统贯穿于药品全生命周期中,树立质量安全意识,落实主体责任,将提高质量管理水平、保证药品质量安全、履行社会责任作为首要任务,切实降低企业产品的安全风险,确保高风险药品质量安全。
目前正值我国申请加入PIC/S之际,监管部门的监管能力需要逐渐与国际化水平接轨,我国制药企业的生产和质量管理水平也必将迈向国际化之路。高风险药品生产企业应结合无菌保证能力提升行动的有关要求,对标欧盟、WHO、PIC /S 等标准,进一步从人、机、料、法、环、测等方面开展风险识别,及时挖掘潜在的质量风险点,制定切实可行的解决方案,确保持续稳定地生产出符合预定用途和注册要求的药品。
参考文献
[1] 全国人民代表大会.中华人民共和国药品管理法[EB/OL].( 2019- 08- 26) [2024- 03- 14]. http: / /www. npc.gov. cn /npc /c2 /c30834 /201908 /t20190826 _ 300489. html.
[2] 国家药品监督管理局.国家药监局关于发布《药品上市许可持有人落实药品质量安全主体责任监督管理规定》的公告( 2022 年第126 号) [EB/OL].( 2022-12-29) [2024- 03- 14]. https: / /www. nmpa. gov. cn /xxgk /fgwj /xzhgfxwj /20221229195805180.html.
[3] 国家市场监督管理总局.药品生产监督管理办法[EB/OL].( 2020-01-22) [2024-03-14].https: / /www.samr.gov.cn/zw/zfxxgk/fdzdgknr /fgs/art /2023/art _ 65070d0ee03a4109ac831ee7b3cee51c.html.
[4] 国家药品监督管理局.国家药监局关于加强药品上市许可持有人委托生产监督管理工作的公告( 2023 年第132 号) [EB/OL]. ( 2023- 10- 23) [2024- 03- 14]. https:/ /www. nmpa. gov. cn /xxgk /ggtg /ypggtg /ypqtggtg /20231023160426145.html.
[5] 张磊,朱夜琳,张海龙.当前我国仅委托生产的药品上市许可持有人存在问题及对策分析[J].中国食品药品监管,2023( 11) : 92-97.
[6] 应宏锋.“药品质量受权人制度”的思考与实践———激发药品生产企业落实主体责任是监管工作的“牛鼻子”[J].中国食品药品监管,2019( 6) : 10-15.
[7] 徐大丽,章文霞.上市许可持有人制度实施以来我国药品监管现状探究[J].中国药事,2023,37( 8) : 857-863.
[8] 颜若曦.无菌药品污染控制策略要点探析[J].医药导报,2023,42( 9) : 1424-1429.
[9] 王丹,杨敬鹏.结合PIC/S GMP 无菌药品附录修订探讨国内无菌药品生产现场检查策略[J].中国生物制品学杂志,2023,36( 11) : 1403-1408.
[10] 中国医药设备工程协会.无菌药品生产污染控制策略( CCS) 技术指南[EB/OL].( 2024-02-28) [2024-03-14]. http: / /www. cpape. org. cn /index /article /index /aid /959.html.
[11] 李辉,马仕洪,王兰,等.中药注射剂安全性及其无菌保障体系的现状与思考[J]. 中成药,2022,44( 9) : 2939-2943.
[12] 王似锦,王杠杠,余萌,等.国内外无菌药品生产法规指南中人员的管理[J]. 中国医药工业杂志,2022,53( 8) : 1222-1226.
[13] 周宇升,董晨妍,丁静.“四个最严”视域下药品质量管理人才培养的现实困境与推进策略[J].宁波职业技术学院学报,2023,27( 3) : 53-57.
[14] 钱生稳.药企GMP 培训缺陷分析及建议[J].药学与临床研究,2018,26( 2) : 157-158.
[15] 黄裕.浅谈对生化药源头的质量控制[J]. 上海医药,2017,38( 15) : 52-54.
[16] 邹毅,吴生齐,张信.基于药品GMP 的新型血液制品生产用原料血浆生产与质量管理体系及相关GMP 认证检查方法初探[J].药学进展,2011,35( 12) : 550-554.
[17] 颜若曦.世界卫生组织生物制品检查要点与典型问题研究[J].中国医药工业杂志,2022,53( 7) : 1049-1055.
[18] 王浩,胡士高,袁建龙.安徽省中药注射剂生产企业监督检查情况分析与改进策略[J]. 中国药业,2023,32( 9) : 24-27.
[19] 曹鸿雁,赵杰,柴发永,等.山东省依企业申请药品生产质量管理规范符合性检查质量风险分析[J]. 药学研究,2023,42( 10) : 844-848.
[20] 胡士高,罗京京,窦颖辉,等.安徽省无菌药品生产企业新版GMP 认证检查缺陷分析与对策研究[J].机电信息,2014( 20) : 6-9.
[21] 薛峰.关于药品GMP 检查中清洁验证常见问题的矫正[J].药学与临床研究,2020,28( 1) : 74-77.
[22] 叶笑,颜若曦.产品质量回顾的要点分析研究[J].现代药物与临床,2022,37( 7) : 1653-1656.
作者:芮雪/叶六平/胡士高(安徽省药品审评查验中心)
内容来源:药学研究 2024 Vol.43

来源:Internet


