您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-04 20:17
摘 要: 建立一种新型在线固相萃取-超高效液相色谱-串联质谱分析方法,自动进行样品富集、净化、分离及检测,实现环境水中氯霉素、甲砜霉素、氟甲砜霉素的定量分析。系统由专属的大体积进样器进样2 mL环境水样到亲水亲油的HLB柱上进行富集和浓缩后进行分析,且整个分析时间仅需17 min;使用同位素标记的内标法定量目标物质,用于校正在线固相萃取过程中不可避免的损失和基质效应,以确保方法准确性,测定结果同传统方法吻合度高。各组分在质量浓度0.50~50.0 ng/L范围内与对应的色谱峰面积线性相关性好,相关系数均大于0.999 5,检出限为0.030~0.12 ng/L。3种浓度的样品溶液分别平行测定6次,测试结果的相对标准偏差为1.60%~9.04%,样品加标回收率为85.0%~123.0%。该方法准确可靠、操作简捷、灵敏度高、分析速度快,为研究抗生素在生态环境中的时空分布和迁移转化提供技术支撑。
关键词: 在线固相萃取; 高效液相色谱-串联质谱法; 抗生素; 水质
氯霉素、甲砜霉素和氯甲砜霉素同属于氯霉素类抗生素,具有广谱抗菌作用,在治疗人和动物的感染性疾病等方面发挥着重要作用[1‒2],从而在医疗卫生、农业生产和水产养殖等领域得到广泛应用[3]。氯霉素曾使用广泛,但因其有严重的副作用,会抑制人体骨髓造血机能,现已被禁止使用。甲砜霉素和氯甲砜霉素作为新型氯霉素类抗生素,成为氯霉素的替代物,但其仍对动物有胚胎毒性,孕妇及儿童慎用[4]。近年来,随着氯霉素类抗生素的用量的逐年增加,环境介质中氯霉素类抗生素的残留已成为普遍关注的环境问题[5‒6],该类抗生素药物若直接或间接排入水体,会对人体健康产生危害[7‒8]。目前,国家水质标准体系中尚缺乏对氯霉素类抗生素的检测标准和限值要求,因此有建立一种可靠、简便、快速、准确、高灵敏度的环境水中氯霉素类抗生素分析检测方法具有非常重要的研究意义。
目前,国内外对氯霉素类抗生素的检测方法主要有微生物法[9]、免疫分析法[10]、气相色谱法[11]、气相色谱-质谱法[12]和高效液相色谱-质谱法[13‒17]等。气相色谱法与气相色谱-质谱法测定氯霉素类抗生素的缺点在于样品处理较为繁琐,液相色谱-质谱法具有重复性好、灵敏度高等优点,成为氯霉素类抗生素的主流检测方法。但是在很多现有液相色谱-质谱法方法中水样处理通常需要借助固相萃取柱富集、浓缩,重溶后再进样分析,该过程费时、费力,且容易出现误差[18]。在线固相萃取与离线固相萃取系统相比,具有样品处理简单、自动化程度高、分析速度快和溶剂用量少等特点[19‒22],同时还可以避免经固相萃取后样品在浓缩过程中有机溶剂挥发对环境的污染,和对实验人员的伤害,具有高效、环境友好等优点[23‒24]。
笔者采用在线固相萃取系统和三重四极杆质谱仪联用,样品由系统专属的大体积进样器进样2 mL,经在线固相萃取柱富集净化,之后经过阀切换,固相萃取柱同分析柱连通,目标组分在固相萃取柱上经过流动相洗脱后,进入分析柱进行聚焦、分离和检测。整个过程自动完成,17 min内即可完成氯霉素类抗生素的进样、富集、分离和测定,从而轻松实现对环境水中痕量氯霉素类抗生素的检测。
1、 实验部分
1.1 主要仪器与试剂
全自动在线固相萃取与超高效液相色谱(UHPLC)串联质谱联用系统:AOE+LCMS-8050型,配置5 mL定量环的SIL-16P自动进样器,带四元低压梯度系统LPGE单元LC-20AD输液泵;UHPLC包括系统控制器CBM-20 A,两台LC-20ADXR输液泵,CTO-20AC柱温箱内置FCV-36AH十通阀,日本岛津公司。
台式低速大容量离心机:L-550型,长沙湘仪离心机仪器有限公司。
氯霉素、甲砜霉素、氟甲砜霉素、氯霉素-d5、甲砜霉素-d3、氟甲砜霉素-d3标准样品:质量分数均大于98.0%,百灵威科技有限公司。
乙腈、甲醇、甲酸:均为质谱纯,美国赛默飞世尔科技公司。
实验用水:超纯水,香港屈臣氏有限责任公司。
1.2 内标溶液的配制
分别称取氯霉素-d5、甲砜霉素-d3、氟甲砜霉素-d3标准样品1 mg于同一容量瓶中,加入10 mL乙腈溶解,获得内标储备液,再用乙腈稀释,配制内标工作液,其中氯霉素-d5、甲砜霉素-d3、氟甲砜霉素-d3的质量浓度均为10 μg/L。
1.3 系列混合标准工作溶液的配制
分别称取氯霉素、甲砜霉素、氟甲砜霉素1 mg置于同一容量瓶中,用10 mL乙腈稀释,配制混合工作液,取混合工作液用乙腈以逐级稀释配制系列混合标准工作溶液,其中氯霉素、甲砜霉素、氟甲砜霉素的质量浓度均分别为0.5、1、2、5、10、20、50 μg/L。在超纯水中按照1∶1 000的比例加入上述内标工作液及系列混合标准工作溶液,其中氯霉素、甲砜霉素、氟甲砜霉素溶液各组分质量浓度均分别为0.5、1、2、5、10、20、50 ng/L,内标溶液各组分质量浓度均为10 ng/L。
1.4 样品处理
环境水样品解冻混匀后取10 mL于离心管中,以10 000 r/min离心10 min,取上清液过0.22 μm滤膜,然后按照体积比1∶1 000加入内标工作液,装入13 mL进样小瓶中。
1.5 仪器工作条件
1.5.1 固相萃取仪
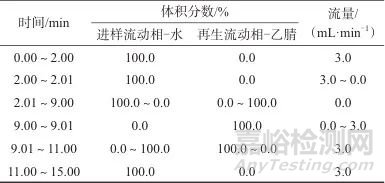
在线固相萃取柱:Oasis HLB Direct Connect HP固相萃取柱(30 mm×2.1 mm,20 μm,美国沃特世科技有限公司);进样体积:2 mL;流动相:水,流量为3 mL/min;进样时间:2 min;SPE柱再生流动相:乙腈,流量为3 mL/min。在线固相萃取条件见表1。
表1 在线固相萃取条件
Tab. 1 On-line solid-phase extraction conditions
1.5.2 色谱仪
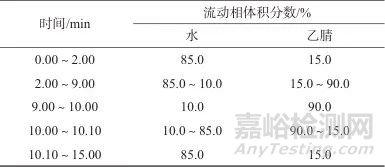
色谱柱:Shim-pack GIST C18柱(100 mm×2.1 mm,2 μm,日本岛津公司);流动相:A相为水,B相为乙腈,流量为0.25 mL/min;柱温:40 ℃;洗脱方式:梯度洗脱,洗脱程序见表2。
表2 梯度洗脱程序
Tab. 2 Gradient elution procedure
1.5.3 质谱仪
质谱进样过程离子化模式:ESI-;接口电压:-3 kV;雾化气流量:3 L/min;加热模块温度:400 ℃;加热气流量:10.0 L/min;接口温度:350 ℃;干燥气流量:10.0 L/min;脱溶剂管温度:250 ℃;扫描模式:多反应监测(MRM)。
1.6 样品测定
将2 mL样品注入Oasis HLB固相萃取柱,并用流量3 mL/min的水洗涤,以转移所有样品并去除杂质等干扰。进样完成后,切换十通阀,将进样Oasis HLB固相萃取柱同UHPLC色谱柱串联,流动相以0.25 mL/min的流量将分析物从Oasis HLB固相萃取柱洗脱下来,在UHPLC色谱柱中进行聚焦和分离并进入质谱检测。同时,另一根Oasis HLB固相萃取柱使用ACN进行再生,流量3 mL/min,再生时间2 min,再使用水进行平衡。检测过程中两根Oasis HLB固相萃取柱交替使用,节省Oasis HLB固相萃取柱再生、平衡时间,提高分析效率。样品检测完成后采用内标法定量分析。
2、 结果与讨论
2.1 MRM参数优化
2.1.1 前体离子质荷比
用初始流动相稀释氯霉素、甲砜霉素和氯甲砜霉素,分别配制成质量浓度为50 ng/mL的3种氯霉素标准溶液,对每个标准溶液进行质量数扫描,结果见图1,根据不同质量数所获得信号强度的峰值位置,选择出氯霉素、甲砜霉素和氟甲砜霉素3种氯霉素的前体离子最优质荷比(m/z)分别为320.75、353.95、355.90。

图1 不同前体离子对应的色谱峰峰面积
Fig. 1 Chromatographic peak areas of different precursor ions
2.1.2 碰撞电压
图2为不同碰撞电压条件下3种氯霉素的响应信号相对强度值,获得氯霉素、甲砜霉素和氟甲砜霉素的碰撞电压最优范围分别为15~18 V、20~22 V、9~11 V,经详细优化后进一步缩小最优参数范围,得出氯霉素、甲砜霉素和氟甲砜霉素3种氯霉素的碰撞电压最优值分别为24.0、18.0、13.0 V。
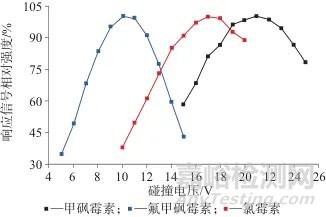
图2 不同碰撞电压条件下3种氯霉素的响应信号相对强度值
Fig. 2 Relative intensity values of response signals of three chloramphenicol species under different collision voltage CE conditions
2.1.3 Q1偏转电压
图3为3种氯霉素在不同的Q1偏转电压下获得的信号强度,利用信号强度峰值所在的Q1偏转电压范围获得3种氯霉素的最优Q1偏转电压参数,由此得到氯霉素、甲砜霉素和氟甲砜霉素3种氯霉素的偏转电压Q1最优值分别为24、18、13 V。
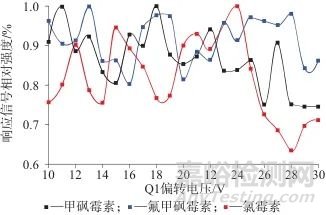
图3 不同Q1偏转电压条件下3种氯霉素的响应信号相对强度值
Fig. 3 Relative intensity values of response signals of three chloramphenicol species under different Q1 deflection voltage conditions
2.1.4 Q3偏转电压
图4为不同Q3偏转电压条件下3种氯霉素的响应信号相对强度值。不同的Q3偏转电压下获得的信号强度有差异,利用信号强度峰值获得3种氯霉素的最优Q3偏转电压,氯霉素、甲砜霉素和氟甲砜霉素3种氯霉素的偏转电压Q3最优值分别为27、21、22 V。
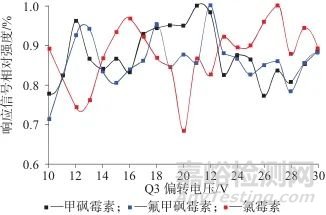
图4 不同Q3偏转电压条件下3种氯霉素的响应信号相对强度值
Fig. 4 Relative intensity values of response signals of three chloramphenicol species under different Q3 deflection voltage conditions
2.1.5 碰撞产物离子质荷比
对3种氯霉素标样进行测试,最终对信号离子收集分析时,除母体离子之外,经过Q2碰撞反应后的产物离子是进行浓度测定的必要物质。图5为不同荷质比条件下3种氯霉素的相对强度值。通过对信号强度峰值的质量数扫描范围确定对产物离子进行分析的最佳质荷比(m/z),氯霉素、甲砜霉素和氯甲砜霉素的产物离子最优质荷比分别为151.90、185.05、185.10。
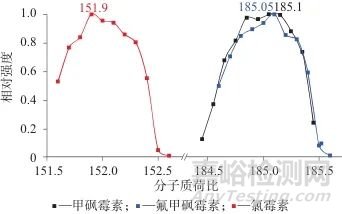
图5 不同荷质比条件下3种氯霉素的相对强度值
Fig. 5 Relative intensity values of three chloramphenicol species under different charge-mass ratio conditions
进行数据分析之后发现碰撞电压对灵敏度有较大影响,偏转电压Q1、偏转电压Q3等影响较小。在此基础上建立多反应监测(MRM)采集模式,3种氯霉素的MRM采集最佳参数见表3。
表3 6种氯霉素类抗生素的MRM条件
Tab. 3 MRM conditions of six chloramphenicol antibiotics
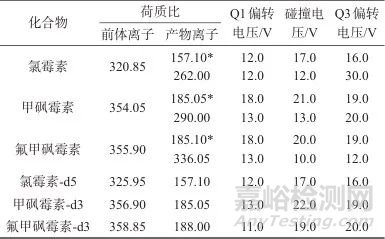
注:*表示定量离子
2.2 离子源参数优化
在液相色谱-质谱检测方法中,离子源参数对方法灵敏度也有较大影响。分别对离子源接口电压、接口温度、脱溶剂管温度等参数进行优化,不同参数下的色谱峰面积如图6所示。最终确认离子源最佳参数为:接口电压4 kV (负离子模式),接口温度400 ℃,脱溶剂管温度150 ℃。
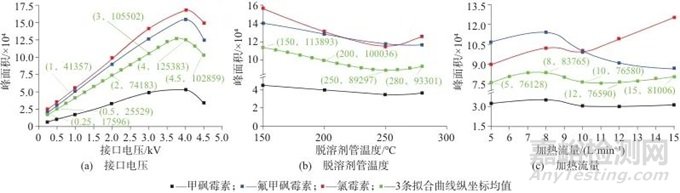
图6 3种氯霉素离子源参数
Fig. 6 Ion source parameters of three chloramphenicol
2.3 分析方法建立
实验先期优化质谱参数,包括离子对、Q1偏转电压、碰撞电压、Q3偏转电压及流动相类型选择,从而建立氯霉素类抗生素超高压液相色谱-四极杆串联质谱分析方法,在此基础上进行方法转移,优化在线固相萃取进样条件,建立在线在线固相萃取-超高压液相色谱-四极杆串联质谱的氯霉素类抗生素检测方法。在此条件下,分析时间15 min,混合标准样品溶液色谱图见图7,溶液中目标物质量浓度均为1 ng/L。
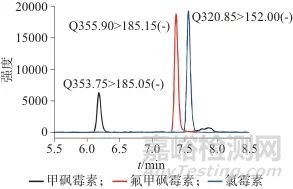
图7 3种氯霉素类抗生素的色谱图
Fig. 7 Chromatograms of three chloramphenicol antibiotics
2.4 线性范围和检出限
在最优的质谱条件下,以各目标物质量浓度为横坐标,目标物峰面积与内标峰面积的比值为纵坐标,采用内标法绘制标准曲线,3种化合物的线性范围、线性方程、相关系数、检出限、见表4。由表4可见,在0.5~50 ng/L浓度范围内线性关系良好,线性相关系数均大于0.999 5,以3倍信噪比确定检出限,获得氯霉素类抗生素的最低检出限为0.03~0.12 ng/L。比较其他方法测定环境水质中氯霉素类抗生素的文献方法,该方法的灵敏度有很大程度提高,可以应用于实际环境样品痕量氯霉素类抗生素的监测[25]。
表4 3种化合物的线性范围、线性方程、相关系数、检出限
Tab. 4 Linear range,linear equations,correlation coefficients,limit of detection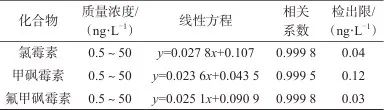
2.5 加标回收和精密度试验
取某湖水样品中添加质量浓度为1、5、20 ng/L的氯霉素类抗生素混合标准溶液,测定其中抗生素的含量,计算回收率,各加标样品平行测定3次,结果见表5。由表5可见,氯霉素类抗生素的加标回收率为85.0%~123.0%,说明该方法准确性良好。
表5 3种化合物的样品加标回收试验结果
Tab. 5 Sample spike recovery test results of three compounds
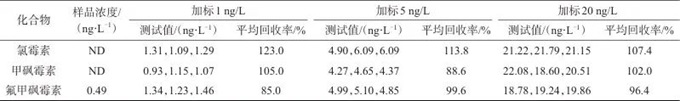
注:ND表示未检出。
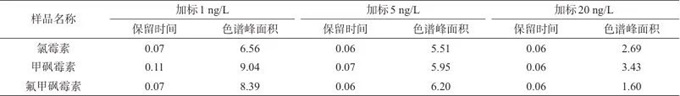
对低、中、高3个质量浓度(1、5、20 ng/L)的氯霉素混合标准溶液连续测定8次,考察分析方法保留时间和色谱峰面积的相对标准偏差,结果见表6。由表6可见,氯霉素类抗生素的保留时间和色谱峰面积测试值的相对标准偏差分别不超过0.11%和9.04%,表明方法精密度高。
表6 3种化合物的精密度试验测定值的相对标准偏差
Tab. 6 Relative standard deviation of precision test measurements for three compounds ( % )
3、 结语
建立了环境水中氯霉素类抗生素的在线固相萃取系统和三重四极杆质谱仪联用分析方法。该方法将样品富集、净化和分析高度集成,在17 min内完成氯霉素类抗生素的上样、富集、分离和测定。具有自动化程度高,灵敏度高,适用时间长等优点,并能提供实时监控信息。该方法补充了国家水质标准体系中对氯霉素类抗生素的检测标准和限值要求的检测方法空白,为可靠、快速、准确、高灵敏度地监测环境水中痕量的氯霉素类抗生素提供了技术支撑。
参考文献:
1 张国栋,董文平,刘晓晖,等.我国水环境中抗生素赋存、归趋及风险评估研究进展[J].环境化学,2018,37(7):1 491.
ZHANG Guodong,DONG Wenping,LIU Xiaohui,et al. Occurrence,fate and risk assessment of antibiotics in water environment of China[J]. Environmental Chemistry,2018,37(7):1 491.
2 KLEIN E Y,BOECKEL T P V,MARTINEZ E M,et al. Global increase and geographic convergence in antibiotic consumption between 2000 and 2015[J]. Proc Natl Acad Sci USA,2018,115(15):3 463.
3 赵莉云.兽药中氯霉素类抗生素的药理作用及用法用量[J].现代畜牧科技,2013(10):175.
ZHAO Liyun. Pharmacologic effects and dosage of chloramphenicol antibiotics in veterinary medicine[J]. Modern Animal Husbandry Science & Technology,2013(10):175.
4 陈眷华,彭羽.氯霉素类抗生素药物对人类健康的威胁[J].贵州畜牧兽医,2006,30(4):17.
CHEN Juanhua,PENG Yu. Threats to human health from chloramphenicol antibiotic drugs[J]. Guizhou Journal of Animal Husbandry & Veterinary Medicine,2006,30(4):17.
5 周正红,邓斌,林保银.氯霉素类抗生素残留分析研究进展[J].肉类研究,2006(2):34.
ZHOU Zhenghong,DENG Bin,LIN Baoyin,New study on the analysis testing methods of Chloramphenicols residues[J]. Meat Research,2006(2):34.
6 DENG W J,LI N,YING G G. Antibiotic distribution,risk assessment,and microbial diversity in river water and sediment in Hongkong[J]. Environmental Geochemistry and Health,2018,40:2 191.
7 邓力,李法松.水环境中抗生素污染现状与检测方法[J].山东农业工程学院学报,2020,37(10):43.
DENG Li,LI Fasong. A review on present situation and detection methods of antibiotic pollution in water environment[J]. The Journal of Shandong Agriculture and Engineering University,2020,37(10):43.
8 张苏珍,王益军,田蕴,等.水体中抗生素污染来源及检测方法研究进展[J].江西农业学报,2019,31(11):111.
ZHANG Suzhen,WANG Yijun,TIAN Yun,et al. Research advance in sources and detection methods of antibiotic contamination in water[J]. Acta Agriculturae Jiangxi,2019,31(11):111.
9 宋杰,宋燕青,王勇鑫,等.微生物法在检测牛奶中氯霉素残留的应用[J].河北师范大学学报(自然科学版),2005,29(1):85.
SONG Jie,SONG Yanqing,WANG Yongxin,et al. Determination of chloramphenicol residues in milk by bioassay,Journal of Hebei Normal University (Natural Science Edition),2005,29(1):85.
10 任帅,丁乔棋,李丽,等.新型氯霉素化学发光芯片免疫检测方法的建立及应用[J].分析化学,2018,46(10):1 581.
REN Shuai,DING Qiaoqi,LI Li,et al. Development and application of a novel chemiluminescence chip immunoassay for detection of chloramphenicol[J]. Chinese Journal of Analytical Chemistry,2018,46(10):1 581.
11 杨秋红,艾晓辉,李荣,等.固相萃取-气相色谱法同时检测水产品中的氯霉素、甲砜霉素、氟苯尼考和氟苯尼考胺[J].分析试验室,2015,34(5):533.
YANG Qiuhong,AI Xiaohui,LI Rong,et al. Simultaneous determination of chloramphenicol,thiamphnicol,florfenicol and forfenicol-amine in aquatic products by gas chromatographic method with solid phase extraction[J]. Chinese Journal of Analysis Laboratory,2015,34(5):533.
12 李鹏,邱月明,蔡慧霞,等.气相色谱-质谱联用法测定动物组织中氯霉素、氟甲砜霉素和甲砜霉素的残留量[J].色谱,2006,24(1):14.
LI Peng,QIU Yueming,CAI Huixia,et al. Simultaneous determination of chloramphenicol,thiam-phenicol,and florfenicol residues in animal tissues by gas chromatography/mass spectrometry[J]. Chinese Journal of Chromatography,2006,24(1):14.
13 王勇,王钊.固相萃取-高效液相色谱三重四级杆质谱联用法在北方河流水体氯霉素类抗生素测定中的应用[J].海河水利,2016(6):65.
WANG Yong,WANG Zhao. Application of solid phase extraction-high performance liquid chromatography-triple quadrupole mass spectrometry for the determination of chloramphenicol antibiotics in northern river waters[J]. Haihe Water Resources,2016(6):65.
14 郁宏燕,熊晓辉,游京晶,等.液相色谱-质谱法测定乳及乳制品中氯霉素类抗生素的含量[J].食品安全质量检测学报,2017(4):1 485.
YU Hongyan,XIONG Xiaohui,YOU Jingjing,et al. Determination of chloramphenicols in milk and dairy products by liquid chromatography-mass spectrometry[J]. Journal of Food Safety and Quality,2017(4):1 485.
15 尹燕敏,沈颖青,朱月芳,等.超高效液相色谱-串联质谱法同时测定水和沉积物中磺胺类、喹诺酮类和氯霉素类抗生素残留[J].分析科学学报,2015,31(02):228.
YI Yanmin,SHEN Yingqing,ZHU Yuefang,et al. Simultaneous determination of sulfonamides,quinolones and chloramphenicols in water and sediment samples by ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Analytical Science,2015,31(02):228.
16 王娅南,彭洁,谢双,等.固相萃取-高效液相色谱-串联质谱法测定地表水中40种抗生素[J].环境化学,2020,39(1):188.
WANG Yanan,PENG Jie,XIE shuang,et al. Determination of 40 antibiotics in surface water by solid phase extraction-high performance liquid chromatography-tandem mass spectrometry[J]. Environmental Chemistry,2020,39(1):188.
17 封梦娟,杨正标,张芹,等.高效液相色谱-串联质谱法同时测定表层水体中5类40种抗生素[J].色谱,2019,37(5):525.
FENG Mengjuan,YANG Zhengbiao,ZHANG Qin,et al. Simultaneous determination of five types of 40 antibiotics in surface water using high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography,2019,37(5):525.
18 庄姜云,刘建芳,李红权,等.内标液相色谱-串联质谱法测定蜂蜜中氯霉素、甲砜霉素和氟苯尼考残留[J].食品安全质量检测学报,2021,12(5):1 966.
ZHUANG Jiangyun,LIU Jianfang LI Hongquan,et al. Determination of chroramphenicol,sulfoxycin and fluorphenicol residues in honey by liquid chromatography-tandem mass spectrometry with interior label[J]. Journal of Food Safety and Quality,2021,12(5):1 966.
19 李丽,王建宇,王蕴平,等.在线固相萃取-超高效液相色谱-三重四极杆串联质谱法检测水中痕量有机磷农药和五氯酚[J].环境化学,2019,38(9):2 166.
LI Li,WANG Jianyu,WANG Yunping,et al. Detection of trace pentachlorophenol organophosphorus pesticides in water by on-line solid phase extraction-ultra-high performance liquid chromatography-triple quadrupole tandem mass spectrometry[J]. Environmental Chemistry,2019,38(9):2 166.
20 许泽君,景霞,孙芳,等.在线固相萃取净化-高效液相色谱法测定人血浆中的霉酚酸[J].分析测试学报,2020,39(1):162.
XU Zejun,JING Xia,SUN Fang,et al. Determination of mycophenolic acid in human plasma by high performance liquid chromatography with oline solid phase extraction purification[J]. Journal of Instrumental Analysis,2020,39(1):162.
21 徐小民,张京顺,蔡增轩,等.在线固相萃取-液相色谱-串联质谱法检测蘑菇中毒患者尿液中痕量α-鹅膏毒肽[J].色谱,2020,38(11):1 281.
XU Xiaomin,ZHANG Jingshun,CAI Zengxuan,et al. Determination of trace ɑ-amanitin in urine of mushroom poisoning patient by online solid phase extraction-liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography,2020,38(11):1 281.
22 徐建业,吕贞,茆永晶,等.在线固相萃取-液相色谱串联质谱法测定污水厂尾水中6种酸性药物[J].中国环境监测,2021,37(2):128.
XU Jianye,LYU Zhen,MAO Yongjing,et al. Determination of six acidic drugs in tailwater of wastewater treatment plant by large volume online-SPE coupled with liquid chromatography-tandem mass spectrometry[J]. Environmental Monitoring in China,2021,37(2):128.
23 LIU R Z,RUAN T,WANG T,et al. Determination of nine benzotriazole UV stabilizers in environmental water samples by automated on-line solid phase extraction coupled with high-performance liquid chromatography-tandem mass spectrometry[J]. Talanta,2014,120:158.
24 金津,宋善军,彭子娟,等.在线固相萃取-高效液相色谱-电感耦合等离子体质谱法同时测定血清中多溴二苯醚及其羟基代谢产物[J].分析化学,2021,49(4):520.
JIN Jin,SONG Shanjun,PENG Zijuan,et al. Determination of polybrominated diphenyl ethers and hydroxylated analogues in serum using high performance liquid chromatography-inductively coupled plasma mass spectrometry with online solid phase extraction[J]. Chinese Journal of Analytical Chemistry,2021,49(4):520
25 李莉,郑璇,张晓岭,等.高效液相色谱-串联质谱法同时测定水体中氯霉素类抗生素[J].化学分析计量,2020,29(5):57.
LI Li,ZHENG Xuan,ZHANG Xiaoling,et al. Determination of chloramphenicol antibiotics in water by HPLC-MS/MS[J]. Chemical Analysis and Meterage,2020,29(5):57.
引用本文: 彭君,满倩茹,黄钢,等 . 在线固相萃取-高效液相色谱串联质谱法快速测定水中痕量氯霉素类抗生素[J]. 化学分析计量,2024,33(10):16. (PENG Jun, MAN Qianru, HUANG Gang, et al. Rapid determination of trace chloramphenicol antibiotics in water by online solid phase extraction coupled with high performance liquid chromatography tandem mass spectrometry[J]. Chemical Analysis and Meterage, 2024, 33(10): 16.)

来源:化学分析计量


