您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2025-01-03 08:49
1、 类器官是什么
类器官(Organoids)是一种在体外三维(3D)环境中培养的细胞簇集合,这些细胞簇能自组织并分化成具有与体内器官相似的结构和功能的微型模型。类器官技术的发展可以追溯到20世纪初,并经历了多个重要的发展阶段。
早在1907年,H.V. Wilson 对分离的海绵细胞进行研究,观察到它们能自我组织并再生一个完整的有机体,H.V. Wilson(Herbert Vose Wilson)是一位美国海洋生物学家。
在19世纪末至20世纪初,科学界对于细胞是如何组成复杂多细胞生物的理解还处于起步阶段。当时的一个关键问题是,单个细胞是否能够独立生存并重新组合形成完整的生物体。海绵作为多孔的水生生物,由相对简单的细胞组成,成为了研究这些问题的理想对象。

图片来源:https://www.technologynetworks.com/cell-science/news/sponge-cells-successfully-cultured-in-3d-357761
1907年,H.V. Wilson 进行了一项具有里程碑意义的实验。他将海绵个体解离成了单个细胞,然后将这些细胞放在海水中,观察它们的行为。Wilson 发现,当这些单独的海绵细胞被放在一起时,它们会自发地重新聚集,并最终重建出与原始海绵形态相似的结构。这个实验的结果证明了单个细胞具有记忆其原始组织结构的信息,并且能够与其他细胞合作来重建复杂的生物体。
这一发现挑战了当时的科学观念,即认为一旦细胞之间的联系被破坏,就无法恢复原有的组织结构。Wilson 的工作强调了细胞间通信和合作在多细胞生物发育中的重要性。Wilson 的实验激发了许多后续研究,包括对其他简单多细胞生物(如海鞘和水螅)的细胞重组能力的研究。
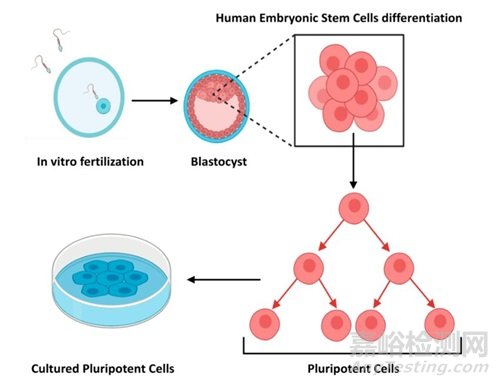
图片来源:https://images.app.goo.gl/XxXLx1S3peiQu2gR8
1944年至1988年间,从两栖动物原肾的体外培养到人类胚胎干细胞系的建立等多个重要的科研进展,不仅证实了细胞的自我组织能力和维持分化状态的潜力,还为后续的多能干细胞研究和类器官技术的发展奠定了基础。
2、 重要的节点——iPSCs
时间来到2006年,日本的山中伸弥(Shinya Yamanaka)团队报告了从成年小鼠皮肤纤维母细胞诱导产生诱导多能干细胞(Induced Pluripotent Stem Cells, iPSCs)。这项研究的成果迅速引起了全球科学界的关注,并在随后几年内引发了大量相关研究。2012年,山中伸弥因此项成就与英国科学家约翰·戈登(John Gurdon)共同获得了诺贝尔生理学或医学奖。
在2006年之前,科学家们普遍认为,一旦细胞完成了分化过程,就无法再回到未分化的状态。这意味着,成年人体内的细胞,比如皮肤细胞,已经失去了变成其他类型细胞的能力。但是,如果能够找到一种方法让这些已经分化的细胞“回退”,那么就可以为治疗各种疾病提供无限的可能性。
而故事的主角——山中伸弥(Shinya Yamanaka),一名干细胞研究专家,他的研究彻底改变了我们对细胞可塑性的理解,并为再生医学开辟了新的道路。2006年,他和他的团队发表了一篇划时代的研究论文,展示了如何将成年小鼠的皮肤细胞转换为具有类似胚胎干细胞特性的细胞,这些细胞被称为诱导多能干细胞(iPSCs)。
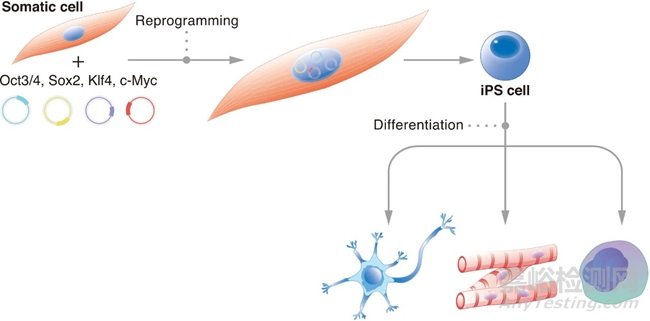
图片来源:https://images.app.goo.gl/yfXBDX33Kc2kKShS6
他们选择了24个已知与胚胎干细胞特性相关的基因,试图找出哪些基因能够使成熟的细胞恢复到未分化状态。通过使用逆转录病毒作为载体,将这些基因导入到成年小鼠的皮肤纤维母细胞中。经过一系列的实验和筛选,他们发现只有四个基因——Oct3/4、Sox2、c-Myc 和 Klf4——足以将成年细胞重编程为多能干细胞。
这些被重编程的细胞表现出与胚胎干细胞非常相似的特征,例如能够自我更新并且具有分化成身体内所有细胞类型的能力。山中伸弥将这些细胞命名为诱导多能干细胞(iPSCs)。这一发现不仅证明了细胞的命运是可以被逆转的,而且提供了一种无需使用胚胎就能获得多能干细胞的方法,从而避开了与使用胚胎干细胞相关的伦理争议。
3、 里程碑——肠道类器官
而真正标志着类器官研究时代开始的事件,是2009年Hans Clevers 教授团队使用来自小鼠肠道的成体干细胞培育出了首个肠道类器官。在Hans Clevers之间,科研人员已经能够利用胚胎干细胞或诱导多能干细胞(iPSCs)培育出一些简单的组织结构,但对于如何使用成体干细胞在体外构建复杂的三维组织结构了解甚少。
肠道是一个高度再生的器官,每几天就会更新一次,因此成为研究细胞再生机制的理想模型。肠道内部有一层单层上皮细胞构成的隐窝-绒毛结构,其中含有负责细胞再生的干细胞。Hans Clevers团队首先从成年小鼠的肠道隐窝中分离出了干细胞。为了促进这些干细胞的增殖和分化,他们设计了一种特殊的三维培养系统,该系统包含了模拟肠道微环境的基质成分和必要的生长因子。这些条件能够支持干细胞在体外形成类似于肠道隐窝-绒毛结构的小型组织团块,即所谓的“类器官”。
通过这种方法,Hans Clevers 团队成功地培育出了能够自我组织并分化成包含所有主要肠道细胞类型(包括吸收细胞、分泌细胞和潘氏细胞等)的肠道类器官。这些类器官不仅在形态上与真实的肠道组织相似,而且在功能上也表现出了类似的特性,例如能够响应营养物质和分泌消化酶。
这一科学发现证明了使用成体干细胞在体外构建功能性组织结构的可能性,为研究器官发育、疾病建模和药物筛选提供了新的平台。肠道类器官的成功培育也为研究肠道疾病(如炎症性肠病和肠癌)的发病机制提供了有力工具,并为开发新的治疗方法铺平了道路。
4、 类器官 vs 动物实验模型
利用类器官技术替代动物实验来构建疾病模型进行科学研究,是近年来讨论的热门话题。2023年1月10日,FDA宣布将不再要求新药上市前必须进行动物试验。这也预示着类器官应用于药物开发、基础科学研究的需求前景将变得更广阔。
类器官和动物模型相比,具有多个优势。
1. 更接近人类生理条件
人类特异性:类器官是由人类细胞(通常是诱导多能干细胞 iPSCs 或成体干细胞)培养而成,因此能够更准确地反映人类的生理和病理特征,避免了物种间的差异。
个体化模型:可以从特定患者的细胞中生成类器官,从而创建个性化的疾病模型,这对于研究遗传性疾病和个体化治疗尤为重要。
2. 伦理优势
减少动物实验:类器官技术可以减少对实验动物的需求,符合动物伦理和福利的要求,避免了动物实验中可能的痛苦和道德争议。
伦理接受度高:使用人类细胞培养的类器官更容易被公众和社会接受,尤其是在涉及动物实验的敏感领域。
3. 成本效益
成本降低:相对于长期的动物实验,类器官培养的成本较低,尤其是当需要进行大规模筛查或高通量实验时。
资源优化:类器官培养所需的时间和空间相对较少,可以更高效地利用实验室资源。
4. 高通量和标准化
高通量筛选:类器官可以批量生产,适用于高通量药物筛选和毒理学测试,提高了研究效率。
标准化:通过优化培养条件和标准化操作流程,可以确保类器官的一致性和可重复性,提高实验结果的可靠性。
5. 功能和结构的多样性
多器官模型:可以同时培养多种类器官,构建多器官相互作用的模型,更好地模拟人体内的复杂生理环境。
特定功能:类器官可以包含多种细胞类型和组织结构,更全面地模拟器官的功能,例如肝脏类器官可以进行代谢研究,脑类器官可以用于神经发育和疾病研究。
类器官技术在替代动物实验和构建疾病模型方面具有显著的优势,包括更高的生理相关性、伦理优势、成本效益和高通量筛选能力。然而,技术局限性、标准化问题、规模化生产和伦理法律问题仍然是需要克服的挑战。随着技术的不断进步和标准化操作的完善,类器官技术有望在未来为科学研究和临床应用带来更多突破。

来源:实验老司机


