您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-02-13 08:41
通常地,在质粒构建过程中,T4 DNA连接酶连接效率不高问题可能主要包含以下几个方面,DNA底物的质量和末端状态,确保其是否符合连接要求。其次,优化连接酶的使用条件,包括酶的用量、反应温度和时间等。最后就是反应体系的组成,如添加辅助物质或pH值。
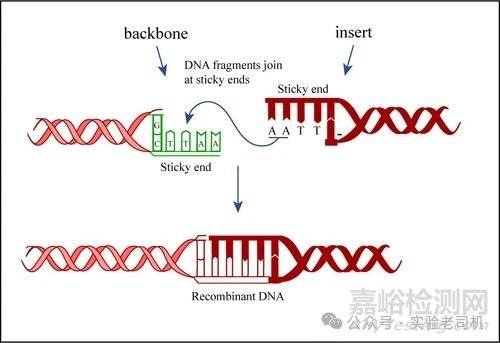
具体的解决办法如下:
1.底物DNA质量
(1)DNA纯度检查
1)确保待连接的DNA片段纯度高,没有杂质(如蛋白质、RNA或其他化学物质)。可以通过琼脂糖凝胶电泳后切胶回收来纯化DNA。在切胶回收过程中,要使用高质量的琼脂糖凝胶和合适的核酸染料,避免使用可能会抑制酶活性的染料。例如,使用溴化乙锭(EB)染色时,要注意其毒性,并在操作后妥善处理含有EB的凝胶和缓冲液。
2)对于微量的DNA样本,可以使用更灵敏的纯化方法,如磁珠法纯化DNA,它能够有效地去除杂质,提高DNA的纯度。
(2)DNA末端状态优化
1)平滑末端连接:如果是平滑末端的DNA片段连接,T4 DNA连接酶的连接效率通常比粘性末端低。可以考虑在连接反应体系中加入适量的聚乙二醇(PEG),PEG可以使DNA分子聚集,增加局部DNA浓度,从而提高连接效率。一般PEG-8000的终浓度为5%~10%。
2)粘性末端连接:对于粘性末端的DNA片段,要确保末端没有被核酸外切酶降解。在制备DNA片段后,尽快进行连接反应,或者将DNA样本保存在-20℃以下。如果怀疑末端有损伤,可以在连接反应前使用DNA聚合酶的Klenow片段对末端进行补平或修复。
Klenow片段:Klenow片段是通过枯草杆菌蛋白酶对大肠杆菌DNA聚合酶I进行有限水解得到的。水解后,Klenow片段保留了5'→3'聚合酶活性和3'→5'外切酶活性,但丧失了5'→3'外切酶活性。常常被用于DNA末端处理。
2.连接酶及反应体系优化
(1)连接酶活性和用量
1)检查T4 DNA连接酶的活性。使用新鲜的、未过期的酶,并按照供应商推荐的保存条件进行保存(通常是-20℃或更低温度)。如果酶的活性降低,可以尝试更换新的酶批次。
2)适当增加连接酶的用量。一般情况下,按照说明书的标准用量进行反应,但如果连接效率一直很低,可以在一定范围内(如1~2倍)增加酶的用量来提高连接效率。不过,过量的酶可能会导致非特异性连接或其他副反应。
(2)反应缓冲液优化
1)使用合适的连接反应缓冲液。T4 DNA连接酶通常有配套的缓冲液,确保缓冲液的成分完整,没有受到污染或变质。有些缓冲液中含有ATP,它是连接反应的能量来源。如果缓冲液中的ATP降解,会影响连接效率,可以考虑添加新鲜的ATP(终浓度一般为1~5mM)。
2)调整反应缓冲液的pH值。T4 DNA连接酶的最适pH值在7.5~7.8之间,检查缓冲液的pH是否在这个范围内。如果pH值不合适,可以使用适当的酸或碱进行微调。
3.反应条件优化
(1)温度和时间控制
1)T4 DNA连接酶的最适反应温度是16℃左右。可以尝试在这个温度下进行连接反应,反应时间一般为4~16h。如果连接效率仍然很低,可以适当延长反应时间,但过长的反应时间可能会增加背景连接和其他副反应的发生。
2)对于一些难以连接的片段,也可以尝试采用分步连接的方法。例如,先在较低温度(4℃)下进行过夜连接,然后在16℃下再反应几个小时,这样可以让连接反应更充分。
(2)反应体系体积优化
尽量减少连接反应体系的体积,以提高DNA片段和连接酶的浓度。但也要注意,反应体积过小可能会导致反应成分不均匀,一般反应体积在10~20μL比较合适。另外,酶切质粒与酶切目的片段的比值一般为1:3或者1:4,可以适当减少假阳性等问题。同时,在加入反应成分时,要确保准确无误,使用精密的移液器,并注意避免产生气泡,因为气泡可能会影响反应体系的成分分布。

来源:实验老司机