您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-01-02 08:44
DNA凝胶回收即从琼脂糖凝胶中提取DNA的过程,大致经过切胶、溶解、离心分离等步骤,常规回收过程一般使用试剂盒实现,其常见问题及注意事项如下:
1.对于需要回收的DNA,跑胶时应选择梳齿宽、薄的梳子,同时保证上样量充足。
2.切胶过程中,若不确定条带具体位置,可在紫外照射下进行,快速切胶,防止紫外照射时间过久导致DNA变性。同时,切胶的刀片保持干净,防止污染,切胶时尽量只切有条带的胶,减小切胶体积,但务必保证将条带胶全部切下,将切下的胶块切小后全部收集到离心管内。
3.加入溶解液溶胶时,在55℃-65℃的水浴(具体温度由说明书决定)中进行,同时2-3min震荡混匀一次,保证琼脂糖凝胶充分溶解,否则易导致回收效率过低,正常全部溶解后溶液呈淡黄色。
4.过柱过程中保持柱子和回收管干净,每一步充分离心,同时保证每一步加入正确的试剂。
5.洗脱液提前在55℃-65℃水浴中温浴。
6.加入洗脱液前,将柱子开盖,室温晾5-10min左右,最大程度上将酒精挥发干净,酒精污染也是后续影响A260/A230比值的重要因素。
7.加入洗脱液体积不宜太多,以30-50μl为宜,洗脱液太多会造成回收浓度过低,洗脱液量太少则不宜洗脱,加入洗脱液时快速垂直滴到膜中央。加入后需静置一定长的时间,充分洗脱。同时,洗脱液最后也可用实验用的超纯水,但需保证PH值在7.0-8.5之间。
8.测浓度时,重点关注A260/A280的比值,以1.8-2为宜。若回收成功无污染,A260/A230比值一般在1.8以上。
9.凝胶回收试剂盒中,部分试剂需加入无水乙醇后再使用,同时注意试剂需在有效期内。
在实际胶回收的过程中,按说明书常规操作也会出现回收效率低、回收产物污染等情况,以我做实验为例,在回收过程中均按说明书操作,测浓度时比值较低,如下图所示:
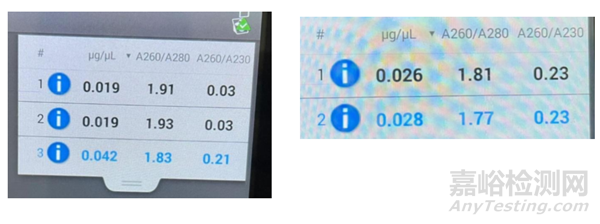
在经过重复实验比值仍未提高的基础上,我们继续往下做了后续的实验,对后续的实验影响不太明显。同时,为提高A260/A230的比值,我们在回收结束后继续做了纯化,也由试剂盒完成,纯化后DNA浓度会比纯化前更低,但比值正常,因此在实际DNA凝胶回收的过程中,可根据回收前的DNA浓度选择是否进行二次纯化。

来源:实验老司机


