您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-08-19 09:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
片仔癀1类NASH新药PZH2109胶囊申报上市。片仔癀药业具有自主知识产权的1类创新药PZH2109胶囊的上市申请获CDE受理,该药品主要用于治疗非酒精性脂肪性肝炎(NASH)。2020年3月,已有同类药物saroglitazar magnesium新药用于治疗NASH获得印度药物管理局(DCGI)批准上市,美国和中国暂无相同靶点相同适应症的药品获批上市。据查询,saroglitazar magnesium是一种新型的PPAR激动剂,是世界上首款获批治疗非肝硬化性NASH的药物。
国内药讯
1.拜耳氯化镭223Ra注射液即将在华获批。拜耳在中国提交的氯化镭223Ra注射液上市申请进入“在审批”阶段,有望近期获批,治疗前列腺癌骨转移。氯化镭223Ra注射液是一种α-粒子辐射放射性治疗药物,最早以Xofigo的商品名在2013年5月获FDA批准,用于治疗晚期去势抵抗前列腺癌的骨转移型。在一项III期ALSYMPCA研究中,氯化镭223Ra联合标准疗法可显著延长患者总生存期(14.9vs11.3个月),将死亡风险降低30%(HR 0.70)。
2.天麦生物口服胰岛素新药启动III期临床。天麦生物与以色列Oramed公司联合开发的重组人胰岛素肠溶胶囊ORMD-0801在国内启动一项III期临床。该研究在口服降糖药血糖控制不佳的2型糖尿病患者中评估联合ORMD-0801治疗的有效性、安全性以及免疫原性。计划入组人数 470 患者。主要研究者由上海交通大学医学院附属瑞金医院的宁光院士担任, 39 家医院来自上海、江苏、广东、北京、河南、黑龙江等18个省市。
3.海思科DPP-4长效抑制剂即将开展Ⅲ期临床。8月17日,海思科发布公告,其DPP-4长效抑制剂HSK7653片已获得伦理批准, 即将在中国2型糖尿病患者中开展评估HSK7653片单药治疗的安全性和有效性的Ⅲ期临床。该研究的组长单位是北京大学人民医院,由纪立农教授担任本研究的主要研究者,全国预计45家研究中心将加入HSK7653的Ⅲ期临床研究。公司计划2020年第四季度开始筛选并入组患者。
4.恒瑞TIM-3单抗启动临床。恒瑞启动一项TIM-3单抗SHR-1702治疗骨髓增生异常综合征或急性髓系白血病的I期临床研究。TIM-3受体是一种表达在免疫细胞和髓系白血病细胞表面的抑制性受体,它的表达水平与急性髓系白血病(AML)和骨髓增生异常综合症(MDS)的严重程度相关。目前,全球尚无TIM-3抗体药物获批上市,Insight全球新药数据库显示,TIM-3靶点的在研新药目前共有10款且大都处于早期临床,进展最快的是诺华的MBG 453,其用于慢性髓单核细胞白血病、骨髓增生异常综合征的适应症已进入 Ⅲ期临床。
5.拜耳与华领医药达成糖尿病新药合作协议。拜耳与华领医药就华领的首创葡萄糖激酶激活剂dorzagliatin在中国的商业化达成独家合作协议。根据协议,华领医药将负责这款新型糖尿病治疗药物的临床开发、注册、产品供应以及分销工作;拜耳将负责该产品在中国市场的营销、推广以及医学教育活动。华领医药将获3亿元人民币的预付款,以及可能高达41.8亿元人民币的里程碑付款;拜耳将根据产品销售额的一定比例获得服务费用。
6.华东医药与荃信生物达成合作协议。华东医药子公司中美华东与荃信生物达成股权投资和产品合作开发协议。华东医药拟对荃信生物进行3.7亿元股权投资,投资完成后持有20.56%股权。同时,双方就荃信生物在研的乌司奴单抗生物类似药QX001S在中国大陆境内达成合作开发和商业化协议,并在产品上市后按照协议约定分享收益。QX001S拟用于治疗银屑病、克罗恩病等,计划明年初启动评估治疗成人中重度斑块状银屑病的Ⅲ期研究。
国际药讯
1.IAP抑制剂治疗头颈癌3年随访结果积极。Debiopharm公司“first-in-class”口服IAP抑制剂Debio 1143,联合放化疗(CRT),治疗高危局部晚期头颈部鳞状细胞癌(LA-SCCHN)的II期临床3年随访结果公布。Debio 1143+CRT方案此前已达到总生存期(OS)的主要研究终点。3年的随访结果证实了近期发表在《柳叶刀》上的2年预期结果的持续性,所有其他关键终点均有统计学上的显著改善,包括无进展生存率翻倍、缓解持续时间更长;Debio 1143+CRT方案的安全性特征与之前观察到的相一致。。
2.鲁宾制药塞克硝唑治疗滴虫病达III期主要终点。鲁宾制药(Lupin Pharma)5-硝基咪唑类抗菌剂Solosec(secnidazole,塞克硝唑)治疗滴虫病女性患者的关键性III期临床结果积极。与安慰剂相比,单剂量Solosec显著提高患者的缓解率或微生物治愈率(92.2%vs1.5%;p<0.001)。详细数据将于IDSOG 2020年会上公布。鲁宾制药计划今年晚些时候向FDA提交Solosec治疗滴虫病的一份补充新药申请。Solosec目前仅被FDA批准治疗成年女性细菌性阴道病(BV)。
3.诺和诺德血友病新药concizumab三项III期项目恢复。诺和诺德宣布,血友病药物concizumab Ⅲ期临床试验(EXPLORER 6、7、8)正在恢复重启。这些临床试验正在研究皮下注射concizumab预防性治疗A型血友病患者和B型血友病患者的疗效和安全性,而不考虑抑制剂的状态。上述试验在2020年3月暂停,原因是Ⅲ期项目中入组的3例患者中发生了非致命性血栓事件。诺和诺德已与有关当局共同为concizumab确定了一条新的研究路径。基于对所有可用数据分析的一份新的安全措施和指南已与FDA达成一致,并且已经解除了临床暂停。
4.创新CDK4/6抑制剂获FDA优先审评资格。FDA受理G1 Therapeutics公司CDK4/6抑制剂trilaciclib的新药申请(NDA),用于正在接受化疗治疗的小细胞肺癌(SCLC)患者。FDA同时授予其优先审评资格,预计在明年2月15日之前做出回复。Trilaciclib是一种“first-in-class”的研究性疗法,它的作用是在化疗期间保护骨髓和免疫系统功能,改善患者预后。该药曾获FDA授予的突破性疗法认定。先声药业拥有这款创新疗法在大中华地区所有适应症的开发和商业化权益。
5.BMS囊获创新IL-12疗法。百时美施贵宝和Dragonfly Therapeutics达成一项合作协议,百时美施贵宝将获得Dragonfly公司的IL-12在研免疫疗法DF6002的全球独家许可。DF6002是一款具有延长半衰期的IL-12细胞因子融合蛋白。它的IND申请已在5月获得FDA的批准。针对晚期实体瘤患者的Ⅰ/Ⅱ期临床试验已启动。根据协议,百时美施贵宝将负责DF6002及其相关产品在全球范围内的开发和任何后续推广。Dragonfly将获得4.75亿美元的前期付款,后续里程碑付款以及产品销售额的分成。
6.吉利德和Tango扩大肿瘤战略合作。吉利德与Tango Therapeutics宣布扩大战略合作,共同发现、开发和商业化针对癌症患者的靶向免疫逃避的创新疗法,合作候选产品的估值高达60亿美元。根据协议,此次吉利德将向Tango支付1.25亿美元的预付款,并对后者进行2000万美元的股权投资。在这次为期7年的合作中,吉利德将有权选择最多15个项目,每个项目的选择加入、延期和里程碑付款的金额高达4.1亿美元,Tango也有资格在净销售额上获得两位数的产品分成。此次合作将替换两家公司首次于2018年签署的协议。
医药热点
1.国药新冠疫苗预计12月底上市。日前,国药中生北京生物制品研究所新冠灭活疫苗生产车间通过国家相关生物安全联合检查,具备了使用条件。围绕相关热点,国药集团董事长刘敬桢表示,国际Ⅲ期临床结束后,新冠灭活疫苗就可以进入审批环节,预计今年12月底能够上市。预计北京生物制品研究所的灭活疫苗年产量能达1.2亿剂,武汉生物制品研究所的灭活疫苗年产量能达1亿剂。两针疫苗价格应在1000块钱以内。
2.广东省乡村医生注册管理调整。近日,广东省卫健委发布《广东省乡村医生注册管理试行办法》,乡村医生注册发生两项调整。调整一:村医执业门槛确定,具有中等医学专业学历的人员,经县级卫生健康行政部门组织的综合理论、技能考试,成绩均合格的,可申领《乡村医生执业证书》。调整二:大专以上学历相关医学专业应届生无需考试,直接拿证。
股市资讯
【亚宝药业】收到国家药监局核准签发的硫辛酸注射液《药品注册证书》
【圣达生物】(1)2020年上半年实现营业收入4.50亿元(+79.51%),归母净利润为1.51亿元(+345.61%),扣非归母净利润1.49亿元(+425.53%)(2)控股股东一致行动人浙江鸿博、万健投资、朱勇刚拟集中竞价方式减持公司股份合计不超过 3,423,779 股,拟以大宗交易方式减持公司股份合计不超过 6,847,558股.
【普利制药】公司及各子公司自2020年01月01至2020年08月17日累计收到各项政府补助资金共计人民币805.69万元
审评动向
1. CDE最新受理情况(08月18日)
无
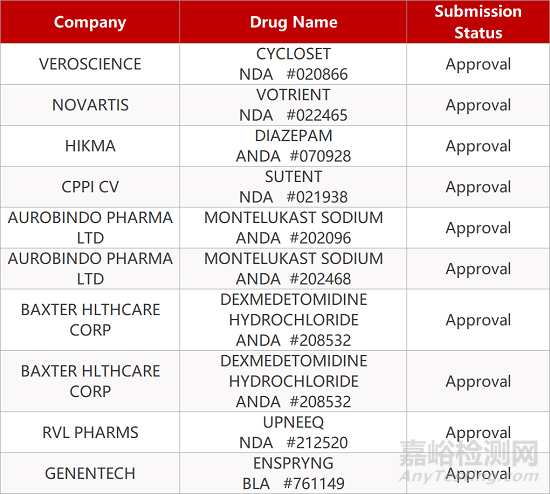
2. FDA最新获批情况(北美08月17日)
- The End -

来源:药研发


