您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-10 09:02
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
卫材仑伐替尼在华获批治疗甲状腺癌。卫材仑伐替尼第2个适应症获国家药监局批准上市,用于治疗分化型甲状腺癌(DTC)患者。在一项SELECT研究(303研究)中,与安慰剂相比,仑伐替尼显著延长放射性碘难治性分化型甲状腺癌患者的无进展生存率(PFS),两组中位PFS分别为18.3个月和3.6个月,具统计学显著性差异。2018年9月,仑伐替尼已在华获批用于治疗既往未接受过全身系统治疗的不可切除的肝细胞癌。
国内药讯
1.豪森奥氮平口腔速溶膜即将获批上市。豪森奥氮平口腔速溶膜2.2类新药上市申请进入“在审批”状态,有望近期获批上市。奥氮平是神经系统药物中的超40亿大品种,豪森药业为该品种的领军企业,2019年在中国公立医疗机构终端市场份额占据64%左右,2020H1跌至48%。目前国内奥氮平仅有普通片以及口崩片获批上市,暂无口腔速溶膜。
2.安进地舒单抗注射液新适应症即将在华获批。安进地舒单抗注射液在中国的第三个上市申请进入行政审批阶段,有望近期获批上市。据悉即将获批的适应症是:多发性骨髓瘤和实体瘤骨转移患者中骨相关事件的预防。地舒单抗是我国第一批临床急需境外新药,由安进原研,目前在全球已获批用于多发性骨髓瘤、实体瘤骨转移引起的骨相关事件的预防、不可切除的或手术切除会导致严重并发症的成人或骨成熟青少年骨巨细胞瘤的治疗、双磷酸盐耐药的高钙血症的治疗及多种骨质疏松等。
3.恒瑞罂粟乙碘油注射液申报上市。恒瑞医药罂粟乙碘油注射液3类仿制上市申请获CDE受理。罂粟乙碘油是一种碘化造影剂,该品种恒瑞此前已按6类注册申报并已获批上市,用于碘缺乏病的治疗和淋巴造影。国内目前仅有恒瑞医药一家企业生产销售罂粟乙碘油注射液。Guerbet公司开发的碘化油注射液Lipiodol是全球首个获批的碘化造影剂,据公开数据,2015年Lipiodol的全球销售额为3349.8万美元,中国市场销售额为76.1万美元。
4.灵北偏头痛预防新药在中国获批临床。灵北公司CGRP单抗eptinezumab注射用浓溶液获国家药监局一项临床试验默示许可,拟定适应症为:用于偏头痛和药物过量性头痛双重诊断患者的偏头痛预防性治疗。在两项Ⅲ期临床(治疗发作性偏头痛的PROMISE-1研究和治疗慢性偏头痛的PROMISE-2研究)中,eptinezumab均达到主要终点:1-3个月的平均每月偏头痛天数(MMD)减少。今年2月,eptinezumab已在美国获批上市,是FDA批准的首个用于预防偏头痛的静脉注射药物。
5.复宏汉霖第二款COVID-19治疗药物在美获批临床。复宏汉霖ACE2-Fc受体融合蛋白HLX71用于治疗COVID-19的临床申请获FDA批准。HLX71也是继HLX70(新冠病毒中和抗体)之后复宏汉霖第二款获FDA临床批准的COVID-19治疗候选药物。在临床前研究中,HLX71能够显著抑制SARS-CoV-2病毒感染,且静脉注射HLX71具有良好的安全性。目前,复宏汉霖正探索HLX70和HLX71的协同作用,在联合用药分析中,两款候选药物已展现出协同阻断RBD与细胞表面hACE2结合的能力。
国际药讯
1.阿斯利康替格瑞洛新适应症获FDA批准。阿斯利康替格瑞洛(ticagrelor,Brilinta)在美国获批用于降低急性缺血性卒中的风险,这些卒中患者的美国国立卫生研究院卒中量表评分≤5或具有高危短暂性脑缺血发作(TIA)的风险。替格瑞洛是一种口服P2Y12受体拮抗剂,此前已获FDA批准用于急性冠状动脉综合征(ACS)患者,降低血栓性心血管事件的发生率;以及用于降低冠状动脉疾病高危患者首次心脏病发作或中风的风险。
2.囊性纤维化新药Kalydeco获欧盟扩展标签。欧盟委员会(EC)批准Vertex公司囊性纤维化(CF)治疗药物Kalydeco(ivacaftor)扩展标签,用于治疗年龄≥4个月、体重≥5公斤的CF婴儿患者。具体为,在CFTR基因中存在R117H突变或CFTR基因存在下列9种突变之一(G551D、G1244E、G1349D、G178R、G551S、S1251N、S1255P、S549N、S549R)的CF婴儿患者。值得一提的是,Kalydeco是首个也是唯一一个治疗年龄低至4个月婴儿患者CF根本病因的药物。在美国和欧盟,Kalydeco之前已被批准,用于治疗≥6个月的CFTR基因中存在特定突变的CF患者。
3.辉瑞托法替尼治疗AS达Ⅲ期临床终点。辉瑞JAK抑制剂托法替尼(Xeljanz)治疗活动性强直性脊柱炎(AS)的Ⅲ期临床达主要和关键性次要终点。与安慰剂组相比,托法替尼组在第16周时达到ASAS20应答的患者比例显著提高(56.4%vs29.4%,p<0.0001);达ASAS40应答的患者比例显著更高(40.6%vs12.5%,p<0.0001)。目前,FDA已受理托法替尼的补充新药申请,预计明年第二季度做出回复。如果获批,将是托法替尼斩获的第5个适应症。
4.诺华IL-17A单抗治疗银屑病关节炎临床结果积极。诺华司库奇尤单抗(Cosentyx)治疗银屑病关节炎(PsA)的 IIIb期ULTIMATE试验结果积极。能量多普勒超声(PDUS)滑膜炎评分(GLOESS)结果显示,Cosentyx与安慰剂相比在第12周滑膜炎方面有显著优势,从第1周开始观察到早期改善;Cosentyx还显著改善了关键次要终点,包括ACR20(分别为68%vs34%)、ACR50(分别为46%vs9%)等;Cosentyx在12周内的安全性与先前的研究一致。诺华将在EULAR2021年会上公布该试验的24周完整数据,以及在ACR 2021年会上公布最终分析结果。
5.优时比TNF抑制剂Ⅳ期研究数据积极。优时比TNF抑制剂Cimzia(certolizumab pegol)治疗中轴型脊柱关节炎(axSpA)患者急性前葡萄膜炎(AAU)的Ⅳ期C-VIEW研究数据积极。两年期间,与基线相比,Cimzia将AAU复发率降低82%(率比[95%CI]:0.18[0.12,0.28],p<0.001);Cimzia治疗组患者axSpA体征和症状显著改善,达ASAS20和ASAS40应答的患者比例分别为75.6%和58.5%,未发现新的安全性问题。详细数据将在ACR2020年会上展示。
6.诺华IL-1β单抗治疗新冠Ⅲ期临床中期结果失败。诺华抗炎药物Ilaris(canakinumab)治疗COVID-19和伴发细胞因子释放综合征(CRS)住院患者的Ⅲ期CAN-COVID研究中期结果没有达到主要终点。Ilaris联合标准护理(SoC)组在第29天时无机械通气生存率为88.8%,安慰剂+SoC组为85.7%(p=0.29);Ilaris+SoC组4周内COVID-19相关死亡率为4.9%,安慰剂+SoC组为7.2%(p=0.33);Ilaris+SoC与安慰剂+SoC的安全性具有可比性,没有发现Ilaris新的安全信号。该试验将继续进行至第127天,完整结果预计2021年初公布。
医药热点
1.全球累计新冠确诊病例超5000万。据美国约翰斯·霍普金斯大学统计数据显示,截至北京时间11月9日6时24分,全球新冠肺炎累计确诊病例已超5000万,达50282709例,累计死亡病例超125万,达1254453例。据统计,全球累计确诊病例从1000万例升至2000万例耗时43天;从2000万例升至3000万例耗时38天;从3000万例升至4000万例耗时32天;从4000万例升至5000万例耗时仅20天。确诊数排在前三位的国家仍为美国、印度和巴西。
2.7125人!深圳史上最大规模招医。深圳启动史上最大规模招医。参与此次招聘单位共有70家,提供招聘岗位1908个,共招聘7125人,较去年5873人,岗位数量大幅增加,创深圳历年医疗岗位招聘数量之最。在今年的招聘中,市属医疗机构20家,招聘3362人;区属医疗卫生机构34家,招聘3404人;社会办医疗机构7家,招聘359人。其中招聘人数最多的单位是深圳市第三人民医院,达629人。招聘时间从10月31日开始,至12月12日结束。
3.连云港基层全科医生最高每年补助3万。江苏省连云港市政府印发《全面加强全科医生队伍建设实施方案》提出,统筹调剂县域内卫生事业编制,基层机构原则上有编即补,主要用于引进全科医生;对基层机构全科医生给予财政专项补助,高级职称3万/年/人,中级职称2.5万/年/人,初级职称2万/年/人;对各区达标的乡镇卫生院和社区卫生服务中心,以及农村区域性医疗卫生中心和社区医院每个奖补30万元,对示范(甲级)村卫生室和社区卫生服务站每个奖补8万元,对星级家庭医生工作室每个奖补3万元。
股市资讯
【乐普医疗】(1)公司自主研发的三款药物支架——血管内药物(雷帕霉素)洗脱支架系统(商品名: Partner)、钴基合金雷帕霉素洗脱支架系统(商品名:GuReater)、血管内无载体含药(雷帕霉素)洗脱支架系统(商品名: Nano+)近日获得欧盟CE证书。(2)旗下子公司北京乐普诊断科技股份有限公司自主研发的抗原检测试剂盒入围出口 “白名单”。
【新产业】公司四个产品髓过氧化物酶测定试剂盒(化学发光免疫分析法)、抗SS-A/Ro抗体IgG测定试剂盒(化学发光免疫分析法)、抗SS-B抗体IgG测定试剂盒(化学发光免疫分析法)、抗Jo-1抗体IgG测定试剂盒(化学发光免疫分析法)获得广东省药品监督管理局颁发的4项《医疗器械注册证》。
【恒瑞医药】(1)公司收到国家药品监督管理局核准签发的关于SHR3680片的《药物临床试验批准通知书》。SHR3680是一种AR受体拮抗剂,拟用于去势治疗失败或者采用传统的激素治疗方法失败的前列腺癌的治疗。(2)收到国家药品监督管理局核准签发的关于海曲泊帕乙醇胺片的《药物临床试验批准通知书》,并将于近期开展临床试验。
审评动向
1. CDE最新受理情况(11月09日)
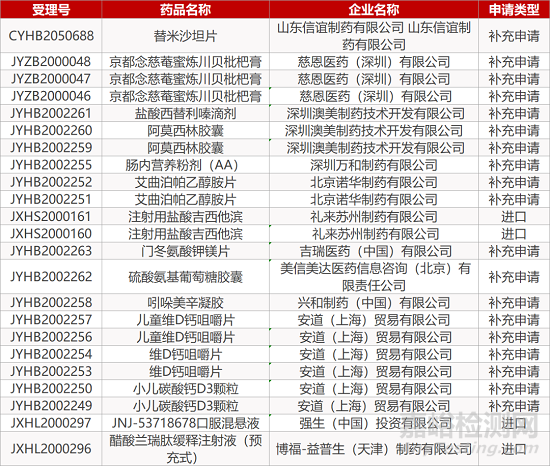
暂无
- The End -

来源:药研发


