您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-30 13:38
01 清洁验证目的
确立可靠的清洁方法和程序,以防止药品在生产过程中受到污染和交叉污染。
02 需从设备上清除物质
活性成分及其降解产物、辅料、清洁剂、微生物、润滑剂、设备运行过程中产生的微粒等。
03 总体流程
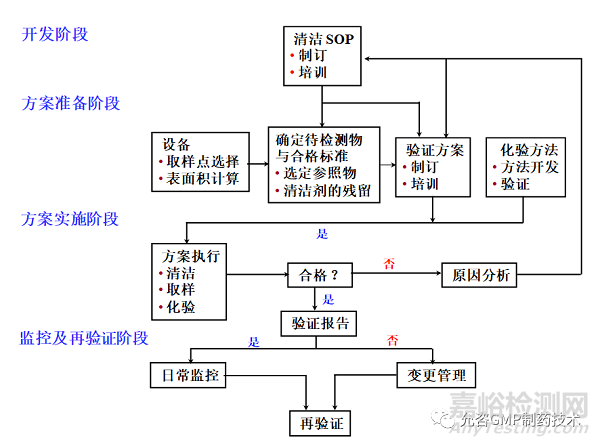
04 基本要求
4.1与产品直接接触的设备,其清洁程序应当经过验证,且至少需要连续进行3个成功批次,以证明清洁程序的有效性和重现性。清洁验证应该综合考虑设备使用情况、使用的清洁剂、取样方法和取样位置、残留物的性质和限度、残留物检验方法的灵敏度等因素。
4.2清洁验证应该在最差工艺条件下完成,如生产后最长的时间间隔、最短的冲洗时间、最少的清洁剂量、最少的清洗次数或最多的连续生产批次等。
4.3对于专用设备,不存在上一产品的活性成分转移至其他产品中的风险,如果产品稳定不易降解一般清洁到目视无可见残留物即可。但考虑到其他残留如降解产物、清洁剂、消毒剂、微生物及内毒素残留等会转移到相同产品的下一批次中造成污染,根据降解产物、清洁剂、消毒剂等物质对人体的影响程度进行评估,确认是否还需要对这些残留进行清洁验证。
4.4对于非专用设备(用于多产品生产),如果产品清洁程序不同,则需按不同的清洁程序分别进行验证;如果产品的清洁程序相同,可以根据评估选取“最难清洁品种”进行验证。残留限值应当考虑生产的所有产品,一般建议选择后续所有产品允许残留限度的最小值作为清洁验证可接受残留标准。如果该最小值太低,有的产品不适用,该限值对应产品则不适宜与其他产品共用该设备,建议使用专用设备生产或者限定后续产品的生产顺序。
4.5 当设备分可拆卸部件、不可拆卸部件和附属设备分别进行清洁时,由于其情节方法不一致,需要根据评估对清洁程序进行验证。
4.6清洁验证中取样要有代表性,需根据设备的结构尺寸、功能、清洁程序等因素确定取样点。
取样点应当经过评估,评估包括最难清洁位置、关键部件、最有代表性部位、结构材料的不同部位等,并且对于产物可能转移到的与产品非直接接触部件如密封、搅拌轴、法兰等应综合考虑。
清洁验证取样点应根据评估出的各部件清洁风险、相应部件面积或形状,确定各部件的取样点数量;
清洁监测可根据清洁验证的结果评估,选择较难清洁的位置进行取样监测。
取样示意图应该和实际取样位置相同,可采用绘制、实物照等形式。如果采用实物照形式,照片应彩色打印,标示出取样点的位置,当照片不能清晰显示具体取样位置时,可采用设备整体加局部放大示意图的形式标示出取样点位置。
4.7 在评估活性成分残留限度时,最终成品生产设备应考虑活性残留的累积,需要考虑所有共用设备面积。
4.8 在设定活性成分残留限度时应该进行回收率试验。
05 如何对清洁验证品种/最难清洁物质进行选择
当存在2个以上不同品种或同一品种存在多个组分并且使用同一清洁程序时,可根据各产品或各组分在清洁剂中的溶解性、清洁难易程度来评估最难清洁品种作验证;当有充分数据的时候,可结合药理毒性/活性数据来选择清洁验证参照物;没有充分数据的时候,可对每个品种单独验证。
06 评估最难清洗部位
凡是死角、清洁剂不易接触的部位如带有密封垫圈的管道连接处、压力、流速迅速变化的部位如有岔管处、管径由小变大、容易吸附残留物的部位如内表面不光滑处等,均应进行评估。当设备分可拆卸部件、不可拆卸部件和附属设备分别进行清洁时,应在不可拆卸部件中选取最难清洁部位进行评估。
07 清洁验证项目
活性残留:
针对评估出的目标残留物按相应的分析方法进行检验,可采用擦拭取样及浸泡液或最终淋洗水检测。
清洁剂残留:
对于需要考虑清洁剂残留的设备,一般通过最终淋洗水检测清洁剂残留。
生物负载残留:
对于有微生物限度控制的设备,可以通过最终淋洗水检测微生物残留,也可以通过擦拭法或者接触碟法检测微生物残留;对于有细菌内毒素限度控制的设备,一般通过最终淋洗水检测微生物残留。
08 如何计算可接受限度
8.1活性残留
允许残留总量通常基于活性成分剂量、残留毒性或默认限度建立。
8.1.1基于活性成分剂量的允许残留总量
对于活性成分,一般定为已清洁产品活性成分最小日剂量占下一产品最大日剂量的千分之一。对于非专用设备生产的非高毒性活性成分,该方法是可接受日暴露量法之外的另一选择。
|
MACO |
允许最大残留量,从上一产品带入下一产品的最大可接受残留量 |
|
LDD |
同一设备中生产的下一批活性成分的最大日剂量 |
|
MDD |
待清洁产品活性成分的最小日剂量 |
|
MBS |
下一批产品的最小批量 |
|
SF |
安全系数,通常为1000 |
8.1.2基于残留毒性的允许残留总量
通常有三种基于残留毒性的计算方法。一种方法是可接受日暴露量法 (ADE),适用于活性成分、中间体残留和降解物;一种方法是采用LD50值(半数致死量)作为残留的限度;一种方法是采用PDE值作为残留的限度。
基于ADE确定允许残留总量
通过评估毒性反应来建立无可见损害作用水平(NOAEL) (通常通过动物试验或人体数据获得)。ADE由有资质的毒理学家按照体重和不同调整因子估算。
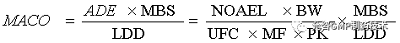
基于半数致死剂量确定允许残留总量
适用于具有短期毒性研究(如半数致死量)数据的残留。
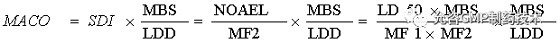
基于PDE确定允许残留总量
适用于具有毒性研究数据的残留。
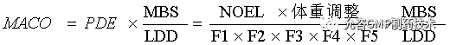
|
ADE |
残留的可接受日暴露量(Acceptable Daily Exposure) |
|
PDE |
允许的日接触量(Permitted Daily Exposure) |
|
NOAEL |
无可见损害作用水平(No Observed Adverse Effect Level) |
|
NOEL |
无可见作用水平(No Observed Effect Level) |
|
LOEL |
能观察到反应的最低量(Lowest Observed Effect Level) |
|
LOAEL |
能观察到损害作用的最低量(Lowest Observed Adverse Effect Level) |
|
BW |
服用下一产品患者体重,一般成年人的体重为70kg |
|
PK |
与给药途径相关的药代动力学因子 |
|
UFC |
综合不确定度,由种间差异、种内差异、亚慢性到慢性的推断、最低可见损害作用水平到无可见损害作用水平的推断和数据库完整性等因素确定 |
|
MF |
基于毒理学家判断的因子PK与给药途径相关的药代动力学因子 |
|
LD50 |
目标残留物在动物中的半数致死剂量,通常以mg/kg体重表示( 采用适当给药途径) |
|
MF1 |
修正因子,由毒理学家确定累积修正因子一般不超过1000 |
|
MF2 |
修正因子,由毒理学家确定,累积修正因子-般不超过1000 |
|
SDI |
残留每日安全摄入量 |
|
F1 |
物种差异系数(F1=5,从大鼠剂量推断人用剂量的系数;F1-12,从小鼠剂量推断人用剂量的系数;2,从狗剂量推断人用剂量的系数;F1=2.5,从免剂量推断人用剂量的系数;F1=3,从猴剂量推断人用剂量的系数;F1=10,从其他动物剂量推断人用剂量的系数;) |
|
F2 |
个体系数(F2=10) |
|
F3 |
短期接触急性毒性研究的可变系数(F3=1, 研究时间至少为动物寿命一半,鼠、兔1年,猫、狗、猴7年;F3=1器官形成的整个过程的生殖研究;F3=2 对啮齿动物6个月或者非啮齿动物3.5年的研究;F3=5啮齿动物3个月或者非啮齿动物2年的研究;F3=10更短的研究时间) |
|
F4 |
用于产生严重毒性情况的系数(F4=1有母体毒性有关的胎儿毒性; F4=5无母体毒性的胎儿毒性;F4=5 受母体毒性影响的致畸反应;F4=10无母体毒性影响的致畸反应) |
|
F5 |
一个可变系数,当使用LOAEL或LOEL时,F5=10; 当使用NOAEL或NOEL时,F5=1 |
8.1.3默认残留总量
当无法获得活性成分的医学或药理效力、残留毒性的相关数据时或上述计算的数据较大时,则适合使用默认残留浓度制定默认残留总量。默认残留浓度是设定上一批产品带入到下一批产品中的污染物质的最大浓度上限。根据公司所生产产品的属性不同(例如,毒性、药物活性等),从上一产品带入下一产品中的污染物质。最大浓度通用上限通常设定为5-500ppm(原料药中100ppm是很常见的)10PPm多用于液体制剂设备的清洁。
即:MACO=默认残留总量×MBS
对于成品,应按照活性成分的医学或药理效力或残留毒性的相关数据计算残留总量,然后与默认残留限度进行比较,选择最小值作为该产品的允许残留;
8.1.4单位面积限度
用MACO除以设备表面积(SSA)计算出单位共用面积限度(SAL),单位μg/cm2
产品接触面积测定的准确度应具有实际意义,不需要绝对的精确。可将复杂设备转化成基本几何图形以便计算和测量。
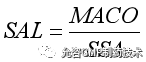
8.1.5一旦确定了SAL,擦拭或冲洗样中残留限度即可计算得出。
擦拭样提取液中残留浓度限度,该限度通常表示为μg/mL。将SAL乘以取样表面积,再除以所用提取溶剂量(SEA)即得。
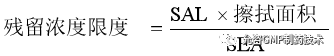
淋洗样中残留浓度限度度,对于淋洗样,限度多表示为固定冲洗液中残留的浓度。将SAL乘以淋洗取样面积,再除以所用冲洗液量。
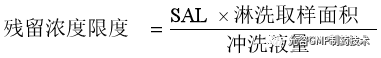
如果整个设备组使用一种冲洗液冲洗的,则SSA(共用表面积)和冲洗法取样面积是等同的。那么冲洗样中残留浓度限度简化(无需计算SSA)为:
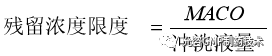
8.2清洁剂残留限度见ICH残留溶剂指南规定。
8.3生物负载残留
通过检测最终淋洗水检测微生物和细菌内毒素残留,残留限度参照工艺用水(纯化水/注射用水)的限度标准;通过擦拭法或者接触碟法检测微生物残留,残留限度参照设备所在区域洁净级别下的表面微生物的合格标准。
09 如何进行取样
取样方法的选择取决于设备、待检测残留物的性质、残留物限度以及所需的分析方法。包括目视检查、擦拭取样、淋洗取样。也可采取其他可供选择的方法,如接触碟取样。
取样方法的选择:不同的取样方法可以单独使用,也可以组合使用。对于设备难清洁位置优先选择擦拭法进行活性残留取样。对于细菌内毒素项目优先选择淋洗法取样。
9.1目视检查:
使用手电筒照射被清洗设备内表面,直接目视检查;如有不易观察的位置,则使用白布在清洁后的表面进行擦拭,然后进行目视检测,是否有可见残留物。
9.2擦拭取样:
常用的擦拭工具为药签,在一定长度的尼龙或塑料棒的一端缠有不掉纤维的织物。药签应耐一般有机溶剂的溶解。棉签容易脱落纤维,故在使用前用溶剂预先清洗,以避免纤维遗留在取样表面。溶剂用于擦拭时溶解残留物并将吸附在擦拭工具上的残留物萃取出来以便检验。用于擦拭和萃取的溶剂可以相同也可以不同。一般为水、有机溶剂或两者的混合物,也可含有表面活性剂等以帮助残留物质溶解。溶剂不得在设备上遗留有毒物质;应使擦拭取样有较高的回收率;对检测无干扰。
擦拭方法:
在取样点上选取5cm×5cm(或10cm×10cm)的区域进行水平擦拭取样,用适宜的溶剂湿润药签,并将其靠在溶剂瓶上以除去多余的溶剂。将药签头按在取样表面上,用力使其弯曲,平稳而缓慢地擦拭取样表面。在向前移动的同时将其从一边移动到另一边。擦拭过程应覆盖整个表面。翻转药签,让药签的另一面也进行擦拭。但与前次擦拭移动方向垂直,见如下附图。
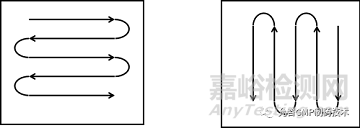
擦拭表面需使用3根擦拭棒,擦拭完成后,将药签放回试管,加入10mL稀释液手动摇晃提取,即为擦拭样品溶液。擦拭取样时应注意与擦拭回收率试验的四个一致性,即擦拭签湿润程度一致、擦拭动作一致、用力一致、擦拭面积一致。
9.3淋洗取样:
选择淋洗取样应有充分的理由,如:无法采用其他取样方法(设备表面不易接近);残留物易挥发不适合进行擦拭取样;淋洗取样能够充分检测到表面的残留物等。
根据淋洗水流经设备的路线,选择淋洗线路相对最下游的一个排水口。淋洗取样一种方法是在最终淋洗过程中“抓取”淋洗溶液的最后一部分作为样品;另一个方法是在淋洗结束后,向设备中加入一定体积的溶剂用来提取设备表面的残留。
10 取样回收率研究
10.1设备活性残留取样方法包括淋洗法和擦拭法,应当对不同的取样方法进行回收率研究。取样回收率研究应当在设备首次清洁验证前完成,以证明用于设备清洁验证的取样方法是有效性。取样回收率研究是将一定量的残留物均匀涂布在材质试样上,然后使用与清洗验证取样相同或相似的方法进行取样检测,检测值与涂布值的百分比即“取样回收率”。在材质试样上涂布的残留物量,应与设备表面活性残留限值一致。由于极低的涂布量可能导致更低的回收率,因此当设备因共用等因素导致设备表面活性残留限值变小时,应当在新的活性残留限值下再次进行回收率研究。应当对不同的设备材质分别进行取样回收率研究。取样回收率的大小与设备材质有关,如设备表面的光滑度,对残留的吸附能力等均会影响回收率的大小。可以选取有代表性的材质代替其他材质进行取样回收率研究,用来作为代表的材质的取样回收率应当是最差的。
10.2取样回收率标准材质板一般选择25cm2 (5cmx5cm),如果2Scm2面积 上残留量太小,低于检测限时,可以增加擦拭面积( 如100cm2)或者减少萃取溶液体积等方式增加检测浓度。取样回收率应不低于50%,回收率RSD不大于20%。应当至少进行三次重复试验,以保证取样回收率研究结果具有重现性,最终的取样回收率应选择三次试验结果中的最小值。应将取样回收率值带入公式计算清洁后的设备表面活性残留值,判断活性残留是否在允许限度范围内,评估清洁程序是否有效。计算公式如下:
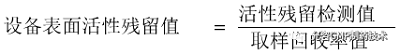
擦拭取样回收率研究使用与清洗验证取样相同的工具,相同的方法及相同的面积。淋洗取样回收率研究采用模拟淋洗的方式进行,模拟淋洗的条件应同实际设备淋洗条件相同或更差。目前有三种方法:
①在干净的收集容器上方悬挂一个已涂布的材质试样,将淋洗液从表面冲过,并收集在容器中;
②在合适材料的烧杯底部涂布残留物,晾干后向烧杯中加入淋洗液并轻轻搅拌,搅拌时间同最终淋洗相同;
③当没有合适材质烧杯时,在烧杯底部放置一个材质试样然后同上一种方法一样模拟淋洗。
11 采用分析方法
清洁验证时采用的检测方法应该有足够的灵敏度,特别是确认方法的检测限、定量限与活性物质允许残留限度是否匹配,且要与擦拭回收率验证时采用的检测方法保持一致。
活性残留检测分析方法的选择取决于残留物的性质,一般包括专属性和非专属性分析方法。
①专属性分析方法是指在有预期干扰物存在的情况下仍可以检测特定残留物的方法。包括色谱法(如HPLC、UPLC、 TLC) 和光谱法(如紫外、可见和红外),一般需要有适宜的对照品;一般优先选择使用专属性分析方法,专属性方法只适用于在清洁过程中活性成分未发生降解,或者使用的方法对降解产物也具有专属性;专属性分析方法应按照ICHQ2“含量”进行全面的验证,包括准确性、精密度、专属性、线性和范围,以及定量限(LOQ) /检测限(LOD)。
②非专属性分析方法
非专属分析方法检测的是一种大致的性质,如电导率和TOC等。当没有专属性分析方法,且非专属性分析方法的检测值也能反映残留情况时,可以选择非专属性分析方法,如对于治疗用大分子、多肽或者残留物暴露于pH极值和/或极温时会发生降解、变性时,使用专属性分析方法检测活性残留可能不现实,此时可以采用非专属性分析方法。
当用TOC方法检测活性残留时,需要按照如下公式将活性残留标准折算成TOC标准:
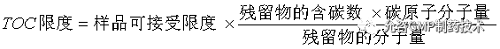
电导率检测是一个比较灵敏的方法,用于检测淋洗水样中的离子。一般用于检测清洁剂的残留和控制自动清洗工艺,比如CIP。与TOC检测相比,电导率一般仅用于水样测试,电导率通常不适用于检测产品的残留。
12 异常情况处理
当所有检测项目均符合规定时才能确定设备的清洁操作规程是可用的,清洁效果符合规定。当检验结果出现不合格情况时,按照偏差管理规程进行处理,进行调查后,根据调查结果重新修订清洁规程,修订后重新进行验证,直至合格。

来源:允咨GMP制药技术


