您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-10-08 10:52
医疗器械研究者手册新旧版本对比图示
一、规范要求
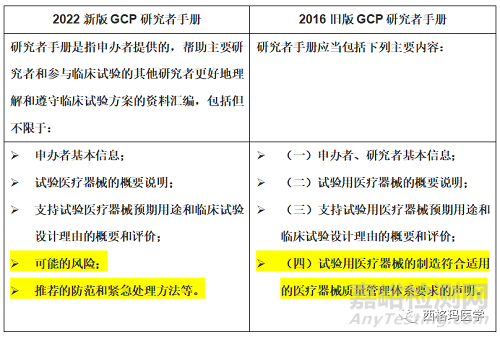
新版《医疗器械临床试验质量管理规范》于2022年5月1日正式实施,其中第九章 附则 第六十四条 本规范下列用语的含义:研究者手册,是指申办者提供的,帮助主要研究者和参与临床试验的其他研究者更好地理解和遵守临床试验方案的资料汇编,包括但不限于:申办者基本信息、试验医疗器械的概要说明、支持试验医疗器械预期用途和临床试验设计理由的概要和评价、可能的风险、推荐的防范和紧急处理方法等。
旧版《医疗器械临床试验质量管理规范》于2016年6月1日正式实施,其中第四十一条 研究者手册应当包括下列主要内容:
(一)申办者、研究者基本信息;
(二)试验用医疗器械的概要说明;
(三)支持试验用医疗器械预期用途和临床试验设计理由的概要和评价;
(四)试验用医疗器械的制造符合适用的医疗器械质量管理体系要求的声明。
二、对比图示

来源:西格玛医学


