今日头条
国产首个带状疱疹疫苗获批签发。4月11日,长春百克生物开发的带状疱疹减毒活疫苗获得国家药监局生物制品批签发证明。该产品是首个国产带状疱疹疫苗产品,也是全球首个适用于40岁以上人群的带状疱疹减毒活疫苗,免疫程序为1针。我国带状疱疹发病率目前是12.6/1000人年,每年带状疱疹的发病人数为266万,而且呈现出年轻化趋势。
国内药讯
1.君实PD-1单抗肺癌新适应症报产。君实生物PD-1抑制剂特瑞普利单抗的新适应症上市申请获国家药监局受理,联合化疗用于可切除III期非小细胞肺癌(NSCLC)的围手术期治疗和单药用于辅助治疗后巩固治疗。在III期临床(Neotorch)中,与单纯化疗相比,特瑞普利单抗联合化疗用于III期可手术NSCLC患者围手术期治疗并在后续进行特瑞普利单抗单药巩固治疗可显著延长患者的无事件生存期。这是特瑞普利单抗在中国递交的第七项上市申请。
2.复星长效肽制剂神经调节剂报产。复星医药与Revance公司合作开发的注射用A型肉毒毒素(RT002,DaxibotulinumtoxinA-lanm)上市申请获国家药监局受理,申报的适应症推测为中重度眉间纹患者的治疗。RT002是首款也是唯一一款长效肽制剂神经调节剂,不含人血清白蛋白和动物成分,除皱效果的中位持续时间为6个月,最长可达9个月。复星医药拥有该产品在中国大陆、香港、澳门地区的独家授权。
3.罗氏FIC眼科双抗新适应症在华报产。罗氏制药2.2类生物制品法瑞西单抗注射液(faricimab)的上市申请获国家药监局受理,推测此次申报的适应症为视网膜静脉阻塞继发黄斑水肿。Faricimab(Vabysmo)是首个针对眼科疾病开发的VEGF-A/ANG-2双抗,已于去年1月获FDA批准上市,用于治疗湿性年龄相关黄斑变性(nAMD)和糖尿病黄斑水肿(DME)。2022年8月,罗氏也在中国提交该产品用于治疗DME和wAMD的上市申请。
4.苏州天辰C5/C3补体抑制剂报IND。天辰生物1类创新药LP-005临床试验申请(IND)获CDE受理。这是一款可同时抑制补体C5与C3的双功能融合蛋白,通过与C5特异性结合,阻止其裂解为C5a和C5b,从而不能形成膜攻击复合物,减少血栓并发症发生风险,防止突破性溶血事件的发生,并通过抑制C3来避免血管外溶血的发生。该产品拟用于多种补体相关罕见病和常见病的治疗。
5.苏州鑫康合B7-H4抗体报IND。鑫康合生物1类生物制品XKH002注射液的临床试验申请获CDE受理。XKH002是一款IgG4亚型的B7S1(又名B7-H4)抗体,可以有效阻断B7S1介导的对T细胞增殖和免疫反应的抑制作用。目前针对B7-H4的在研疗法多为抗体和ADC药物,且均是针对肿瘤的治疗,其中乳腺癌和卵巢癌居多。在即将到来的AACR年会上,阿斯利康将首次公开其B7H4 ADC的药物进展。
6.至善唯新A型血友病基因疗法报IND。四川至善唯新1类生物制品“ZS802注射液”临床试验申请获CDE受理。ZS802是一款拟开发用于A型血友病治疗的rAAV基因药物,也是至善唯新第二款进入临床的rAAV基因药物。与Biomarin公司同类产品valoctocogene roxaparvovec相比,ZS802采用自主研发的全球最小的肝脏特异启动子,解决了病毒载体包装难题,显著提高药物质量。
7.安可康双矛溶瘤病毒报IND。四川安可康生物1类生物制品“注射用重组WNV-HCD86”新适应症临床试验申请获CDE受理。这是该公司的第一个双矛1型H2-1溶瘤病毒产品DS1-H2-1,由西尼罗河病毒(WNV)和人T细胞共刺激基因组成。自2023年2月至今,安可康已提交该产品三个适应症的临床试验申请。该产品拟开发用于治疗复发和难治性神经母细胞瘤、胶质母细胞瘤和结肠癌。
国际药讯
1.莫德纳RSV疫苗将在美国报产。Moderna公司日前透露,预计将在本季度递交其编码RSV融合前F糖蛋白的mRNA疫苗mRNA-1345的上市申请,用以预防60岁以上成人罹患呼吸道合胞病毒相关下呼吸道疾病(RSV-LRTD)。在Ⅲ期临床ConquerRSV中,mRNA-1345治疗组较安慰剂组出现两种或两种以上RSV-LRTD症状的病例数目更少,疫苗预防效力达到83.7%。此前,FDA已授予mRNA-1345突破性疗法认定和快速通道资格。
2.CD38抗体两项肾病Ⅱ期临床积极。Hi-Bio公司CD38抗体felzartamab在治疗aPLA2R阳性、原发性膜性肾病(PMN)的Ⅰb/Ⅱa期概念验证M-PLACE研究以及Ⅱ期NewPLACE研究中均获得积极结果。M-PLACE研究显示,大多数患者在治疗后六个月时其aPLA2R抗体水平减少>50%,疗效持续长达12个月。与NewPLACE中的两剂和五剂治疗方案相比,在M-PLACE中的九剂治疗方案观察到aPLA2R抗体水平呈现最持久的降低。felzartamab在两项试验中总体耐受性良好。
3.同种异体γδT细胞疗法最新临床数据积极。IN8bio公司同种异体γδ T细胞疗法INB-100用于治疗接受造血干细胞移植(HSCT)的急性白血病患者的最新临床积极结果将在4月23日EBMT年会上发表。数据截止到2022年12月18日,1x 106剂量组的4例患者在骨髓移植(BMT)后32.2、29.8、18.1和3.8个月均处于完全缓解(CR);临床中,没有剂量限制性毒性(DLTs)、治疗相关的≥Gr3不良事件、神经毒性或细胞因子释放综合征的报告。
4.抗凝血GalNAc-siRNA药物上I期临床。Sirnaomics公司宣布启动其首款GalNAc-siRNA治疗药物STP122G的I期临床试验。STP122G旨在通过靶向肝细胞产生的酶(十一因子),用以治疗抗凝血,如心房颤动、肺栓塞、深层静脉血栓(DVT)及预防因手术而导致的深层静脉血栓。该项试验将在健康受试者中开展,评估皮下注射给药的安全性、耐受性和药代动力学特征。
5.Discovery公司收购ReachBio研究实验室。Discovery公司宣布增加对创新临床前开发服务的战略投资,收购总部位于西雅图的ReachBio研究实验室。ReachBio成立于2007年,是一家专门从事基于细胞的检测、预测性血液毒性和药物筛选服务的公司。此次收购将扩大Discovery的综合药物发现和临床前开发产品的规模,将加速Discovery在其细胞生物学和毒理学服务的持续增长。
6.美国超50亿美元开发下一代新冠疫苗。4月10日,白宫宣布终止与新冠疫情有关的国家紧急状态,并同时启动一项下一代项目(Project NextGen),拟投资至少50亿美元用于开发下一代新冠疫苗。NextGen项目有三个主要目标:1.开发一种有望预防感染和重症的鼻腔疫苗;2.开发更持久的疫苗;3.创造“提供更广泛保护”的疫苗,预防所有变体和多种不同的冠状病毒。
医药热点
1.国家发布新冠疫苗接种新任务。4月10日, 国务院联防联机制发布 《应对近期新冠病毒感染疫情疫苗接种工作方案》。《方案》提到,符合条件人群可在感染3个月后接种新冠疫苗。在此前疫情中,未感染且尚未完成既定免疫程序的人群,未来仍存在感染并发展成重症的风险;已感染且未完成基础免疫的人群,由于疫苗或病毒诱导的抗原刺激不足,免疫保护效果也明显弱于完成基础免疫后再感染获得的混合免疫。《方案》强调,现阶段我国疫苗接种的重点是针对不同目标人群补齐免疫水平差距,进一步降低重症和死亡风险。
2.天津市第一中心医院水西院区正式启用。近日,天津市第一中心医院新址扩建项目(水西院区)建设工程完成并投入使用。水西院区坐落于天津市西青区侯台风景区东南侧,东侧临春明路,西侧临文正路,南侧临保山西道,北侧临保泽西道。总建筑面积41万平方米,设计床位2000张,日门诊量7000人次,日急诊量1200人次,落实了优质医疗资源扩容目标并一定程度上缓解群众对优质医疗资源需求的矛盾。
3.清华大学成立器官移植与仿生医学研究院。4月8日,清华大学揭牌成立“器官移植与仿生医学研究院”(简称“移植仿生院”),由著名肝胆外科和肝脏移植专家董家鸿院士担任院长,将推动器官移植临床医学与清华优势学科深度交叉融合,建设临床驱动型与超学科融合式卓越器官移植中心。
评审动态
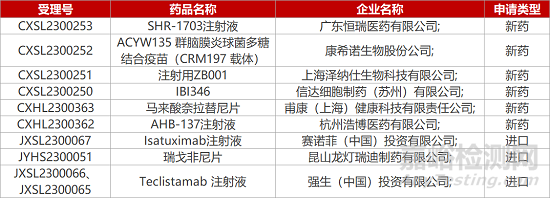
1. CDE新药受理情况(04月12日)
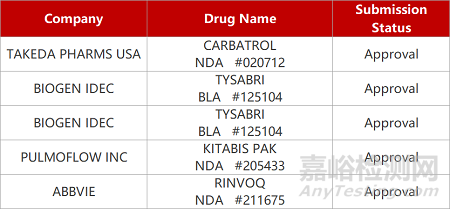
2. FDA新药获批情况(北美04月11日)