YY0778-2018《射频消融导管》于2020 年6 月1 日起正式实施,新版标准替代了旧版YY0778-2010标准。文章聚焦于标准变化内容,详细解读了新旧标准在标准章节、性能要求层级、条款内容等方面的差异。
射频消融导管是一种配合高频手术附件使用的特殊耗材,其能够通过血管、腔道把射频能量传递到目标组织,对目标组织实施切割或消融。常见的射频消融导管有心脏射频消融导管、静脉闭合射频消融导管、支气管射频消融导管等。根据现行医疗器械分类目录的规定,射频消融导管属于“01 有源手术器械”中“03 高频/ 射频手术设备及附件”下的二级产品类别,管理类别为Ⅲ类。射频消融导管的现行行业标准为YY0778-2018《射频消融导管》,该标准于2018 年12 月20 日发布,2020 年6 月1 日起正式实施。新版的YY0778-2018标准替代了旧版YY0778-2010标准。相较于2010 版,YY0778-2018无论从标准结构还是条款内容上均有较大幅度的修订[1,2]。笔者作为YY0778-2018的第一起草人将对新旧版标准的内容变化进行分析解读,以便各标准使用方能够更加准确地理解新版标准,并顺利完成标准换版的过渡。
1.标准章节的删减
YY0778-2010 标准的正文部分共包括1 范围,2 规范性引用文件,3 术语和定义,4 要求,5 试验方法,6 检验规则,7 标志、标签、使用说明书,8 包装、运输和贮存,共8 个章节。考虑到6、7、8 章节并非规范性约束条款且部分内容与其他现行标准存在一定的矛盾,故YY0778-2018标准删除了这部分内容,仅保留前5 个章节。
2.性能要求层级的调整
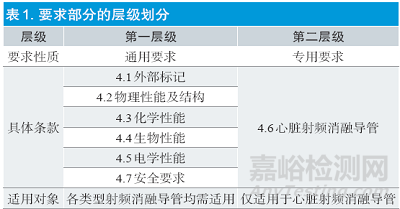
YY0778-2018的第4 章节“要求”部分是整个标准的核心章节,包括4.1~4.7共7项要求。相较2010版的最大变化是,在适用对象方面,7 项要求可以分成两个层级:第一层级为通用要求,第二层级为专用要求。如表1 所示,第一层级包括4.1 外部标记、4.2 物理性能及结构、4.3 化学性能、4.4 生物性能、4.5 电学性能以及4.7 安全要求共计6 项要求。这6项要求作为通用要求适用于各类型射频消融导管,而不仅适用于某一特定类别的导管。第二层级为4.6 心脏射频消融导管,该项要求适是心脏射频消融导管的专用要求,仅适用于心脏射频消融导管,其他类型的导管不需要执行此条款。
3.修改及删除的条款解析
YY0778-2018 相较2010 版在标准内容上进行了诸多修订,其中比较主要的修改及删除内容如下:
3.1 修改了断裂力条款
2010 版标准要求:
“4.2.2 断裂力
当按规定方法试验时,各试验段的断裂力应符合表1 的规定。”
2018 版标准要求:
“4.2.2 断裂力
当按规定方法试验时,各试验段的断裂力应符合YY0285.1-2017中表1 的规定。”
在YY0778-2010 中,断裂力限值主要由标准中表1 来规定。该表引用自当时现行有效的行业标准YY0285.1-2004《一次性使用无菌血管内导管 第1 部分:通用要求》,与YY0285.1-2004标准中的表1 保持一致。
在2018 版YY0778标准起草过程中,YY0285.1 标准发生了换版,YY0285.1-2004 标准由YY0285.1-2017 标准所替代,且断裂力相关内容发生了变化,因此在YY0778-2018中4.2.2 断裂力条款直接引用了YY0285.1-2017的内容,同时更新了相关试验方法,确保了与相关现行标准的一致性。
3.2 修改了生物相容性条款
2010 版标准要求:
“4.4.2 热原
导管应无热源
4.4.3 细胞毒性
细胞毒性反应≤1 级。
4.4.4 皮内反应
试验样品和溶剂对照平均记分之差≤1.0。
4.4.5 迟发型超敏反应
应无迟发型超敏反应。
4.4.6 血液相容性
与血路或血液接触的导管还应进行血液相容性评价,至少满足:
a)溶血 溶血率应<5%。
b)体内静脉血栓形成试验 血栓形成等级应≤2 级,供试样品与对照样品的血栓形成应基本一致。
c)部分凝血激活酶时间试验 应为非内源性凝血通路激活物或极轻微激活物。
4.4.7 急性全身毒性
与血路或血液接触的导管应无急性全身毒性。”
2018 版标准要求:
“4.4.2 生物相容性
预期与生物组织、细胞或体液接触的部分, 应按GB/T16886.1中给出的指南和原则进行评估和形成文件。”
在2010 版YY0778标准中,生物相容性要求包括:4.4.2热原、4.4.3 细胞毒性、4.4.4 皮内反应、4.4.5 迟发型超敏反应、4.4.6 血液相容性、4.4.7 急性全身毒性共5 项要求。该5项试验要求主要是基于心脏射频消融导管产品所制定的。根据GB/T16886.1的器械分类,心脏射频消融导管属于外部接入器械,且与循环血路接触,接触时间为短期接触,因此,依据GB/T16886.1附录A的规定心脏射频消融导管应进行前述5 项生物学评价试验。
近年来,随着新型射频消融导管的不断出现,例如:肾动脉射频消融导管、消化道射频消融导管等,各类型导管根据GB/T16886.1的器械分类不再集中和统一。对于其他种类的射频消融导管如果依旧沿用心脏射频消融导管的5项试验要求是不恰当的。因此,在YY0778-2018 中4.4.2 生物相容性条款并未给出具体试验项目,而是要求制造商根据自身产品的分类特点依照GB/T16886.1进行评估。相较旧版内容,2018 版这一修改将更加科学有效的评估导管的生物学性能。
3.3 调整了X 射线可探测性条款的位置
并非所有品种的射频消融导管在使用时都需要X 射线显影和定位,比如:支气管射频消融导管是利用肺纤维镜进行定位操作的,静脉闭合射频消融导管在使用中需要借助超声影像进行定位,故X 射线可探测性不应作为适用于各类型导管的通用要求出现。
而心脏射频消融导管则必须具备良好的可探测性,因为其在使用中需要借助X 射线进行导引和控弯才能保证介入手术的正常进行。所以在YY0778-2018中,将X 射线可探测性条款调整为心脏射频消融导管的专用要求,不再作为通用要求出现。
3.4 修改了安全要求条款
2010 版标准要求:
“4.6.1 基本安全
应符合GB 9706.1-2007的相关要求。
4.6.2 高频漏电流
应符合GB 9706.4-2009中59.103.5 的相关要求。
4.6.3 高频介电强度
应符合GB 9706.4-2009中59.103.6 的相关要求。
4.6.4 工频介电强度
应符合GB 9706.4-2009中59.103.7 的相关要求。
4.6.5 与内窥镜设备的绝缘配合
可与内窥镜一起使用的导管,应符合GB9706.19-2000中42.101 的相关要求。”
2018 版标准要求:
“4.7.1 应符合GB9706.1和GB9706.4-2009的要求。
4.7.2 属于内窥镜附件的导管,应符合GB9706.19-2000的要求。”
YY0778-2018 标准的4.7 安全要求条款全面引用了GB9706.1-2007、GB9706.4-2009的要求,对于属于内窥镜附件的导管则引用了GB9706.19-2000 的要求。修改了旧版标准中部分引用安全标准的问题,能够更充分地考核产品的安全性,为产品的安全使用提供更有力的技术支撑。
3.5 删除了使用说明书条款
在YY0778-2018 中删除了旧版标准中4.7 使用说明书要求。原有4.7内容与GB9706相关标准中说明书的要求存在一定的重复,并且相关要求表述过于简略容易引起歧义。
因此,在充分征询标准各使用方意见后,删除了使用说明书要求,从根本上消除了标准理解上可能存在的偏差和歧义。使用说明书执行GB9706相关标准的对应要求即可,这一修订也为制造商编写说明书提供了便利。
4.新增条款解析
在YY0778-2018中,除鲁尔接头条款属于通用要求外,其余新增内容均为心脏射频消融导管的专用要求,具体解析如下:
4.1 新增鲁尔接头条款
2018 版标准要求:
“4.2.5 鲁尔接头
导管上的鲁尔圆锥锁定接头应符合GB/T1962.2-2001的要求。”
许多射频消融导管都配备有鲁尔接头,鲁尔接头的主要作用是与外接的气体或液体管路连接,在驱动设备作用下传输液体或气体物质。例如盐水灌注心脏射频消融导管,其通过鲁尔接头连接外部生理盐水管路,在灌注泵驱动下盐水由导管头端流出,达到降低消融温度,增大消融部位体积的作用。
YY0778-2018 填补了2010 版的空白,增加了4.2.5 鲁尔接头要求及相应试验方法,规定了锁定接头应符合GB/T1962.2-2001 的相关要求。根据标准应进行尺寸、泄漏、分离力等试验,用以检测鲁尔接头是否符合要求。
4.2 新增高频导通性条款
2018 版标准要求:
“4.6.1 高频导通性
头端电极与手柄对应芯脚之间的导线在传输高频电流时应保持电气导通,试验后导线的直流电阻应符合4.5.1 的要求。”
心脏射频消融导管在实际使用中需要将射频仪(主机)产生的高频电流传输到心脏靶组织,对靶组织进行消融。通常在一次消融过程中,导管中的导线需要承载幅值约1A的电流数十秒钟,在此期间导线会因流经的电流而发热,产生比较明显的温度升高。受限于导管外径尺寸,传输高频电流的导线一般都比较纤细,如在导管装配过程中导线收到机械损伤,则在消融时损伤点可能会因无法长时间承载高频电流而发生熔断,导致手术失败。因此,YY0778-2018标准增加了4.6.1 高频导通性要求,目的是考核导管承载高频电流的能力,确保导管具备良好的传导能力。
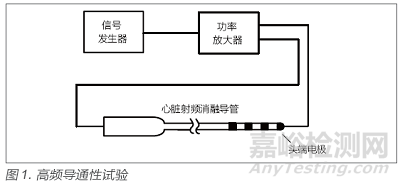
标准5.6.1 规定了高频导通性的试验方法。如图1 所示,在头端电极和手柄对应芯脚间通入400kHz±100kHz 的正弦试验电流,该正弦信号通常由信号发生器产生,信号发生器连接功率放大器,调节放大器增益使试验电流达到1A并保持1min。试验期间电流应不发生中断。1min后切断试验电流,等待导管冷却至室温后,使用万用表测量导管的直流电流以判定是否符合要求。
4.3 新增头电极牢固性条款
2018 版标准要求:
“4.6.2 头端电极牢固性
手柄相对头端电极转动540˚ 后,头电极不应脱落。”
心脏射频消融导管的管身通常采用高扭矩的编织管材制成,使用者在手柄端的旋转动作可通过管身传递到头电极,带动导管头端随之旋转。在一些特殊情况下,头电极会被钳位而不跟随管身转动,此时,旋转带来的扭矩就集中在了头电极与管身的连接处。如果头电极与管身连接不牢固的话,连接处发生断裂,头电极会脱落而滞留在患者体内,造成严重的医疗事故。
因此,YY0778-2018中新增了4.6.2 头端电极牢固性的要求及相应试验方法,通过操作手柄沿顺时针和逆时针两个方向旋转540˚,检查头电极与管身连接处的牢固程度,避免手术中头电极脱落的问题,保证了器械的使用安全。
4.4 新增灌注流速条款
2018 版标准要求:
“4.6.3 灌注流速
具有盐水灌注功能的导管和制造商指定的灌注设备连用时,导管头端出水孔应出水通畅。导管实际输出的盐水流速与灌注设备设定流速之间的误差应不大于±20%。”
根据标准4.6.3 灌注流速的要求,盐水灌注导管头端的出水孔应出水通畅且实际出水流速与设定值之间的误差应不大于±20%。该条款的制定初衷是保证导管的出水孔不发生堵塞,同时流速误差应控制在合理范围内。因为如果超出允差的流速,无论过大还是过小,都会对实际消融效果产生不利影响,存在安全隐患。
在根据标准5.6.3进行试验时,需要注意两个测试细节:①试验时应将导管远端调节至预期弯型以模拟正常使用场景,不应在导管初始自然伸直状态进行试验。②测量出水流速时,应先将导管内的空气排出且流速稳定后再进行测试,否则,可能导致实际出水流速偏低。
4.5 新增高频耦合电流条款
2018 版标准要求:
“4.6.5 高频耦合电流
4.6.5.1 预期不传输高频电流的电极经200Ω 无感电阻到中性电极不应产生150mA以上的高频电流。
4.6.5.2 预期不传输高频电流的电极之间跨接200Ω 无感电阻不应产生50mA以上的高频电流。
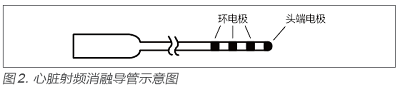
典型的心脏射频消融导管的头端通常含有4 个电极,如图2 所示,分别为1 个头端电极和3 个环电极。在实际使用中,除头端电极外,3 个环电极预期不传输消融用的高频电流。但由于导管中不同导体间固有寄生电容的作用,头端电极所传输的高频电流会通过寄生电容部分耦合到环电极上。如果耦合电流过大,则会对与环电极接触的非靶点正常组织进行消融,导致非预期消融的发生。因此,YY0778-2018中新增了高频耦合电流条款,目的是限制耦合电流的大小,保证手术时的安全性。
标准4.6.5.1规定的150mA限值引用自GB9706.4-2009中19.3.101a)条款,与单极应用时的高频漏电流限值保持一致。标准4.6.5.2 规定的50mA限值引用自GB9706.4-2009 中19.3.101c),与未启动双极横向耦合的50mA限值保持一致[3,4]。
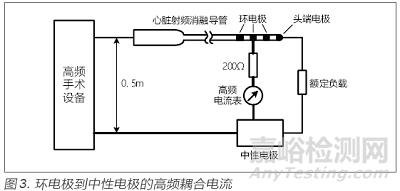
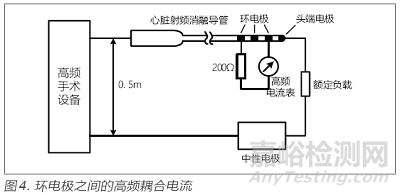
应根据标准5.6.5的试验方法进行测试,测试的布置如图3和图4所示,试验时应注意以下3点:①试验应按照GB9706-2009 的图105 进行排布,需要将被测导管及测试设备放置在下方铺设有接地导电平面的试验台上,试验台的高度为1m。②心脏射频消融导管及其尾线与中性电极及其连线的间距为50cm,实验室应严格按此距离进行,以便测试结果具备较好的复现性。③试验所用200Ω 电阻应选用无感或低感电阻,且电阻的额定功率应能承受150mA电流所产生的功率,推荐使用10W以上的无感电阻。
5.小结
本文从标准章节的删减、性能要求层级的调整、修改及删除的条款、新增条款四个方面介绍了YY0778-2018标准相较2010 版的变化,希望能给各标准使用及相关方带来帮助。