纳米抗体,1989年比利时科学家是从骆驼科家族中发现的仅含重链抗体HCAb的可变区(VHH)。由于其体积小,结构简单,抗原结合亲和力高,以及在极端条件下的高稳定性。因此,纳米体在各种研究领域,特别是在疾病的诊断和治疗方面引起了极大的兴趣。从2018年,世界上第一个基于纳米抗体的药物(卡普拉珠单抗)获得批准,到2022年世界第一款双特异性纳米抗体Ozoralizumab获批上市。此外,从国内维度来看,康宁杰瑞的KN-035产 (PD-L1靶点,单链抗体FC融合)以及传奇生物的首款纳米抗体CAR-T细胞分别于2021以及2022年获批上市,由此可见纳米抗体正逐渐在生物制药领域占有重要地位。
1、纳米抗体的独特结构特征
驼科动物仅含重链的抗体(HCAb)由一个片段结晶区(Fc),直接连接到一个由单结构域(VHH)组成的Fab片段。由于缺少轻链以及CH1区域纳米抗体的分子量比传统单克隆抗体减少了90 kDa。其中HCAb的VHH片段,大小约为2.5*4 nm, 分子量约为15 kDa,可以结合广泛抗原库,又称纳米抗体(Nbs)。与传统抗体的可变区(VH)类似,纳米抗体VHH(Nbs)由四个保守区域(FR)和三个负责决定抗原特异性的高变互补决定区(CDR)组成。与此同时纳米抗体VHH与单克隆抗体的VH区域也存在一系列的差别,首先由于缺乏轻链,纳米抗体通过三个CDR区域与抗原结合,而单克隆抗体通常需要六个CDR区域才能与抗原结合。从结构上看,尽管纳米抗体缺失了轻链,但是其CDR1区域的结构变异和CDR3区域长度的增加,极大促进了其抗原结合的多样性。此外,传统单抗VH结构域的FR2主要由的疏水氨基酸残基组成,即V37/G44/L45/W47,而纳米抗体的FR2通常由亲水性氨基酸残基组成,即F37/E44/R45/G47,这也就使得其能以可溶性单体的形式存在。
图1 单克隆抗体及仅含重链抗体以及纳米抗体示意
2、纳米抗体单克隆抗体相比的优势以劣势
与传统单克隆抗体相比,纳米抗体的独特结构具有多种优势。它们的小尺寸、凸形状和延伸的CDR3赋予了它们的伞形结构特征,可以结合抗原的凹部分,这些凹部分通常被认为是阻塞的,而分子量较大的单克隆抗体无法接近如。与此同时纳米抗体的微小尺寸并不妨碍结合亲和力,并且表现出与单克隆抗体相当的抗原结合力。此外,较小尺寸的纳米抗体,展现出较好的组织穿透性,纳米抗体-药物偶联物,可以穿透肿瘤,而传统抗体-药物偶联物无法穿透肿瘤。因此,纳米抗体展现出优异的药物递送能力。
除了由于体积较小而已经赋予它们的优势外,纳米抗体还具有一系列有利的生化特性。首先,纳米抗体在长时间暴露于高温下时表现出显著的稳定性,这部分是由于其延长的CDR3和变性后重新折叠的能力所造成的。其次,纳米抗体由于其含有亲水性FR2而具有高可溶性,从而防止聚集并允许其作为单体发挥功能,而且它们还能够在蛋白酶存在下保持稳定,并表现出对pH变化的抵抗力,因此纳米抗体展现出口服给药以及腹腔给药的潜力。此外多项研究表明,纳米抗体具有较低的免疫原性,成为药物开发的理想潜在候选物。此外,还可以通过将纳米抗体的骆驼特异性氨基酸序列突变为人类VH对应序列(即人源化)从而进一步降低发生副作用的风险。最后,传统的单克隆抗体结构复杂,需要繁琐的纯化步骤,而纳米抗体的生产和纯化相对更简单,可以通过添加组氨酸标签,使用固定金属亲和层析(IMAC)进行纯化。
虽然纳米抗体具有许多令人满意的特性,但仍有一定的局限性。由于肾小球滤过的阈值为50-60 kDa,其15 kDa的小尺寸导致血清持续时间低或肾脏清除迅速,因此在诊断筛查和治疗应用方面存在劣势。一种解决策略是将纳米抗体偶联到聚乙二醇(PEG)或白蛋白上。其次,纳米抗体缺乏Fc区,因此不能发挥与该部分相关的效应功能。然而,这个问题可以通过偶联到Fc区来增加治疗能力来解决。
3、纳米抗体开发和生产
3.1 纳米抗体发现
抗原特异性纳米抗体可以从三个不同的来源中选择,即免疫动物、天然来源和文库筛选。免疫文库通常由目标抗原对骆驼科动物(如羊驼或单峰骆驼)进行免疫,通常在两个月内至少四次。然后从提取的血液中纯化淋巴细胞,提取mRNA,然后进行cDNA逆转录。然后采用两步聚合酶链反应(PCR)方法,首先从所有IgG的先导序列扩增到CH2结构域内的保守区域,然后琼脂糖凝胶电泳选择来自HCAb的序列,最后通过引物靶向活性限制性内切酶位点扩增VHH序列。最后,将获得的扩增子连接到载体中,并转化为适当的表达系统,通常是大肠杆菌。一个典型的理想免疫库应该包含至少107个独特转化。
一旦获得纳米抗体库,最常用的方法是利用噬菌体展示技术进行筛选,用M13噬菌体感染纳米抗体文库细胞,产生含有纳米抗体DNA序列的噬菌体。此外,这些噬菌体将展示融合在其外壳蛋白上的纳米抗体,然后将其引入带有粘附目标抗原的微滴板。通过pH冲击洗脱阳性结合物。多轮筛选丢弃亲和性较弱的噬菌体,从而排除非特异性结合纳米抗体。接下来,噬菌体再次被转染到新的大肠杆菌细胞中,在培养基中培养,使用相应抗生素为选择标记。便于挑选出大量培养阳性结合物,此外它们可以通过酶联免疫吸附试验(ELISA)进行验证,然后进行测序以确定纳米抗体核苷酸序列。最后,为了确定亲和力最高的结合剂,采用表面等离子体共振(SPR),进行进一步的筛选。含有最终序列的大肠杆菌用甘油进行保菌。
图2 纳米抗体发现流程-噬菌体展示技术
3.2 纳米抗体表达与纯化
纳米抗体的标准生产通常采用大肠杆菌表达系统,用表达纳米抗体的大肠杆菌细胞的甘油原液接种到(LB)培养基,孵育过夜,然后依次接种到 (TB)培养基。在达到足够的生长(OD:0.6-0.8)后,通过添加1Mm IPTG进行诱导纳米抗体表达,然后进一步过夜孵育。然后通过离心收集细胞(微球),通过裂解大肠杆菌获得纳米抗体上清液,纳米抗体的纯化通常使用IMAC靶向与纳米抗体初级序列相连的组氨酸标签,最后通过添加(0.5 M)咪唑溶液洗脱纳米抗体。
图3 纳米抗体表达与纯化
4、临床研究进展
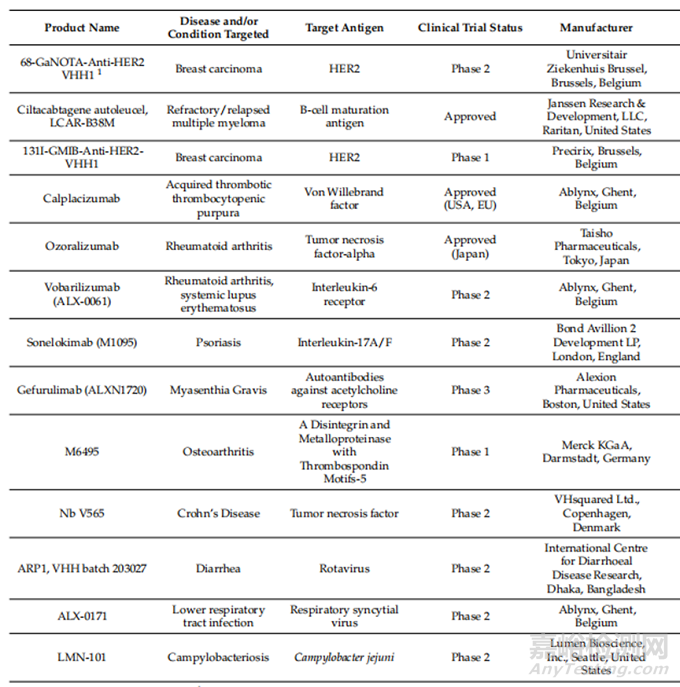
如表1所示,目前已有三种治疗性纳米抗体获批,多种纳米抗体处于临床实验阶段。
4.1 纳米抗体用于癌症治疗
纳米抗体优异的肿瘤穿透能力、识别独特抗原的能力等优势使其成为癌症治疗领域的一个有极大潜力的候选者。纳米抗体癌症治疗的一个途径是开发CAR-T细胞,表达肿瘤抗原特异性的纳米抗体。从患者体内提取T细胞并对其进行基因修饰,使其表达肿瘤抗原特异性纳米抗体,然后再注入患者体内,从而使T细胞通过释放细胞毒性分子、通过肿瘤坏死因子受体识别诱导细胞凋亡、分泌炎性细胞因子等机制结合并中和肿瘤细胞。2018年,针对癌症生物标志物B细胞成熟抗原的Nb CAR -T 细胞候选物治疗难治性/复发性多发性骨髓瘤的I期临床试验结果显示出令人满意的结果。它成功地完成了I期临床试验,并进行了进一步的II期试验,在首次给药4年后进行的随访研究也显示,CAR-T细胞具有良好的长期安全性和持久性。基于I期和II期临床试验的成功,这种Nb CAR-T细胞候选药物(更名为Ciltacabtagene autoeucel)于2022年2月被FDA批准用于治疗多发性骨髓瘤。
4.2 纳米抗体用于自身免疫疾病的治疗
纳米抗体在治疗应用方面取得最大成功的领域是自身免疫性疾病的治疗。2018年,Caplacizumab被欧盟批准用于治疗获得性血小板减少紫癜(一种罕见的凝血疾病),这是纳米抗体治疗领域的里程碑式成功。不久之后,在2019年,Caplacizumab也被美国FDA批准用于消费者处方。另一种已经进入商业市场的纳米抗体治疗药物是Ozoralizumab,截至2022年9月,以TNF- α为靶点的Ozoralizumab在日本被批准用于治疗类风湿性关节炎。
4.3 纳米抗体用于抗感染
与肿瘤和自身免疫性疾病的广泛候选纳米抗体相反,几乎没有针对病毒、细菌和寄生虫引起的传染病的治疗候选纳米抗体。然而,也有一些针对传染病的纳米抗体治疗药物的报道,如针对轮状病毒的VHH 203027治疗腹泻和用于治疗呼吸道合胞病毒下呼吸道感染的ALX-0171。目前暂未获得积极进展。此外,一种用于治疗空肠弯曲杆菌感染的纳米抗体候选药物LMN-101已被报道,目前正在进行2期试验。治疗性纳米抗体的缺乏并不意味着纳米抗体不适合开发治疗病毒、细菌或寄生虫的疗法,而是表明这一领域在很大程度上仍处于起步阶段。
表1 纳米抗体临床应用进展
5.总结
自从30多年前它们被偶然发现以来,纳米抗体的应用领域呈指数级增长纳米抗体与传统单克隆抗体相比具有许多优势,这推动了研究的发展,此外,在过去几年中,纳米抗体治疗癌症和自身免疫性疾病的多种疗法获得批准,推动了商业和工业的兴趣。因此,这一领域将在不久的将来进一步发展。此外,纳米抗体治疗传染病的潜力也已被证明明显存在,但仍需要大量的研究和开发。因此,可以肯定的是,在未来的几年里,纳米抗体将在下一代诊断工具和治疗方法的发展中发挥重要作用。
参考文献
[1]Jin, B.-k.; Odongo, S.; Radwanska, M.; Magez, S. Nanobodies: A Review of Generation, Diagnostics and Therapeutics. Int. J. Mol. Sci. 2023, 24, 5994. https:// doi.org/10.3390/ijms24065994
[2]Bailon Calderon, H.; Yaniro Coronel, V.O.; Cáceres Rey, O.A.; Colque Alave, E.G.; Leiva Duran, W.J.; Padilla Rojas, C.; Montejo Arevalo, H.; García Neyra, D.; Galarza Pérez, M.; Bonilla, C.; et al. Development of Nanobodies Against Hemorrhagic and Myotoxic Components of Bothrops atrox Snake Venom. Front. Immunol. 2020, 11, 655
[3]Zimmermann, I.; Egloff, P.; Hutter, C.A.J.; Kuhn, B.T.; Bräuer, P.; Newstead, S.; Dawson, R.J.P.; Geertsma, E.R.; Seeger, M.A. Generation of synthetic nanobodies against delicate proteins. Nat. Protoc. 2020, 15, 1707–1741