您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-02-11 09:31
间接竞争ELISA是一种基于抗原-抗体特异性结合的免疫检测技术,用于检测样品中微量的小分子抗原或半抗原。
在该实验中,先将已知抗原包被在酶标板的微孔表面,然后加入待测样品和一定量的抗体。如果样品中含有目标小分子(抗原),这些小分子会与包被在板上的抗原竞争有限的抗体结合位点,从而抑制抗体与包被抗原的结合。接着加入酶标二抗,与结合在包被抗原上的抗体结合,通过酶催化底物产生显色反应,根据颜色的深浅来定量分析样品中目标小分子的含量。
由于样品中目标小分子的量与最终的颜色信号成反比,所以通过测量吸光度值可以间接反映出样品中目标小分子的浓度。
一、实验前准备
1、试剂选择
(1)包被抗原:选择具有良好免疫原性和特异性的抗原,它将作为固相载体上的捕获分子,决定着整个实验的特异性和灵敏度。因此尽量使用高纯度的抗原,可通过亲和层析、离子交换层析等方法纯化。如果是自己制备的抗原,要确保其结构完整,避免变性。例如,对于蛋白类抗原,可使用SDS-PAGE和Western blot来鉴定其纯度和分子量。保存抗原时,根据其稳定性选择合适的保存条件,一般在-20℃或-80℃,避免反复冻融。
(2)抗体是间接竞争ELISA的核心试剂,与抗原的亲和力和特异性直接影响实验结果。因此可以使用单克隆抗体或多克隆抗体。单克隆抗体特异性强,批间差异小;多克隆抗体可能具有更好的亲和力,但特异性相对稍弱。选择时根据实验要求权衡。保存抗体时,遵循供应商的建议,一般在4℃短期保存或-20℃长期保存,避免反复冻融。可将抗体分装成小份,使用时取出一份,减少因反复冻融导致的活性下降。
(3)酶标二抗:酶标二抗与一抗结合,通过酶的催化作用产生可检测的信号。选择与一抗来源物种相匹配的酶标二抗,如一抗是小鼠来源的,可选择抗小鼠的酶标二抗。确保二抗的工作浓度经过优化,可通过预实验确定最佳浓度。购买高质量的酶标二抗,检查其保质期和保存条件,通常在4℃保存,并注意避免光照,因为一些酶(如HRP)对光敏感。
2、耗材准备
(1)酶标板:作为反应的固相载体,其质量会影响抗原包被效果和实验背景信号。优先选择质量可靠的品牌,如Costar、Nunc等。不同类型的酶标板(如聚苯乙烯、聚氯乙烯)可能对实验结果有影响,一般使用聚苯乙烯的高吸附板进行蛋白包被。在使用前检查酶标板是否有损坏或污染,可通过肉眼观察或用蒸馏水清洗后检测吸光度来判断。
(2)移液器和吸头:准确的加样对于实验结果的准确性至关重要。使用经过校准的移液器,定期检查和校准其准确性。使用合适量程的移液器,避免超量程使用。选择与移液器匹配的高质量吸头,确保吸头无RNase、DNase和内毒素,防止污染。
二、实验操作
1、包被:将抗原固定在酶标板的孔底,为后续与抗体的结合提供结合位点。一般使用碳酸盐缓冲液(pH9.6)或PBS缓冲液(pH7.4)作为包被缓冲液,将抗原稀释至合适浓度(根据预实验优化,一般为0.5~10μg/mL)。每孔加入100μL抗原溶液,4℃过夜或37℃孵育2~4小时。包被后,用洗涤液(一般是含0.05%Tween-20的PBS)洗涤3~5次,以去除未结合的抗原。可以使用酶标仪检测OD值,判断包被效果,一般OD值在0.8~1.2之间较为理想。
2、封闭:封闭未被抗原占据的酶标板表面,减少非特异性吸附。常用的封闭剂有牛血清白蛋白(BSA)、脱脂奶粉等。使用1%~5%BSA或5%脱脂奶粉的PBS溶液,每孔加入200μL,37℃孵育1~2小时或4℃过夜。封闭后彻底洗涤,确保去除未结合的封闭剂,以免影响后续的反应。
3、竞争反应:在样品和已知浓度的标准品中加入一抗,使它们竞争与包被抗原结合,样品中的目标分子会与标准品竞争结合抗体,从而反映样品中目标分子的浓度。准备一系列浓度的标准品溶液,涵盖预期的样品浓度范围。同时加入适量的一抗,一抗浓度根据预实验优化。一抗孵育时间和温度可根据抗体说明书和预实验调整,一般37℃孵育1~2小时或室温孵育2~4小时。包括阳性对照、阴性对照和样品孔,每个样品和标准品设多个复孔,以提高结果的可靠性。
4、酶标二抗孵育:使酶标二抗与一抗结合,为后续显色反应做准备。使用含0.05%Tween-20的PBS稀释酶标二抗,稀释倍数根据预实验确定,一般为1:5000~1:20000。每孔加入100μL酶标二抗溶液,37℃孵育1小时左右,然后充分洗涤,去除未结合的二抗。
5、显色和终止原理:通过酶催化底物产生颜色反应,终止反应后测量吸光度,反映目标分子的含量。若使用HRP标记的二抗,常用的显色剂是TMB底物,加入100μL,在室温或37℃避光显色10~30分钟,至颜色达到一定强度。使用2M硫酸终止反应,每孔加入50μL,终止反应后立即在酶标仪上读取450nm(或450/630nm双波长)处的吸光度。
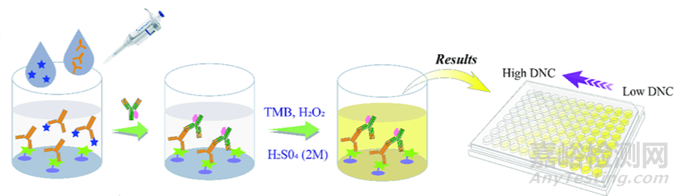
三、实验数据分析
1、标准曲线绘制原理:根据标准品的浓度和相应的吸光度值绘制标准曲线,用于定量分析样品中的目标分子浓度。以标准品浓度为横坐标,吸光度为纵坐标,使用软件(如GraphPadPrism、Excel)绘制标准曲线。通常使用四参数逻辑曲线(4PL)拟合,该曲线能较好地拟合间接竞争ELISA的数据。检查曲线的拟合度(R²值),一般要求R²>0.95,确保曲线的可靠性。
2、结果分析原理:根据标准曲线计算样品中目标分子的浓度。将样品的吸光度值代入标准曲线方程,计算出样品中目标分子的浓度。对于超出标准曲线范围的样品,需要稀释或浓缩后重新检测。分析数据时,计算样品浓度的平均值和标准差,评估实验的重复性和准确性。对于多组实验数据,可以使用统计分析软件(如SPSS)进行组间比较。
四、常见问题及解决方法
1、高背景信号可能原因及解决方法
(1)封闭不充分:增加封闭剂的浓度或延长封闭时间,优化封闭条件。
(2)洗涤不彻底:增加洗涤次数或延长洗涤时间,确保洗涤液完全覆盖孔底,避免残留的试剂影响后续反应。
(3)酶标二抗浓度过高:降低二抗浓度,重新进行实验。
2、低信号强度或无信号可能原因及解决方法
(1)抗原或抗体失活:检查试剂的保存条件和有效期,使用新的试剂重新实验。
(2)包被效果不好:优化包被抗原的浓度和包被条件,如调整包被缓冲液、时间和温度。
(3)显色时间过短:适当延长显色时间,但要避免过度显色导致颜色过深,难以准确测量。

来源:实验老司机


