目的:堆密度、振实密度是粉体的重要参数,主要体现粉体的粒度和流动性。其测定条件对结果的影响较大。本研究旨在考察不同测定条件对结果的影响,为药用辅料或制剂中间体的粉体压缩性测定提供有意义的科学借鉴。方法参考《中华人民共和国药典》( 2020 年版) 四部附录固定质量法( I 法) 对三种压缩性的药用辅料进行堆密度及振实密度的测定,并计算得到压缩性指数及豪斯纳比率。
结果:物料的装填速率是影响堆密度的关键因素,随装填速率增大,粉体堆密度增大,压缩性指数减小。在振实密度测定中,振幅高低对压缩性指数大的物料影响显著。结论对比研究不同压缩性的药物辅料时,应在同一条件( 如量筒体积、装填速率、装填量、振幅等) 下进行检测。应用I 法时,建议选用250 mL 量筒、100 g 样品及14 mm 振幅条件下进行测定。
堆密度、振实密度是粉体材料表面特性的重要表征参数,也常用于计算豪斯纳比率和压缩性指数,可反映药用辅料可压缩性[1]。《中华人民共和国药典》( 2020 年版) 四部通则中“0993 堆密度和振实密度测定法”给出了堆密度和振实密度测定方法及粉体压缩性( 如压缩性指数、豪斯纳比率计算公式) 的计算要求[2]。这与《欧洲药典》[3]、《美国药典》[4]及《日本药局方》[5]上的规定基本一致。目前常用测定方法有三种,分别为固定质量法、体积计法和固定体积法[6]。但由于体积计法无法测定振实密度,固定体积法仪器较复杂,所以辅料厂家常选用固定质量法进行试验。由于粉体压缩性并不是粉体的固有属性,实验操作过程对测定结果影响较大[7],同时目前各辅料厂家在应用固定质量法时大多选择企业内控标准操作进行测定。因此有必要对固定质量法的具体测定方法进行考察优化。
本文作者研究了不同量筒体积、装填量、装填速度及振幅等试验操作因素对药用辅料堆密度及振实密度测定结果的影响,同时提出在试验操作过程中出现的影响测定结果的问题,并给出解决方法。在合理利用固定质量法对药用辅料、药物颗粒( 制剂中间体) 的粉体压缩性测定上提供具有科学的借鉴意义。
1、仪器与材料
BT301 型振实密度测定仪( 丹东百特仪器有限公司) ,BSA 124S 电子分析天平( 北京赛多利斯仪器系统有限公司) 。
微晶纤维素( microcrystalline cellulose,MCC,CEOLUSTM UF-711,批号: 7981,日本旭化成株式会社) ,微晶纤维素( MCC,AvicelⓇ PH-200NF,批号: M1804C,美国Du Pont Nutrition Biosciences公司) ,玉米淀粉( maize starch,批号:E1922,法国Roquette 公司) 。所选用的辅料性质如表1所示。
表1 粉体压缩性测定所选用的辅料的粉体学性质
2、方法与结果
2.1 堆密度与振实密度的测定
按《中华人民共和国药典》( 2020 年版) 四部通则“0993 堆密度和振实密度测定法”( 以下称为通则0993) 进行测定,精密称定100 g 过筛待测粉末样品,缓慢倾入玻璃刻度量筒,记录表观体积,按公式ρB = m/V0计算,式中ρB为堆密度( g·mL - 1 ) ; m 为待测样品质量( g) ; V0为待测样品表观体积( mL) 。将量筒固定于托架上,进行振实多次后,直至两次连续记录的体积之差小于2 mL,按公式ρT = m/VF计算,式中ρT为振实密度( g·mL - 1 ); m 为待测样品质量( g); VF为振实体积( mL)。取同一批样品3 份,平行测定,记录读数,以平均值作为测定结果。
2.2 压缩性指数及豪斯纳比率的计算
依据堆密度与振实密度数据,压缩性指数按公式C = 100( V0 - VF) /V0计算。式中,C 为压缩性指数( %) ,豪斯纳比率按公式HR = V0 /VF计算,式中HR 为豪斯纳比率。
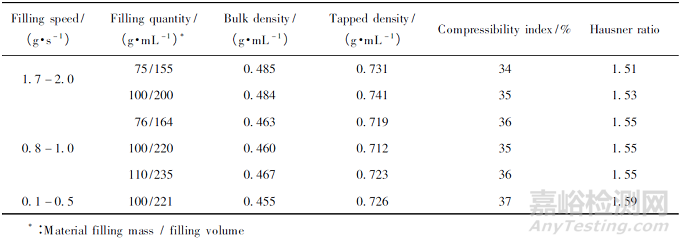
2.3 物料的装填速度及装填量对堆密度及压缩性测定的影响
选用玉米淀粉与无水磷酸氢钙进行研究。考虑装填速度是影响堆密度的重要因素,所以确定0. 1 ~ 0. 5、0. 8 ~ 1. 0 g·s - 1和1. 7 ~ 2. 0 g·s - 1三种装填速度进行试验。在通则0993 中,规定装填量为100 g,若样品密度过高或过低,应选择其他样品量进行试验,所以选定三种装填量,分别是小于100g,等于100g 和大于100g。物料装填速度及装填量对物料粉体学性质的影响见表2。由表2可知,随辅料的装填速度增加,样品堆密度增大,振实密度无明显影响,压缩性指数逐渐减小。
表2 物料的装填速度及装填量对淀粉的压缩性指数及豪斯纳比率的影响(n=3)
影响压缩性指数的因素是堆密度和振实密度。辅料充填速度过快会压实粉体堆,导致辅料的堆密度会增大,但对振实密度无显著影响。当物料的装填速度一定时,装填量( 或体积) 对淀粉的压缩性指数( 或豪斯纳比率) 测定无显著影响。因此,填装速度不宜超过1. 0 g·s - 1,同时为保证试验效率,物料的装填速度应保持在0. 8 ~ 1. 0 g·s - 1 ; 装填量建议为100 g,与《中华人民共和国药典》( 2020 年版) 规定保持一致。
2.4 振幅对不同辅料的粉体压缩性测定的影响
为考察不同流动性物料的适用性,选定流动性分别为好、中和差的PH-200NF 型微晶纤维素、UF-711 型微晶纤维素和玉米淀粉进行考察。根据通则0993 规定,固定质量法中振幅可为3 mm或14 mm。试验结果见表3。流动性好的物料( 如PH-200NF) 在不同振幅条件下振实体积差距较小; 流动性一般的物料( 如MCC UF-711) 振实初期体积差距较大,随次数增多体积差距不断减小,但采用低振幅会增加达到平衡的时间。
表3 振幅对三种辅料的粉体学特性的影响对比(n=3)
对于粘附性强的淀粉,振幅对振实体积的影响较大。因此,对于流动性一般或粘附性强,且不易“破碎”的物料考虑选用14 mm 高振幅进行测定。
2.5 量筒体积对粉体压缩性测定的影响
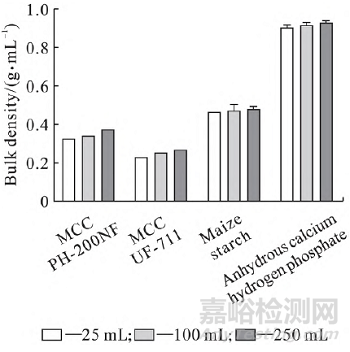
按通则0993 规定,应选择容积为250 mL( 最小刻度为2 mL) 的刻度量筒。若100 g 粉末的表观体积在50 ~ 100 mL 范围内,可选择容积为100 mL( 最小刻度为1 mL) 的刻度量筒。考虑测试价格昂贵样品时,尽可能减少装填量,所以选定容积为250、100 mL 和25 mL 的刻度量筒考察[8 - 10]。结果显示随量筒体积减小,堆密度呈减少趋势,但对振实密度的影响无规律性。结果见图1和图2。
图1 量筒体积对不同辅料的堆密度的影响对比
随着量筒体积的减少,装填量也较少,对下层物料的冲击力减少,因而物料堆密度呈减小趋势[11]。而量筒体积对振实密度的影响并无规律性,这应该是振动强度或判断试验结束标准不同所引起的数据差异。如参照《中华人民共和国药典》( 2020 年版) 规定, 100 mL 量筒是以最后两次振实体积差值小于2 mL 判断试验结束( 与250 mL相同) ,除去无水磷酸氢钙外,其他的物料可能并未达到完全振实状态,所以检测到的振实密度较其他两种量筒的数据小。因此,在考察不同种类辅料时,必须在同一条件下进行检测,尽量选择容积为250 mL 的刻度量筒。
图2 量筒体积对不同辅料的振实密度的影响对比
2.6 体积的读数对堆密度和振实密度的影响及解决方案
采用固定质量法测定堆密度或振实密度的最大问题在于粉末表面不规整,影响读数。例如在测定淀粉过程中,物料粘附在内壁,如图3A; 或振实后物料顶端呈非平整状态,如图3B,均造成读数困难,导致人为误差较大[12]。抑或针对这一问题,目前采取的解决方案: 1) 用棉签等刮去粘附在量筒壁上的淀粉,小心地使用刮板尽量抚平淀粉的表面,便于读数( 但管壁有空隙时,需重新装填) ; 2) 分别取三个最高点和最低点,取最高点和最低点的平均值,作为实测值。如能细心熟练地使用上述两种方法,对堆密度及振实密度的测定无显著影响[13]。
图3 固定质量法测定辅料堆密度及振实密度的问题
3、结论
在固定质量法中,粉体压缩性试验结果受不同测定条件影响。物料的装填速度增大,辅料测定的堆密度增大,振实密度无明显影响,因此压缩性指数逐渐减小。振幅对压缩性指数小的物料影响较小,但对压缩性指数大的物料影响显著。为减少振动次数,对于不易“破碎”或粘附性辅料建议采用高振幅方法。随量筒体积的减小,堆密度呈减少趋势,而对振实密度无规律性的影响。同时,考虑到读数会造成较大的人为误差,应选择三面读数取平均值的方法来确定样品体积。所以建议应用固定质量法时,选用容积为250 mL 的刻度量筒, 100 g 样品及14 mm 振幅进行测定。
参考文献
[1] FANG L. Pharmacokinetics ( 药剂学) [M]. Beijing:People's Medical Publishing House, 2016: 177 - 180.
[2]Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia:part 4( 中华人民共和国药典: 四部) [M].Beijing: China Medical Science Press,2020: 151 -153.
[3]European Pharmacopoeia Commission. European Pharmacopoeia9. 0[S]. Europe: European Directorate forthe Quality of Medicines, 2017: 359 - 361, 363 - 364.
[4] The United States Pharmacopoeia Commission. The United States Pharmacopeia 40 [S]. The United States: The United States Pharmacopoeia Convention,2017: 505 - 508, 1604.
[5]Japanese Pharmacopoeia Commission. Japanese Pharmacopoeia17[S]. Japan: Ministry of Health,Labourand Welfare, 2016: 98 - 100, 2425 - 2426.
[6] INOUE Y. Powder characteristics tester,model PT-S&USP tapped density tester[J]. Micromeritics,2008,51: 81 - 86.
[7] WANG L,PAN J,YUAN Y,et al. Research progress of evaluation methods for flowability of pharmaceutical powders [J]. China Powder Science and Technology(中国粉体技术) , 2016( 5) : 28 - 34.
[8] China Association for Standardization. GB /T 5162 -2021,Metallic powder-determination of tap density(金属粉末振实密度的测定) [S]. Beijing: Standards Press of China, 2021.
[9] American Society of Testing Materials. ASTM B527 - 15, standard test method for tap density of metal powders and compounds. Standard test method for bulk solids characterization by Carr Indices[S]. The United States: American Society of Testing Materials,2015.
[10] ARTAMONOV V V,BYKOV A O,BYKOV P O,et al. Measurement of the tap density of metal powders[J]. Powder Metall Met Ceram, 2013, 52: 237 - 239.
[11]AKSELI I,HILDEN J,KATZ J M,et al. Reproducibility of the measurement of bulk /tapped density of pharmaceutical powders between pharmaceutical laboratories[J]. J Pharm Sci, 2018, 108( 3): 1081 - 1084.
[12]HERTZSCH J M. Cellular model for the compaction of a vertically tapped granular column[J]. Eur Phys JB, 2000, 18( 3) : 459 - 466.[13]SILVA J P S,SPLENDOR D,GONCALVES I M B,et al. Note on the measurement of bulk density and tapped density of powders according to the European Pharmacopeia[J]. AAPS PharmSciTech,2013,14(3) : 1098 - 1100.