近期,来自美国天普大学的Santiago Orrego研究员在科爱创办的期刊Bioactive Materials上发表文章。本综述文章报道了抗菌应用的生物活性、刺激响应和自主牙科材料的设计、评估、优势和局限性。首先,讨论了智能生物材料的重要性和分类。其次,根据不同的刺激,包括pH、酶、光、磁场等,列出了生物响应抗菌牙科材料的类别,讨论了它们的抗菌机制、应用和实例。最后,研究了开发这些技术的临床相关应用所面临的局限性和障碍。
1. 引言
与骨骼不同,牙齿的自我再生能力有限,牙釉质是无细胞的,不能自我再生。牙本质的自我再生能力也受到牙髓干细胞库的限制和制约。因此我们依赖牙科材料来治疗和改善口腔健康。
然而,口腔微环境使牙科材料面临着挑战。细菌可以产生使硬组织脱矿产酸,从而导致直接和间接修复的失败。它们通过干扰唾液中的酶来实现这一点,从而导致牙科树脂粘合剂的水解降解。理想的牙科材料需要对抗病原体,防止水解降解,促进牙齿再矿化,与组织牢固结合,并使牙齿组织再生以治疗牙科疾病。到今天为止,我们仍然没有找到用于不同牙科治疗的最佳材料。
技术和制造工具的最新进展使“智能”牙科材料的开发成为可能。一般来说,“智能”生物材料会根据刺激改变一个或多个性能。例如,在疾病的进展期可以触发智能生物材料在需要的时刻释放用于治疗的特定药物。智能生物材料的定义非常宽泛,经常被误解,而且不具有包容性,阻碍了具有不同“智能”功能的生物材料的识别和分类。
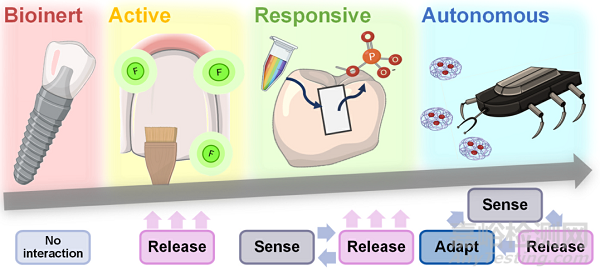
Fig. 1. Levels of smart biomaterials are classified as bioinert, bioactive, bioresponsive, or autonomous. Bioinert biomaterials cause minimal interaction with surrounding tissues and are the least smart. Bioactive materials release an active therapy after implantation to elicit a specific biological response at the material- tissue interface. Bioresponsive materials react to in-ternal or external stimuli releasing specific agents for therapy. Finally, autonomous (or self-sufficient) materials respond holistically to the microenvironment complexity (adapting to changing conditions).
为了解决这一问题,Montoya等人特意根据智能化程度对智能生物材料进行分类,智能化程度由生物材料与周围环境的相互作用程度以及提供治疗的精确度决定。他们定义了四个级别的智能生物材料,包括生物惰性、生物活性、生物反应性和自主性(图1)。
生物惰性生物材料与周围组织的相互作用最小,植入后对周围组织的伤害或毒性最小。例如,聚醚醚酮(PEEK)是一种安全、化学惰性的生物材料,用于口腔植入物、牙冠、牙桥、内支架和义齿框架制作。其他生物惰性牙科材料包括不锈钢、钛和聚甲基丙烯酸甲酯(PMMA)。生物活性材料在植入或接触组织、细胞或体液后,在材料-组织界面诱导特定的生物反应。在这种情况下,生物活性指的是提供有益治疗的材料(例如抗菌、再生、药物递送),而不是仅提供再矿化的生物材料。这些生物材料安装在体内后“不受控制”地释放治疗。例如,释放氟化物的化合物可以稳定牙齿的循环脱矿和再矿化过程。当唾液pH值小于5时,氟离子取代牙齿羟基磷灰石中的OH离子,导致氟磷灰石(FA)或氟羟基磷灰石(FHA)的形成,这些化合物更能抵抗pH值的变化,从而抵抗脱矿。此外,氟化物通过抑制细菌生长并干扰其嗜酸性、耐酸性和对牙齿表面的粘附,对细菌细胞具有毒性。
生物惰性牙科材料可以通过表面涂层或功能化升级为生物活性材料。响应性、生物响应性或刺激响应性生物材料可以“感知”特定刺激(如光、温度、pH变化、电场和磁场、酶),然后通过释放预编程来“响应”治疗。它们可以对体内或体外信号做出反应。例如,牙科复合材料是用对pH敏感的NP制成的,这些NP在一定的pH水平(酸性)下提供抗菌剂来治疗龋齿。最后,自主生物材料可以感知多种刺激,并相应地调整它们的反应,以在不同的时间点为每种需求提供适当的反应。这类生物材料是最聪明的。例如,负载抗菌疗法的磁驱动纳米机器人能够穿透根性牙本质中的牙本质小管,以消毒和治疗根管感染。然而,牙科尚未充分利用这些智能生物材料改善口腔健康。
近年来,智能生物材料在医学不同领域的应用呈指数级增长。它们具有广泛的应用,如药物递送、生物传感器、组织工程、抗菌药物、组织再生和再矿化等。牙科开始受益于这些生物材料的智能化功能。本文旨在汇编智能生物材料是如何应用于牙科抗菌治疗。
2. 口腔环境和对抗菌牙科材料的需求
口腔是人体中第二复杂的微生物群落。它由细菌、病毒、真菌和原生动物组成。700多种微生物在口腔内形成生物膜,口腔生物膜通常以共生(平衡)状态共存。在这些条件下,致病性口腔微生物的增殖受到抑制,从而防止疾病的发展。例如,宿主的免疫系统与其微生物共生体(共生物种)之间的积极相互作用可以防止口腔粘膜的急性感染。当微生物组内的平衡被破坏时,就会发生生物失调。在这种情况下,与疾病相关的病原体数量增加,而共生体数量减少。导致口腔微生态失调的因素包括唾液(流量/成分)的变化、口腔卫生不良、抗生素治疗和生活方式选择(饮食、吸烟)。例如,修复体和牙齿组织之间的界面含有细菌,这些细菌无法用传统的清洁方法去除,导致继发性龋齿和修复失败。除了生物因素外,口腔健康还涉及社会、经济、政治和文化方面(如社会结构和健康信念)。例如,社会经济不平等(即收入和教育机会),以及公共政策和服务的可获得性,会影响人口的总体健康状况以及医疗和牙科服务的使用。
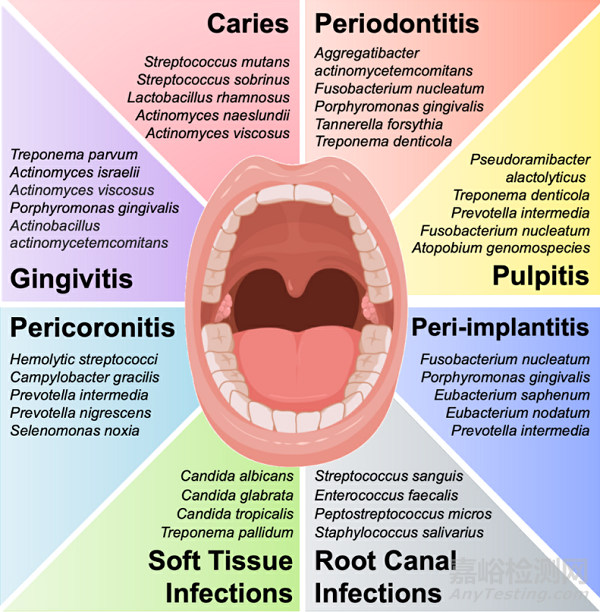
Fig. 2. Pathogen microorganisms associated to oral and systemic diseases.
微生物群自然平衡的有害变化可能导致口腔疾病,如龋齿、牙周炎、根管感染、种植体周围炎、牙髓炎、念珠菌感染、义齿口腔炎和软组织感染(图2)。例如,在龋齿中,糖摄入量的增加和唾液流量的减少会导致产酸和耐酸细菌(如变形链球菌)的生长,这些细菌会使硬组织脱矿并抑制共生物种的生长。如果致病性生物膜得不到控制,口腔感染可能会成为慢性感染,导致牙齿组织损伤,甚至导致牙齿缺失。因此,开发提供抗菌疗法的牙科材料对于预防牙齿感染和早期治疗失败是必要的。
尽管口腔感染通常具有多微生物性质,但特定的病原体与特定的牙齿感染有关。开发抗微生物生物材料的主要策略是阻止这些病原体的生长。例如,变形链球菌是与龋齿相关的主要病原体,而白色念珠菌的过度生长与念珠菌诱导的义齿口炎的发展有关。大多数抗龋齿生物材料仅针对这种病原体进行测试。然而,感染通常是多微生物的。变异链球菌并不是单独作用于龋齿的发展,因为不同微生物之间存在相互作用。例如,白色念珠菌和变形链球菌在龋齿发展过程中具有强烈相互作用,这种相互作用产生的微生物产物刺激变异链球菌在生物膜内的积累,导致疾病的严重程度和治疗难度增加。开发抗微生物牙科材料的更复杂策略包括靶向治疗与特定感染相关的特定毒力基因,或通过信号分子的酶降解、阻断信号生成和阻断信号接收来中断细菌通讯机制(即群体猝灭)。
3.用于抗菌和抗生物膜疗法的智能牙科材料
牙科领域已经使用了大量的抗菌剂来治疗不同的感染。这篇综述是介绍提供这些抗菌剂的不同策略的新综述,这些抗菌剂是根据生物材料的智能水平分类的。例如,银是一种用于治疗/预防龋齿的传统抗菌剂。该试剂的一种常见递送方法是在表面上涂覆涂层(例如SDF–氟化二胺银)。然而,由于银现在可以制造成纳米尺寸,它可以封装或装载在不同载体中,以实现“复杂”或“智能”的交付。此外,该领域还开发了牙科材料,通过将不同的试剂组合到单一载体中,提供多种抗菌功能(例如杀死病原体和破坏生物膜基质)。本文展示了牙科中用于递送/释放抗菌剂的不同方法,包括生物活性、生物响应和自发性。
3.1.生物活性抗微生物疗法
在生物活性疗法中使用不同的抗微生物剂,包括化合物(例如抗生素,如氯己定(CHX)、二甲胺四环素)、阳离子单体例如甲基丙烯酸季铵,MDPB)、抗微生物肽(AMP)以及金属和非金属填料(例如氧化锌)。
生物活性技术通常包括将这些抗菌剂掺入载体(生物材料)中,以在植入后立即提供治疗。例如,可浸出的抗生素,如CHX、四环素和甲硝唑已被掺入粘合剂、密封剂和义齿中,防止生物膜形成并抑制微生物生长。已经研究了纳米空间中抗菌剂的其他载体,包括树枝状聚合物、纳米胶囊、核壳、脂质体、胶束和纳米纤维。由于其大的接触表面,纳米纤维被用作高负载载体,而胶束由于其易于操纵和封装试剂而被优选。这些纳米载体的优点是改善了对药物释放的控制、药代动力学,增加了药物选择性,从而提高了治疗效果。这些具有生物活性的抗微生物制剂中的许多已经在临床实践中使用。
生物活性单体通常掺入牙科树脂(复合材料、底漆和粘合剂)中,用于抗菌治疗。它们在未聚合时表现出优异的抗菌效果,但在聚合后也具有接触抑制效果。抗菌单体也可以固定在聚合物链内,但也可以自由地作为可浸出的化合物。最近的工作重点是增加单体浓度(高达5%),以提高抗菌效果,同时不影响生物相容性、溶剂吸附、机械和固化性能。这些制剂已经对各种革兰氏阳性和革兰氏阴性细菌进行了测试,包括龋齿和肠道相关病原体。
生物活性填料作为一种很有前途的策略,已引起人们的关注,以克服微生物对抗生素耐药性的担忧通常,这些填料是无机的(如金属),在纳米尺度上由几十纳米制成,形状各异。最常见的填料是纳米结构(银、氧化锌、钛和铜化合物、玻璃、纳米金刚石)、聚合物/有机物(季铵聚乙烯亚胺、壳聚糖)和AMPs。
为了实现抗菌治疗,填充物或其离子被释放到微环境中以阻止病原体。NP作为填料的使用提供了广泛的定制可能性。例如,可以通过改变填料尺寸、表面积与质量比、颗粒形状、表面电荷、剂量和NP涂层来提高NP的抗菌/抗生物膜响应。此外,可以对填充物进行修饰,以针对副作用较少的特定病原体。(生物)分子的吸附、官能团的添加和填料表面电荷的改变会诱导对某些细菌的抗菌选择性。在牙科复合材料中,填料的量会影响材料的性能(结构、美观、化学、生物)。例如,将高达7.5%的ZnO NP添加到标准牙科粘合剂中,促进了生物膜的大量细菌减少,同时保持了可接受的转化程度、弯曲强度和弹性模量。
抗菌肽对革兰氏阳性和革兰氏阴性细菌、真菌、寄生虫和病毒具有广谱抑制活性。它们的抗菌活性与构象(α-螺旋)、净电荷和疏水性有关。AMPs存在于唾液、龈沟液(如组胺-1,3和5)、上皮(如肾上腺髓质素、β-防御素)和中性粒细胞(α-防御素。天然AMPs作为防御各种微生物毒力因子的机制。例如,组胺蛋白可作为预防继发性龋齿(变形链球菌)的抗菌剂,而成熟的α-防御素对大肠杆菌、粪肠球菌和白色念珠菌具有抗菌活性。AMPs可以来源于天然(如微生物、植物、昆虫、甲壳类动物、哺乳动物)或合成来源。作为抗微生物剂,AMPs已被纳入粘合剂系统和植入物涂层中。例如,ε-聚赖氨酸被添加到树脂系统中,并成功测试了与牙周炎和龋齿相关的口腔病原体。抗菌AMPs的使用也已扩展到体外测试牙本质复合物界面,显示出对两种关键的产酸初始定植体以及与失败的复合修复体相关的最丰富的分类群的选择性抗菌效力。AMPs的研究已经进入临床试验阶段,并取得了乐观的结果,可以进行商业化。与传统抗生素相比,抗菌肽的主要优点是细菌耐药性最小,起效快,对哺乳动物细胞毒性较小。此外,抗菌肽具有针对特定细菌群的能力。但AMPs仍然存在许多重大挑战,包括随着药物间隔时间的减少,抗菌活性降低,溶血率高,提取成本高,半衰期短(<37小时),体内稳定性低。
抗菌涂层也是生物活性疗法的一部分。对于种植体牙科,涂层可以防止细菌在种植体表面定植和生物膜形成,并成功减少了种植体周围粘膜炎、种植体周围炎和种植体损失。制造抗菌涂层的策略包括接触和释放杀伤表面。接触杀伤表面基于表面附着的抗微生物元素,如季铵化合物、AMP和抗微生物酶(AMEs)。抗菌涂层通常基于药物递送系统和离子释放涂层,如Ag、Au、Zn和Cu。与抗生素相比,抗菌涂层具有一些优势,尤其是在其局部活性方面。然而,在某些情况下,当其达到最大抗菌性能时,其生物相容性和骨螯合可能会受到影响。
尽管这些生物活性抗微生物剂中的一些已经在商业上使用,但仍存在一些局限性。首先,长期提供抗微生物疗法是有问题的,因为它可能通过细菌之间的水平基因转移引起抗微生物耐药性。这些技术在植入后立即开始释放药剂,导致与治疗持续时间(寿命)相比,效果迅速耗尽。通常情况下,可浸出剂的抗菌效果小于1年。一旦耗尽,药剂就无法再补充。其次,抗菌剂的释放可能导致载体的性能发生变化。例如,与不含抗菌剂的相同材料相比,含有失效剂的牙科复合材料、密封剂或粘合剂可能对机械和物理性能有害。第三,抗微生物剂的不受控制的释放对适当剂量的递送提出了挑战。这种不受控制的释放可以加速药剂消耗或提供不足量的药剂用于治疗。通过使用纳米载体在一定程度上规避了这一点。第四,缺乏靶向性会导致附带损害(杀死共生物种)和口腔微生物群的潜在失衡,因为这种疗法会“攻击”它在微环境中遇到的一切。第五,尽管化合物的使用有一些好处,如高疗效、高治愈率和应用的微创程序,但其使用仍然引起了人们对微生物对抗生素耐药性的担忧。
最后,尽管几项临床试验已经成功评估了纳米颗粒在不同牙科材料中作为抗菌剂的用途,但由于担心有毒离子的释放会导致健康细胞的炎症、免疫毒性、细胞毒性和遗传毒性,纳米颗粒在临床实践中的广泛使用受到限制。
3.2.生物响应性抗微生物疗法
生物或刺激响应性生物材料是指能够感知刺激,然后通过释放治疗剂对其做出反应的生物材料。通常,抗菌剂被纳入载体/载体(生物材料)中,旨在通过改变其性能(例如降解)来响应特定刺激。为了释放抗菌剂,一些载体在对刺激做出反应后可能会改变其结构或性能。生物响应性抗生物材料由于能够克服生物活性抗微生物疗法的一些局限性,包括单个病原体的靶点以及治疗的有效性、剂量、位置和持续时间的提高,而受到了相当大的关注。在牙科中,这些响应性抗菌技术是由不同的内部刺激触发的,包括微环境信号(病原体产生的唾液酶和低pH水平)、微生物的代谢产物(分泌酶),或通过靶向微生物表面的特定肽/蛋白/基因。这些反应性生物材料也是由外部(体外)刺激触发的,包括尿酸和产酸,在疾病进展过程中显著改变微环境的pH水平。
在牙科中,树脂(粘合剂/密封剂)、水凝胶和纳米载体(胶束)已被用作治疗感染的pH响应抗菌技术的“智能”载体。通常,在所需的pH水平下,具有弱酸(如羧酸)或碱(如伯胺和叔胺)基团的聚合物会导致电离、表面活性、链构象、溶解度和构型的变化。例如,甲基丙烯酸十二烷基甲基氨基乙酯(DMAEM)是一种叔胺(TA)树脂,在牙科中用作pH响应树脂。DMAEM具有可逆的质子化和去质子化反应,以响应pH水平的变化,在酸性条件下通过形成季铵单体表现为阳离子聚合物(抗菌剂)。Liang等人(2020)将DMAEM掺入牙科粘合剂树脂中(5%),在酸性介质(pH<6)存在的情况下提供抗菌效果。这种可逆的pH响应性和非药物释放性牙科粘合剂可以在不干扰口腔微生态平衡的情况下实现长期防龋效果。在最近的一项后续研究中,该团队成功地将DMAEM的使用转化为树脂基密封剂,以防止长期微渗漏。
释放抗菌剂的pH响应水凝胶也已用于牙科。最近的一项工作设计了一种N-二甲基氨基乙基甲基丙烯酸酯(DMAEMA)-甲基丙烯酸-2-羟乙酯共聚物(HEMA)(聚(DMAEMA-co-HEMA)水凝胶,该水凝胶能够响应pH水平释放CHX(抗菌剂),以预防和治疗龋齿。这种生物反应性生物材料抑制了变异链球菌生物膜的发育,并调节了口腔微生态系统。在另一项研究中,将含有CHX的纳米多孔二氧化硅NP与聚(4-乙烯基吡啶)水凝胶混合。在酸性pH值(<4.0)下,聚合物发生质子化并释放出抗菌剂。在生理pH值(7.0)下,聚合物防止了药剂的释放。该系统已成功地针对致龋病原体(变形链球菌)进行了测试。水凝胶响应于pH水平而膨胀/塌陷,以控制药物的释放和容纳。最近的一项工作使用pH响应水凝胶作为防污杀菌涂层。致龋细菌的生长降低了水凝胶表面的pH水平,从而引发了表面电荷的转移。在吸引病原体后,负载的八肽被释放以发挥抗菌作用。总的来说,pH敏感水凝胶在牙科应用中表现出了稳定性、细胞相容性和适当的机械性能。pH响应性纳米载体,如纳米凝胶、胶束、聚合物-药物偶联物、核壳NP和纳米球,已被用作这些类型生物材料的载体。
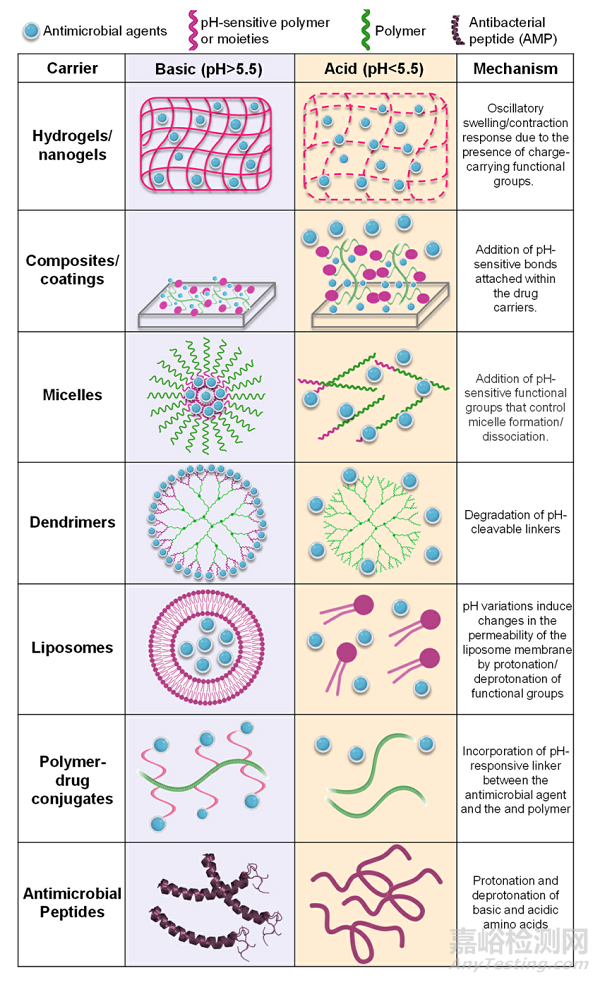
Fig. 3. Configurations used as pH-responsive carriers for the delivery of oral antimicrobial therapies. After degradation/cleavage of the pH-sensitive bonds/ compounds, the carriers release their payloads, which can be in the form of antimicrobial compounds, nano-fillers, or antimicrobial peptides.
通常,这些化合物是用pH可降解的键、pH可裂解的交联或包含电荷转移聚合物来制造的,当被刺激物激活时,电荷转移聚合物将其有效载荷释放到环境中(图3)。pH响应性纳米载体保护包封剂不被降解,并可以以可控的方式释放其产物。此外,由于生物膜内渗透性的增加以及药剂稳定性和溶解度的提高,药剂的局部释放增加了治疗效果。此外,最近的一项研究制造了季铵壳聚糖脂质体的pH响应NP,以对抗生物膜和治疗牙周炎。该制剂显示出可接受的细胞毒性,并在体内抑制牙龈炎症和牙槽骨损失。几项研究报道了一系列pH响应性NP的开发,用于体外和体内治疗龋齿。总体而言,NP对口腔微生物群多样性以及粘膜和牙龈组织没有显示出不良影响。
pH响应型抗菌肽最近为开发具有更高细菌选择性的口服抗菌技术开辟了新的机会。一种创新的方法是通过将AMPs封装到这些纳米载体中,将AMPs的抗菌能力和pH响应纳米载体的可调谐性结合起来。AMPs的封装和递送是保护肽免受酶降解的一种很有前途的策略。
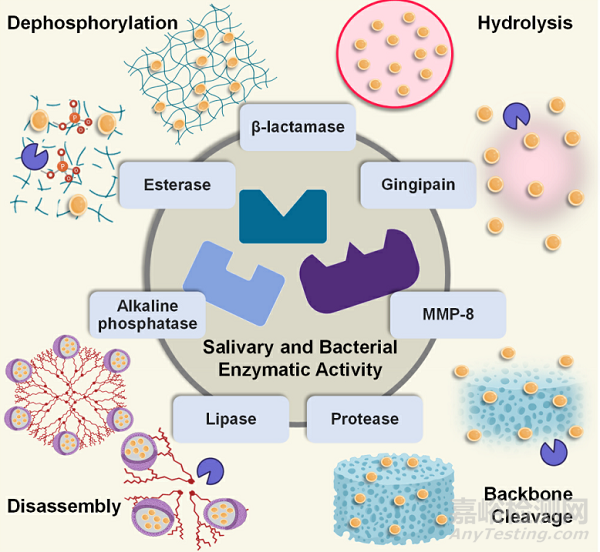
酶响应:酶是加速生物化学反应的催化剂。细菌和真菌分泌各种酶,包括脂肪酶、酯酶、磷酸酶、脲酶、明胶酶等。其中一些酶已被确定为指示疾病活动期的标志物,即需要治疗的时候。例如,慢性牙周炎的细菌副产物是基质金属蛋白酶-8(MMP-8),它会触发宿主免疫反应。这种酶已被用作治疗牙周炎的生物反应递送系统中的刺激物。
Fig. 4. Schematic representation of the typical drug delivery mechanisms used by enzyme-responsive antimicrobial dental materials. The listed salivary and bacterial enzymes activate enzyme-responsive materials such as membranes, nanocarriers (liposomes, dendrimers), nano-hydrogels, or polymer composites to release antimicrobial therapies such as antimicrobial compounds, nano- fillers, or antimicrobial peptides.
通常,酶响应性生物材料可以被编程为对不同的酶做出反应,包括细菌(即酯酶、磷酸酶、磷脂酶、β-内酰胺酶和明胶酶)、细胞表面酶(即MMPs)和唾液(即脂肪酶、蛋白酶、酯酶、α-淀粉酶、脱水酶、溶菌酶)(图4)。在这类生物材料中,酶响应在催化过程中具有高效性、高选择性和特异性,避免了传统抗菌疗法不分青红皂白地杀死细菌的局限性。在酶响应系统中,抗微生物剂在可降解载体(例如,聚(丁二酸乙二醇酯)(PES)、聚己内酯(PCL)、透明质酸、PEG)通过暴露于酶活性而降解后释放。酶可能导致载体中的水解、溶胀、主链断裂、降解、分解、磷酸化和去磷酸化,从而导致制剂在靶位点释放。
与其他响应性生物材料相比,被酶水平激活的生物材料离实现自主又近了一步。由于酶水平是一种内源性刺激,生物材料的激活不需要外部刺激,因此,宿主可“调节”药剂的释放。
光响应:这些抗微生物生物材料在被光激发后对抗病原体。已经开发出许多出色的光响应抗菌生物材料,包括光催化剂、光敏剂(PS)和光热材料。
具体而言,抗微生物光动力疗法(aPDT)利用无害的光来激活非毒性或最小毒性的PS,以产生用于根除病原体的细胞毒性物质(例如活性氧(ROS))。ROS(O2、H2O2、羟基自由基(·OH))的产生会对细菌膜和细胞壁造成损伤,破坏脂质、蛋白质和离子通道,去除关键代谢酶,细胞凝集,并直接抑制脂多糖、胶原酶和蛋白酶等外源毒力因子。而aPDT是一种非侵入性技术,与传统疗法相比具有优势。这些优势包括降低抗微生物耐药性,在不高PS浓度的情况下加速抗微生物消除,在不影响潜在结构和组织的情况下产生局部作用,开/关触发,以及对革兰氏阳性和革兰氏阴性细菌病原体的广泛抗微生物谱。由于该技术对各种口腔微生物病原体具有抗菌作用,因此在牙科中越来越多地用于治疗龋齿、念珠菌感染、牙周炎、牙髓病和种植体周围炎。
作为提高抗菌效果的一种策略,NP已被用作PS的载体,以避免PS的聚集和抗微生物耐药性,并增强其对生物膜基质和细菌细胞壁的渗透。诸如富勒烯、石墨烯、氧化石墨烯、碳纳米管和金属氧化物NP(即ZnO、TiO2、Au、Ag)等NP由于其高稳定性、产生ROS的能力、热性能、光学性能和生物相容性财产而被优先用作PS。
可生物降解水凝胶、胶束、脂质体和聚合物NP作为PS纳米载体的制备允许PS在感染部位局部释放,降低副作用的风险,并提高治疗效果。这些纳米载体是“双重智能”的,因为PS的释放是在载体因水解、化学或酶促反应而降解后发生的。此外,一旦PS在感染部位释放,辐射就诱导抗微生物治疗。
使用光来杀死口腔病原体已被建议作为一些牙科治疗(即龋齿、蛀牙、种植体周围炎)的辅助治疗和局部消毒治疗(即根管消毒)。例如,为了治疗蛀牙,将ZnO、氟改性纳米二氧化硅和聚二甲基硅氧烷(PDMS)混合制成的牙科涂层喷涂在牙齿表面时,可有效抵抗细菌和蛋白质的粘附。与单独的药物相比,近红外辐射在口腔生物膜渗透和破坏方面提供了增强的效力。缺氧微环境中的抗菌作用由于持续的氧气消耗和光穿透深度的不良激发而受到阻碍。为了克服这些挑战,已经提出了氧气自生成(O2)、一氧化碳(CO)和一氧化氮(NO)生物材料系统。
光响应材料的局限性包括对革兰氏阴性菌的抗菌活性低、成本高,以及当组织与特定类型的光源(即亚甲基蓝)接触时牙齿染色/变色。此外,PS浸渍牙本质导致粘结强度降低,在某些情况下,治疗过程中温度过高会导致组织创伤和损伤。应用aPDT后细胞活力的降低需要进一步研究。
电刺激:多年来,人们一直在研究电荷(即电流)对微生物生物膜的影响,将其作为化学疗法的替代方案,而不会导致抗生素耐药性,或作为提高传统疗法有效性的辅助疗法。这种方法的优点是高度的空间覆盖和时间可控性、快速的行动和最小的入侵。电荷摧毁病原体的能力不仅取决于细菌菌株,还取决于电荷的大小、密度和极性。针对口腔病原体,电荷已显示出对牙龈卟啉单胞菌、变形链球菌、粪便大肠杆菌、白色念珠菌等的抗菌反应。通常情况下,低电流水平<30 mA持续不到30分钟。
Montoya等人对生物活性材料进行了评估。提出了几种机制来解释电荷的杀伤能力。这些机制包括直接接触理论,其中电流通过破坏细胞膜的完整性直接导致细菌死亡。间接杀伤理论通过活性有毒物质(即ROS、活性氮物种(RNS))的产生、pH和温度变化以及电流来解释。然而,高浓度的ROS会影响一般的炎症信号传导和/或诱导细菌突变,使其对治疗不太敏感。他们提出了几种机制来解释电荷的杀伤能力。这些机制包括直接接触理论,其中电流通过破坏细胞膜的完整性直接导致细菌死亡。间接杀伤理论通过活性有毒物质(即ROS、活性氮物种(RNS))的产生、pH和温度变化以及电流来解释。然而,高浓度的ROS会影响一般的炎症信号传导和/或诱导细菌突变,使其对治疗不太敏感。
磁响应:静态和脉冲磁场在临床上用于治疗骨折和促进骨形成。在牙科领域,磁响应NP已被用于治疗感染和超敏反应、提高结合强度、靶向药物递送、组织工程和龋齿风险评估。在抗菌应用中,磁性NP主要用于将抗菌剂定位或移动到更靠近感染部位的位置。这在牙科中非常有吸引力,因为感染部位通常位于组织深处,无法治疗。
最近的工作将用于aPDT的PS和用于定位PS的磁性NP结合起来,开发了一种多功能材料,该材料对牙周炎相关病原体具有较强的抗生物膜活性,具有可接受的生物相容性、实时监测和磁性靶向能力。磁反应有助于将PS定位在牙周袋的深处,以有效去除病原体。
使用磁性NP时存在一些局限性,包括凝聚的趋势、毒性水平、对长期稳定性的担忧以及使用单个磁体时定位的方向性有限。
咀嚼/振动响应:口腔环境可以通过咀嚼从日常生物力学运动中提供的力中受益匪浅,从而实现抗菌治疗。
压电材料产生电荷以响应力。最近,研究表明,这些电荷能够对口腔病原体进行抗菌治疗。例如,将压电NP(即钛酸钡-BaTiO3)添加到牙科复合材料和义齿中,仅当材料受到机械刺激(电荷产生)时,才显示出对变形链球菌和白色念珠菌生物膜的抗菌反应。压电电荷的抗菌机制可以通过细胞产生的细胞内ROS水平增加来解释,这表明氧化应激。需要对牙科复合材料和义齿周围的压电电荷分布进行额外的研究,以确保均匀的抗菌效果。此外,关于病原体选择性和极化方向(正方向与负方向)的影响的问题仍需回答。
其他刺激:其他不同类型的刺激也被提出,但探索和研究较少。葡萄糖响应生物材料系统已经被开发用于牙科应用。例如,壳聚糖葡萄糖响应性水凝胶可以使用预先设计的pH响应性水凝胶上的固定化葡萄糖氧化酶(GOx)来检测葡萄糖水平。这是因为固定化GOx可以根据感测到的葡萄糖水平将环境葡萄糖氧化为葡萄糖酸。水凝胶释放控制剂量的甲硝唑,作为对抗牙龈卟啉单胞菌的抗菌疗法。另一种方法是使用葡萄糖敏感的抗菌抗炎壳聚糖水凝胶膜,控制单宁酸的释放。添加单宁酸增加了薄膜的机械性能,并证明了具有足够的生物相容性,可以抑制亚硝酸盐、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)的抗炎作用。
声动力疗法(SDT)是一种新兴的根除肿瘤和感染的方法。超声暴露后,声敏剂(类似于PS)产生ROS以消灭细菌。SDT的优点包括深入组织,产生空化以增强声敏剂对生物膜的渗透性,无侵入性,时空选择性高,无细菌耐药性。
3.3.自主抗微生物疗法
自主生物材料可以感知、响应不同的疗法,并适应不同形式的刺激。它们的自然反馈允许生物材料与生物系统完全集成。例如,水凝胶可以被编程为基于其本地环境专门提供的输入来执行复杂的计算。不同专业领域(如控制理论、计算机科学、材料科学、医学)的融合使得新一代自主材料的开发成为可能。最近,微/纳米机器人的发展已被用作治疗感染的手段。在医学和牙科中使用微型/纳米机器人为疾病治疗提供了一种新的未来替代方案。
微型/纳米机器人是微型和纳米级的机器,可以通过自主或外部动力推进来执行多种特定任务,如传感、诊断、输送和解毒。微型/纳米机器人已成功用于药物靶向递送、诊断、成像和癌症检测。微型/纳米机器人的设计重点是模仿细菌或细胞等生物的行为。与其他智能系统相比,微/纳米机器人具有多种优势,例如实时传递信息以进行正确诊断和治疗的可能性、功能元件(即抗菌剂、生长因子)的封装、非侵入性干预和减少副作用。作为抗菌治疗,微/纳米机器人可以在特定位置输送抗菌剂,提供靶向治疗,并增强抗菌剂对靶向部位或生物膜的渗透,因此有望成为传统抗菌治疗的一种有吸引力的替代品。然而,微型/纳米机器人在牙科领域的应用仅限于一些概念验证。
已经开发出了自驱动和外部供电的微型/纳米机器人来根除牙齿生物膜。自驱动微型/纳米机器人通过将H2O2分解为O2和HO2来使用化学燃料,这是纳米机器人气泡推进的来源。其他微/纳米机器人由外部物理力提供动力,如磁场和电场或超声波。
在最近的一项后续研究中,该团队创建了一个名为STARS的磁场导向纳米机器人,用于去除和杀死细菌生物膜,并对致病生物膜进行诊断采样[335]。STARS是用Fe3O4纳米粒子(IONP)制造的,这些纳米粒子在磁场下动态组装形成磁刷毛。在磁场的引导下,刷毛可以改变其形状、长度和硬度,以去除生物膜,而IONP的催化反应产生ROS作为抗菌机制。最后,改变刷毛的长度可以去除生物膜进行外部诊断。利用变形链球菌和白色念珠菌生物膜生长在与釉质具有类似形态性能的材料上,验证了这一概念。采集生物膜样本后,在刷毛内发现了细菌、真菌和EPS的痕迹。
催化NP对pH和温度等环境变化的敏感性使该技术难以转化为临床应用。需要进行更多的研究来开发涂层,以提高NP的稳定性,在生物介质中提供长的循环时间,并控制纳米/微珠的运动。
4.展望未来工作
过去20年见证了抗菌牙科材料的变革性发展。该领域正在从提供“被动”治疗转向由不同的内部和外部刺激触发的“智能”抗菌生物材料,以提供“按需”治疗,改善对剂量、位置、持续时间和疗效的控制。大多数当代抗微生物生物材料系统都是在生物反应或刺激反应方法中发现的,使用一种刺激来触发效果。即将出现的技术旨在通过提供多种抗菌/抗菌膜效果来提高抗菌效果和持续时间。此外,这些生物反应性抗菌系统的新方法正在被设计用于执行额外的生物功能,包括组织再生、再矿化和抗炎。
这些多功能生物材料可以结合多种能力,并对口腔中的多种刺激做出反应,从而产生协同效应。例如,在牙科领域,具有抗菌和再矿化能力的牙科树脂粘合剂可用于杀死病原体并在结合界面再生组织。该系统可以降低继发性龋齿的发生率,并延长修复体的耐久性。大多数多功能牙科材料是通过混合多种试剂制成的,每种试剂都有一种特定的功能。这种设计方法可能会增加配方的复杂性,并且难以调节应用的物理性能。多功能生物材料的其他挑战是在适当的时间安排特定治疗的递送(例如,首先是抗菌,然后是再生),并防止ROS的过度产生,ROS会导致组织损伤、引发炎症反应和细胞损伤。体外测试多种功能具有挑战性,因为传统上,每种效果都是单独测试的,这可能会阻碍体内的潜在效果。
微生物和生物材料之间的相互作用具有显著的复杂性。了解微生物与生物材料表面相互作用的机制对于控制粘附和生物膜的形成至关重要,尤其是对于智能抗菌生物材料系统,其中需要额外的相互作用来防止感染。有许多广泛接受的标准化方法来评估牙科材料的财产(物理、机械、生物相容性)。然而,对生物膜-牙齿材料的相互作用进行评估尚未达成共识。事实上,国际标准化组织(ISO)目前正在制定一项标准(ISO 3990),用于测试牙科修复材料的抗菌性能。本标准规定了样品制备、菌株选择、体外试验方法和评估以及报告结果的基本要求。这些标准化的方法将使我们能够有效地比较研究之间的结果,防止可疑的结论,并为抗菌技术的临床疗效提供可靠的预测因素。此外,由于人类病理学的可接受表现(即相似的解剖结构、愈合过程和免疫反应)、建立为动物提供相同遗传背景的谱系的可能性以及对复杂相互作用(即遗传/环境因素)的研究,已经使用了模拟口腔生物膜形成和发育的体内模型。然而,专门研究生物材料和生物膜之间相互作用的体内模型有限,这阻碍了研究结果的比较。指导这一领域的工作可以促进技术向临床的转化,减少用于体内评估的动物数量,最大限度地降低体内临床前研究的成本,并促进器官芯片技术的发展。
5. 结论
综上所述,这篇文章介绍了用于抗菌应用的不同生物活性、生物响应(或刺激响应)和自主牙科材料的最新进展。第一节描述了牙科材料中不同水平的智能,以澄清对这些生物材料用于提供效果的策略的潜在误解。第二节简要介绍了不同的生物活性抗菌技术,提供了各种实例和抗菌机制。第三节描述了这些智能牙科材料用于提供抗菌效果的不同外部和内部刺激。文章描述了对pH水平、酶、磁、电和振动做出反应以产生抗菌效果的系统。还介绍了自主微型机器人,展示了这种破坏性的方法如何提供抗菌治疗。在展望部分描述了多功能牙科材料和治疗剂如何为新的研究和概念开辟道路。
原文信息:Carolina Montoya, Lina Roldan, Michelle Yu, Sara Valliani, Christina Ta, Maobin Yang, Santiago Orrego.
Smart dental materials for antimicrobial applications.
Bioactive Materials, 24 (2023) 1-19.