动物源性人工心脏瓣膜(外科瓣)生产环节风险清单和检查指南
本指南旨在指导和规范动物源性人工心脏瓣膜(外科瓣)产品的现场核查工作,帮助医疗器械检查员把握该类产品风险及核查要求,统一核查尺度,同时也为注册申请人建立及运行质量管理体系的工作提供参考。
本指南在《医疗器械生产质量管理规范》及无菌和植入附录的基础上,参考动物源性医疗器械监管要求和相关国家标准和行业标准,对动物源性人工心脏瓣膜开展现场检查提出指导性要求,旨在识别和关注该类产品实现过程中的风险点和要点,供检查员及注册申请人参考使用,帮助有关人员系统梳理该类产品生产控制过程中的风险要点,不作为法规强制执行。注册申请人应依据申报产品的具体特点,遵循相关法规要求建立质量管理体系并保持有效运行。本指南是在现行法规和标准体系以及当前科技认知水平和现有产品技术基础上形成的,随着法规和标准的不断完善、科学技术的不断发展,相关人员参考时应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。随着对产品理解的不断深入,本指南相关内容也将适时进行调整。
一、动物源性人工心脏瓣膜产品和生产信息
(一) 产品简介
1. 概述
动物源性人工心脏瓣膜是可植入人体心脏内替代心脏瓣膜,能使血液单向流动不发生返流,具有天然心脏瓣膜功能的医疗器械。通过设计不同的缝环形状来适应临床上的不同瓣环位置的解剖形状,瓣膜可以区分为两大类:主动脉瓣和二尖瓣,其形式如图 1、图 2 所示:
2. 结构组成
动物源性人工心脏瓣膜是一种带支架的生物假体,通常以牛心包或猪主动脉瓣为瓣叶原材料,经前期处理、化学交联处理、激光切割/剪裁后被缝制在涤纶布包裹的合金支架上,主要用于置换体内病变的瓣膜。主要由四部分组成:瓣架、瓣叶、瓣座和缝环,用缝线连接固定。最终产品经戊二醛灭菌后被保存在该溶液中。
瓣架是一种由具有耐腐蚀性的钴-铬-锰-铁合金制成,被聚酯织物包裹,能提供优异的弹性和疲劳耐久性。
瓣叶是由牛心包组织或猪主动脉瓣经戊二醛交联后再由激光切割整形而得。瓣座是瓣架及连接缝环的支撑结构,由 PET 薄膜内外衬衣及钴-铬-锰-铁合金组成,被涤纶布包裹。缝环是由被涤纶布包裹的衬环,布的表面有 3 道黑色标记用于临床植入时的定位。持瓣器的设计用于外科医生植入瓣膜和观察瓣叶的打开和关闭。瓣膜假体通过缝合固定在瓣膜持瓣器上,而瓣膜持瓣器固定在由盖板和套筒组成的瓣膜保护装置上。
3. 预期用途
动物源性人工心脏瓣膜假体旨在用于患有瓣膜性心脏病的患者,并且不能通过原瓣膜修复技术愈合,而只是更换。它仅供医疗机构用于患心脏瓣膜病的临床瓣膜置换手术。
3.1 适用于心脏瓣膜病(主动脉瓣或二尖瓣)心脏患者。包括心脏瓣膜障碍或狭窄、瓣膜泄漏、返流、关闭不全、或功能性不全或两者兼有,有时也被称为混合性疾病或合并病变。3.2 适用于先天性畸形、各类微生物感染、退行性钙化、风湿性心脏病所致的瓣膜疾病,尤其是对长期抗凝治疗有禁忌或难以维持抗凝治疗的患者。
3.3 适用于无法通过修复得到治愈的瓣膜疾病患者,并且适宜采用假体瓣膜替换自体瓣膜的瓣膜疾病患者;或者已经植入过人工心脏瓣膜的但其性能已经衰败需要更换瓣膜的患者。在后一种情况下,先前植入的假体通过外科手术切除并由替换假体代替。瓣膜可以进行瓣环上或瓣环内植入。
4. 规格型号
在对临床应用现状进行调查后,心脏瓣膜假体可分为两个型号:主动脉瓣假体和二尖瓣假体,分别在支架直径、缝环外径、高度等指标存在尺寸差异。 其规格尺寸应具体参照各企业的产品技术要求。5. 产品性能
动物源性人工心脏瓣膜假体通过同时打开和关闭三片瓣叶,使血液从心房向心室、动脉单向流动而不发生返流。
产品的物理和化学性能应符合 GB 12279-2008 《心血管植入物 – 人工心脏瓣膜》(ENISO5840:1996)中规定的要求。
产品的生物学性能符合 GB/T 16886.1 《医疗器械生物学评价 第 1 部分:风险管理过程中的评价与试
验》 中规定,例如体外细胞毒性试验、致敏性、皮内刺激、急性系统毒性、亚慢性毒性、遗传毒性、植入试验、血液相容性、热原等。具体要求应参照各企业产品技术要求。
(二)参考文献
GB 12279 心血管植入物 人工心脏瓣膜
GB 18278 医疗保健产品的灭菌 确认和常规控制要求 工业湿热灭菌
GB 18279 医疗器械 环氧乙烷灭菌 确认和常规控制
GB 18280 医疗保健产品的灭菌 确认和常规控制要求 辐射灭菌
GB 8369 一次性使用输血器
GB 19335 一次性使用血路产品通用技术条件
GB/T 19633 最终灭菌医疗器械的包装》
GB/T16886.1 医疗器械生物学评价 第 1 部分:评价与试验
GB/T16886.3 医疗器械生物学评价 第 6 部分:遗传毒性、致癌性和生殖毒性试验GB/T16886.4 医疗器械生物学评价 第 10 部分:与血液相互作用试验选择
GB/T16886.5 医疗器械生物学评价 第 5 部分:体外细胞毒性试验
GB/T16886.6 医疗器械生物学评价 第 6 部分:植入后局部反应试验
GB/T16886.10 医疗器械生物学评价 第 10 部分:刺激与致敏性试验
GB/T16886.11 医疗器械生物学评价 第 11 部分:全身毒性试验
GB/T14233.1 医用输液、输血、注射器局检验方法第 1 部分:化学分析法
GB/T14233.2 医用输液、输血、注射器局检验方法第 2 部分:生物学试验方法GB/T19633-1 最终灭菌医疗器械包装 第 1 部分:材料、无菌屏障系统和包装系统的要求GB/T19633.2 最终灭菌医疗器械包装 第 2 部分:成形、密封盒装配过程的确认的要求GB/T 2828.1 计数抽样检验程序第 1 部分:按接收质量限(AQL)检索的逐批检验抽样计划GB/T 2829 周期检查技术抽样程序及表(适用于过程稳定性的检查)
GB/T 9969 工业产品使用说明书总则
YY 0970 含动物源材料的一次性使用医疗器械的灭菌液体灭菌剂灭菌的确认与常规控制YY 0167 非吸收性外科缝线
YY 0605.7 外科植入物金属材料第 7 部分可锻和冷加工的钴铬镍钼铁合金
YY/T 0771.1《动物源医疗器械 第 1 部分:风险管理应用》
YY/T 0771.2《动物源医疗器械 第 2 部分:来源、收集与处置的控制》
YY/T 0771.3《动物源医疗器械 第 3 部分:病毒和传播性海绵状脑病(TSE)因子去除与灭活的确认》YY/T 0771.4《动物源医疗器械 第 4 部分:TSE 因子去除与灭活原则及其验证试验》YY/T 0606.17 组织工程医疗产品:外源因子评价指南
YY/T0606.16 组织工程医疗产品:保存指南[S]
YY/T 0567 医疗产品的无菌加工
YY/T 0316 (GB/T 42062) 医疗器械 风险管理对医疗器械的应用
YY/T 0313 医用高分子制品包装、标签、运输和贮存
YY/T 0287 (GB/T 42061) 医疗器械 质量管理体系用于法规的要求
YY/T 0033 无菌医疗器具生产管理规范
YY/T 0606.25《组织工程医疗产品 第 25 部分:动物源性生物材料 DNA 残留量测定法:荧光染色法》中华人民共和国药典(2020 版第四部)
国药监注[2002]160 号 关于印发《血液制品去除/灭活病毒技术方法及验证指导原则》的通知食品药品监管总局关于发布动物源性医疗器械注册技术审查指导原则(2017 年修订版)的通告(2017年第 224 号)
ISO 22442《医疗器械生产用动物组织及其衍生物》
ENISO14971 Medical devices – Application of risk management to medical devices
ENISO5840-2 Cardiovascular implants-cardiac valve prostheses Part 2 Surgically implantedheartvalve substitutes
ENISO10993.1 Biological evaluation of medical devices – Part 1: Evaluation and testingwithina risk management process
ENISO22442-1 Medial device utilizing animal tissues and their derivatives-Part1: Applicationof risk management
ENISO22442-2 Medial device utilizing animal tissues and their derivatives-Part2: Controlsonsourcing, collection and handling
ENISO22442-3 Medial device utilizing animal tissues and their derivatives-Part3: Validationofthe elimination and /or inactivation of viruses and transmissible spongiform encephalopathy(TSE)agents
ENISO11607-1 Packaging for terminally sterilized medical devices – Part 1: Requirementsformaterial, sterile barrier systems and packaging systems
ENISO11607-2 Packaging for terminally sterilized medical devices – Part2: Validationrequirements for forming, sealing and assembly processes
Council Directive 93/42/EEC
Directive 2007/47/EC
(三)生产信息
1.工艺流程示例(以应用较为普遍的牛心包为示例)1.1 瓣膜主体:牛心包成形处理、瓣叶制作、合金丝制作、涤纶包布制作、瓣架缝制;1.2 带环支架:缝环制作、瓣座缝制、带环支架缝制;
1.3 组装:带环支架、瓣膜主体、瓣膜包布组合形成;
1.4 初包装、灭菌
2. 关键原材料(以应用较为普遍的牛心包为例,各企业可能存在差异)2.1 瓣膜:建议采用非疫源地来源的低龄牛的心包,如果是新鲜牛心包,应在储存液中应严格控制在0-10℃,从取材到运抵备用不应超过 72 小时;如果是已交联合格的牛心包取材后应在抑菌液中储存运输,无热缺血时效性限制。如果选用猪主动脉瓣应取自成年猪的新鲜瓣膜,热缺血时间则应不超过2 小时。原材料应具有可追溯性。应能提供牛饲养人/场、屠宰场、牛心包供应商、瓣膜生产企业等相关信息(例如但不限于:出口国卖方声明、动物屠宰记录、牛心包材料符合性声明、牛心包产地证明、动物检疫证明、原材料进货检验记录等。
2.2 合金丝:较常用 Elgiloy 合金
2.3 包布:较常用涤纶布
2.4 缝线:较常用非吸收外科缝线
2.5 内衬:较常用聚对苯二甲酸乙二醇酯(PET)
2.6 交联剂:较常用戊二醛溶液
2.7 灭菌:较常用戊二醛液体灭菌
3.关键过程和特殊过程(以应用较为普遍的牛心包为示例)3.1 关键过程:瓣膜成型、瓣架缝制、半成品缝制作
3.2 特殊过程:交联处理、瓣叶灭活、清洗、初包装、灭菌
4.质量控制点(以应用较为普遍的牛心包为示例)4.1 缝合质量:按过程检验规程执行
4.2 流量测试:按产品技术要求执行
4.3 成品检验:按逐批检验规程执行
二、动物源性人工心脏瓣膜风风险管理示例(以应用较为普遍的牛心包人工心脏瓣膜为例)
1.确立风险可接受标准
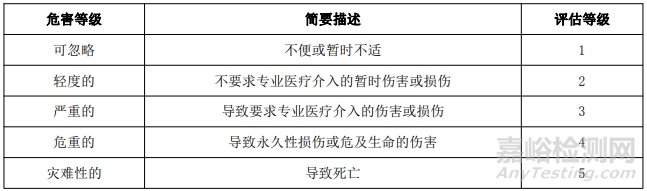
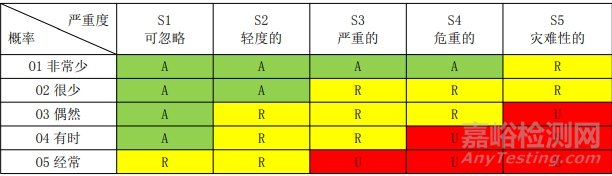
为风险管理制定的风险可接受标准如下所示。 用半定量分析法计算损害概率,用定性分析法分析损害的严重程度。风险可接受性标准用 5×5 矩阵图表示。
1.1 损害的概率分级
1.2 损害的严重度水平
1.3 风险可接受标准
说明:A:可接受的风险;R:研究进一步降低风险;U:不可接受的风险
1.4 风险可接受标准系数值分析
根据上述风险可接受标准所构成的风险评价矩阵图,确定风险可接受区域。 风险系数RPN:RPN = 概率×严重程度
可接受区A:RPN≤4,该区域内,风险是可以接受的。
进一步降低风险区R:4<RPN≤14 该区域内的风险既不是可忽略的也不是不可接受的,应尽可能地消除或降低风险。
注:此风险降低概念不应包含经济考虑因素。
不可接受的区域“U”:RPN> 14 该区域内,风险如果不能予以降低,则判断为是不可接受的
1.5 初始危害分析
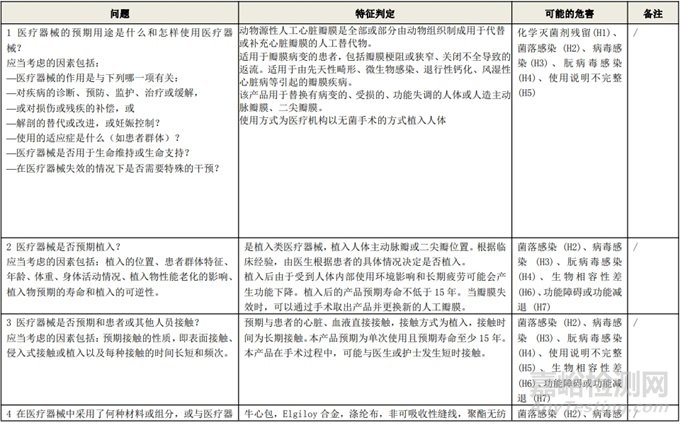
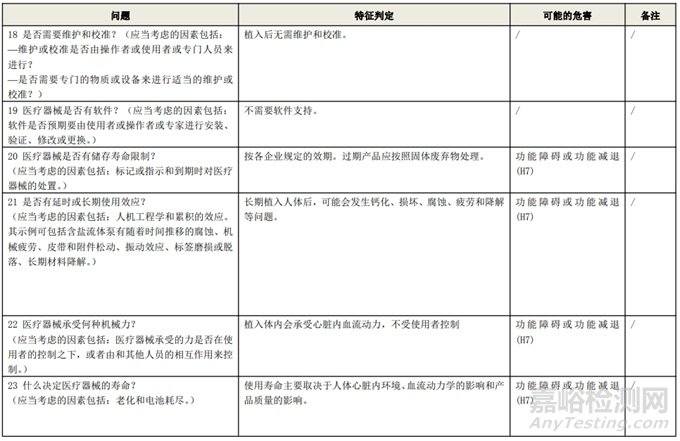
根据风险管理计划和YY/T 0316-2016 《医疗器械 风险管理对医疗器械的应用》(ENISO14971-2012)附录C对预期用途和安全相关特征进行了评估,详见附表1《动物源性人工心脏瓣膜安全性特征清单》(以应用较为普遍的牛心包材料制成品为示例)所示。
通过填写安全特征检查清单,对动物源性人工心脏瓣膜的安全特征有了初步的了解,并识别出了初始的危害共计12个,如下表所示,并分别对这些危害进行了风险分析,详见附表2《牛心包人工心脏瓣膜初始危害分析表(示例)》(以应用较为普遍的牛心包材料制成品为示例)。
2.风险控制措施
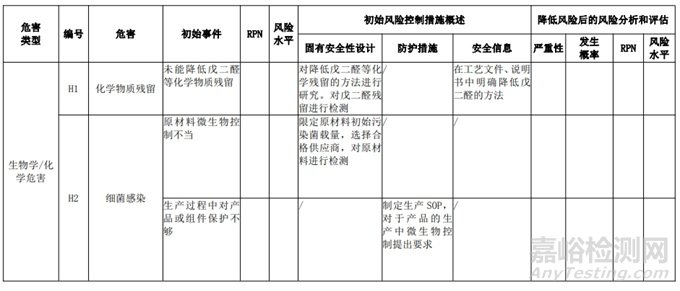
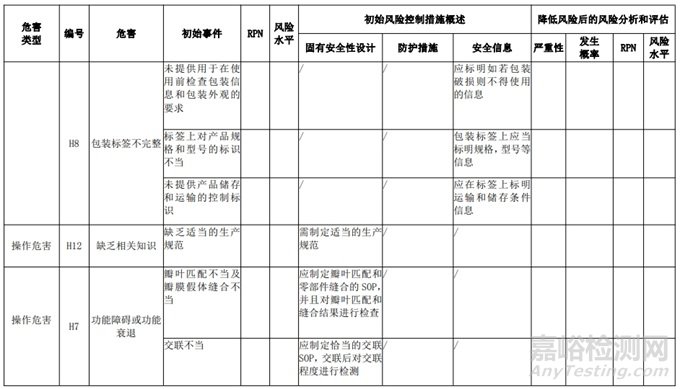
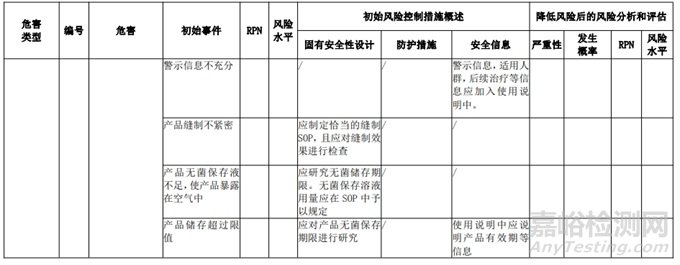
经过对以上危害的风险分析,对不同的风险在产品实现全过程中采取了不同的控制措施,经验证有效,风险可控制在可接受范围,详见附表 3《动物源性人工心脏瓣膜风险评价、风险控制措施表(示例)》(以应用较为普遍的牛心包材料制成品为示例)
三、动物源性心脏瓣膜生产环节风险清单和检查指南
附表 1:动物源性人工心脏瓣膜安全性特征清单(示例)(以应用较为普遍的牛心包材料制成品为示例)
附表 2 动物源性人工心脏瓣膜初始危害分析表(简要示例)(以应用较为普遍的牛心包材料制成品为示例)
表 3 动物源性人工心脏瓣膜风险评价、风险控制措施表(简要示例)(以应用较为普遍的牛心包材料制成品为示例