您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-13 08:38
2024年4月23日,美国食品药品监督管理局(FDA)批准Day One Biopharmaceuticals公司领衔研发的新分子实体药物Ojemda(有效成分:Tovorafenib)上市,适用于年龄在6个月及以上携带BRAF融合/重排或BRAF V600突变的复发性或难治性儿童低级别神经胶质瘤(pLGG)患者。这是首个获批用于BRAF融合/重排儿童低级别胶质瘤适应症的II型RAF抑制剂。Tovorafenib 被FDA授予“突破性疗法”和“罕见儿科疾病”称号,并通过了FDA的优先审查评估。
图1:Ojemda包装
儿童低级别胶质瘤概况及发病机制
脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,我国脑胶质瘤年发病率为5~8/10万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌。根据病理学特点,世界卫生组织将胶质瘤分为I-IV级,其中I-II级为低级别胶质瘤(low-grade gliomas,LGGs),III-IV 级为高级别胶质瘤(high-grade gliomas,HGGs)。
儿童中枢神经系统处在生长发育期,任何的外界因素的干扰,或者是先天因素不全,都有可能导致儿童患中枢神经系统(CNS)肿瘤,这是一种在儿童中非常常见的肿瘤,也是发病率第一位的儿童实体瘤,同时也是儿童癌症相关死亡的首要原因。在儿童中枢神经系统肿瘤中,约有2/3都是脑胶质瘤,其中儿童低级别胶质瘤最常见。
儿童低级别胶质瘤(pLGG)是儿童中枢神经系统肿瘤中常见的一种类型,大约占儿童中枢神经系统肿瘤的30%-50%,好发于5-9岁的儿童,会对儿童及其家庭造成严重破坏,往往会夺走他们的视力、平衡和语言能力。其常见的病理类型包括毛细胞型星形细胞瘤(WHO分级I级)和弥漫型纤维性星形细胞瘤(WHO分级II级)。目前的研究表明,pLGG的病理机制主要涉及丝裂原活化蛋白激酶(MAPK)信号通路上的关键基因变异。
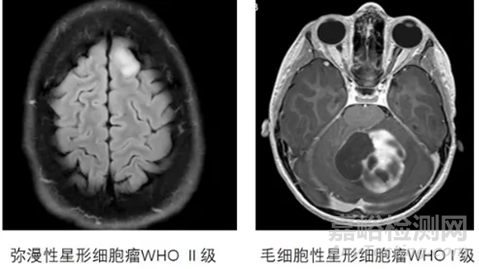
图2:儿童低级别胶质瘤病理类型
MAPK级联是调控细胞存活、增殖和分化的关键信号通路。MAPK信号通路有4条主要的分支路线,其中一条即RAS-RAF-MEK-ERK信号通路(MAPK/ERK通路),BRAF基因是这条通路的一部分,负责编码一个传递细胞信号的RAF激酶蛋白。BRAF V600E突变、BRAF融合、BRAF重排都会导致MAPK信号通路持续性激活,驱动肿瘤发生,因此开发新型RAF抑制剂可以有效降低MAPK通路信号转导,减缓肿瘤进展。
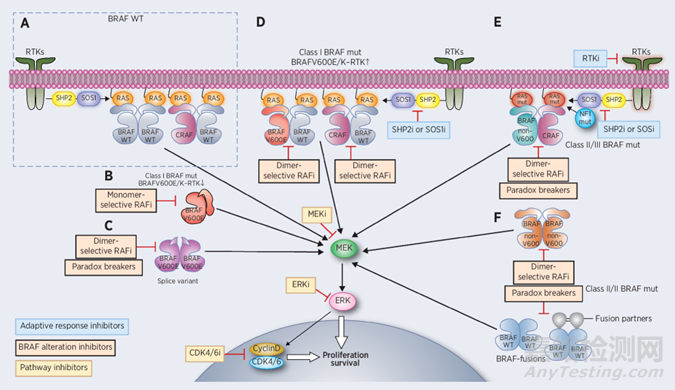
图3:RAS/RAF/MEK/ERK信号通路的调控机制
Ojemda作用机制和治疗优势
针对以上病理机制,FDA首先于2023年3月16日批准了Dabrafenib联合Trametinib用于1岁及以上患有BRAF V600E突变且需要全身治疗的儿童低级别胶质瘤(pLGG)儿科患者,这是首个获批用于BRAF V600E突变儿童低级别胶质瘤适应症的一线治疗方案。然而,这种I型BRAF抑制剂--无论是单独使用还是与MEK抑制剂联用,都不适用于治疗携带BRAF融合的肿瘤患者。
在此之前,由BRAF融合/重排导致的pLGG患者还没有获FDA批准的药物。Ojemda是首个也是唯一一个经FDA批准用于治疗BRAF融合或重排pLGG的药物。Ojemda是一种高度选择性的II型RAF激酶抑制剂,可抑制携带BRAF融合/重排或BRAF V600突变的肿瘤的生长,这是一种新的靶向治疗方案。
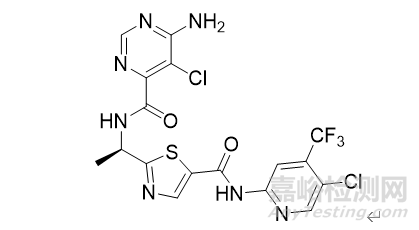
图4:Ojemda结构式
Ojemda获批依据
FDA加速批准Ojemda上市是基于一项关键性开放标签II期FIREFLY-1(NCT04775485)临床试验数据,该实验旨在评估Ojemda单药治疗RAF改变、复发/难治性pLGG或晚期实体瘤儿童、青少年和成人患者的安全性和有效性。该试验共招募了137名复发或难治性BRAF改变的pLGG患者,分为两个研究臂。试验臂1共招募了77名患者,用于Ojemda有效性分析。试验臂2从新增的60例患者中评估Ojemda的安全性数据。主要疗效指标为总反应率(ORR)——根据小儿神经肿瘤低级别胶质瘤反应评估(RAPNO LGG)进行独立审查,得出完全反应(CR)、部分反应(PR)或轻微反应(MR)的患者比例。
结果显示,77名患者的最佳ORR为51%(95%CI:40-63),其中包括28%的PR和11%的MR。在64例BRAF融合或重排患者中,OJEMDA的ORR为52%,在12例BRAF V600突变患者中,OJEMDA的ORR为50%。45名既往接受过MAPK靶向治疗的患者的ORR为49%,31名既往未接受过MAPK靶向治疗的患者的ORR为55%。对137例复发或难治性pLGG患者进行了OJEMDA安全性评估,大多数不良反应为1级或2级。以上试验结果表明OJEMDA具有良好的安全性和有效性。
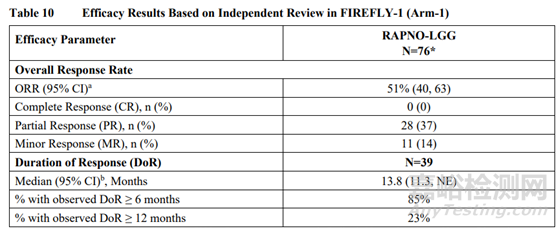
图5:Ojemda临床试验结果
Ojemda重要临床研究
本次FDA的批准是基于Ojemda一项关键II期临床研究中表现出的积极结果(NCT04775485),这项临床研究评估了Tovorafenib在RAF改变、复发或进行性低级别胶质瘤和晚期实体瘤儿童患者中的安全性和有效性,此外在世界范围内Ojemda开展十几项临床研究,充分评估了其药效学、药代动力学、安全性、有效性、耐受性、药物联合应用等,以下归纳了部分Ojemda重要的临床研究。
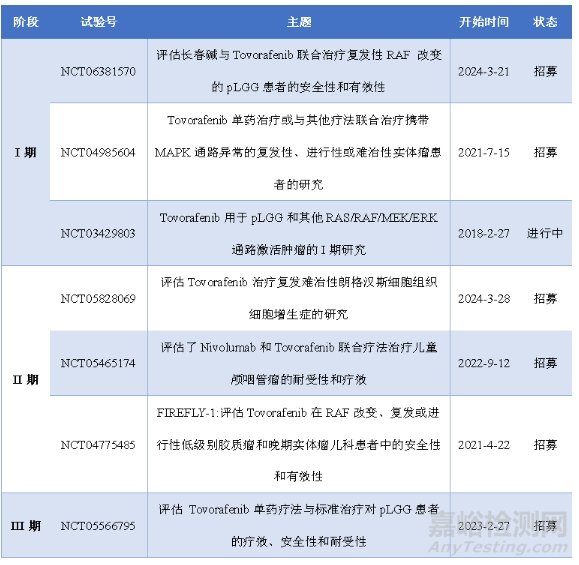
图6:Ojemda重要的临床研究
总结
Ojemda是首个也是唯一一个经FDA批准用于治疗BRAF融合或重排pLGG的II型RAF抑制剂,这种新的靶向治疗方案为患有复发或难治性pLGG的儿童带来希望,每周口服一次的使用方式使得Ojemda具有很好的患者适应性和依从性。“对于患有pLGG的儿童和家庭来说,这是一个激动人心的时刻,如果病情恶化,他们以前几乎没有治疗选择。”儿童脑肿瘤基金会总裁Courtney Davies 在说,“Ojemda的获批可以满足那些日常生活和长期健康状况受到pLGG严重影响的儿童。新的治疗方案能为患儿及其家庭带来潜在的益处,这一点至关重要。这里有太多值得庆祝的事情。”
参考资料:
[1]FDA官网:https://www.fda.gov/
[2]Day One Biopharmaceuticals官网:https://www.dayonebio.com/
[3]Kilburn, L.B., Khuong-Quang, DA., Hansford, J.R. et al. The type II RAF inhibitor tovorafenib in relapsed/refractory pediatric low-grade glioma: the phase 2 FIREFLY-1 trial. Nat Med 30, 207–217 (2024).
[4]Poulikakos PI, Sullivan RJ. Molecular Pathways and Mechanisms of BRAF in Cancer Therapy. Clin Cancer Res. 2022;28(21):4618-4628.

来源:药事纵横


