您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-26 13:56
介绍
血流导向技术是治疗脑血管动脉瘤的一个重要里程碑。血流导向装置(FD)最初仅适用于某些难以治疗的特殊形态的动脉瘤。然而,临床研究已经扩大了适应证,许多中心也大幅增加了"超适应证"的使用。血流导向需要大面积金属覆盖表面才能有效,因此FD具有血栓形成倾向,会导致缺血并发症,需要双联抗血小板治疗(DAPT)。即使在有效DAPT下,缺血事件仍是FD治疗后并发症的主要类型。抑制血小板功能增加了严重出血的风险,但并不总能预防血栓栓塞并发症。如果能开发一种在单抗血小板治疗(SAPT)下仍然安全有效的FD,尤其是仅使用阿司匹林,将具有重要的临床价值。虽然已经考虑了多种解决方案,包括使用生物可吸收材料制造支架,但FD表面改性仍是减少血栓栓塞性缺血并发症和避免植入后DAPT的一种有吸引力的策略。
之前一些潜在的表面改性方法在冠状动脉支架中已经显示了良好的安全性特征,但疗效存在差异。随着药物洗脱支架(特别是西罗莫司)在降低再狭窄方面展现出较好疗效,人们对表面改性的兴趣逐渐减弱。尽管围绕这些冠状动脉应用的表面改性方法已有大量文献,但要将这些概念应用于血流导向装置(FD)仍需进一步研究。冠状动脉粥样硬化性疾病,其暴露的斑块成分本身是血栓形成的,治疗不同于治疗神经血管的动脉瘤性疾病。此外,冠状动脉循环是由较大血管中舒张期血流推动的,剪切应力相对较低,而神经血管系统是由收缩期血流驱动的。虽然支架血栓形成在两个部位都会产生灾难性后果,但需要考虑的因素是不同的。在血流导向后,在被覆盖的分支和穿支血管处形成的微小血栓是一个特殊关注点,而支架再狭窄则是冠状动脉介入后更为棘手的问题。最后,两种器官的重要性不同,神经血管循环的容错性要远低于冠状动脉。这些差异以及冠状动脉支架和FD在设计上的差异,都表明需要进一步研究FD的表面改性。
从概念上讲,有几种不同的方法可以减少DAPT相关并发症(图1,表1),但这些策略同时也能减少血栓栓塞并发症。直接降低器械的血栓形成倾向,从而减少或消除全身性治疗的需求,这是最直观的方法。另一种策略是促进快速装置表面内皮化,因为正常内皮是最好的抗血栓涂层。这种方法虽然可能不会完全消除DAPT的需求,但可以显著减少治疗时间。这两种方法在某种程度上是矛盾的。
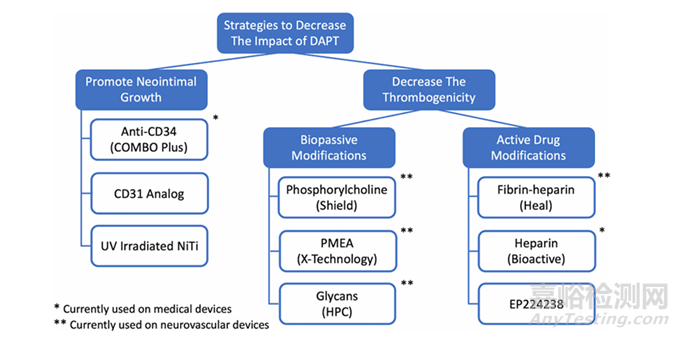
图1:显示了通过各种表面修饰来减少或消除双重抗血小板治疗(DAPT)的方法
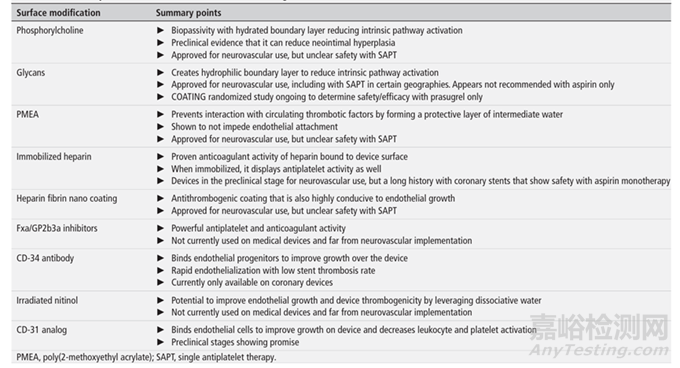
表1:不同表面修饰/涂层用于血流导向装置和颅内支架的总结
预防血小板附着的涂层可能也会延缓内皮化,而设计用于改善内皮细胞生长和粘附的涂层可能同样吸引血小板粘附和激活,从而可能增加血栓形成的风险。目前,只有p48和p64器械带有亲水性聚合物涂层(HPC;Phenox,德国波鸿)在某些地区DAPT禁忌时附有SAPT使用说明;然而,还有几种不同的表面改性旨在实现类似的目标。本综述将重点关注目前可用的表面改性支架,在转化阶段显示出巨大潜力的概念以及支持其设计和使用的一些研究。
表面修饰
生物被动涂层
当暴露于循环系统中时,诸如支架等裸金属器械的表面会被蛋白质覆盖,这可能引发不利反应,包括炎症、内源性凝血级联反应的接触激活以及血小板激活。避免这些反应及其相关后果的一种方法是掩蔽器械表面,使其不与循环中的血小板、纤维蛋白原、凝血因子和白细胞等基质发生反应。这可以通过模仿不会引发这些有害过程的天然亲水性循环系统成分,或使用不与之发生相互作用的聚合物来实现。这两种策略都可以降低血栓形成倾向,同时仍允许正常的新内膜生长和增殖。
磷酰胆碱
磷酰胆碱是磷脂酰胆碱头基的一个组成部分,是所有真核细胞膜(包括红细胞膜)的主要成分。磷脂酰胆碱头基不会诱导血小板激活或允许有效粘附。它创造了一个亲水性边界层,阻碍了内源性路径激活所需的蛋白质构象变化。这或许是最早被提出用于血管支架的涂层。它在冠状动脉器械上已有广泛研究;然而,完全不同的脑血管环境需要进一步的研究和考虑。美敦力(Irvine, California, USA)公司利用冠状动脉支架涂层的经验,为其Pipeline和Vantage支架设计了一种磷脂胆碱表面改性(Shield)。这是一种3纳米厚的化学改性表面,由共价连接到器械编织丝上的磷酰胆碱制成。
早期的体外和离体实验表明,与未涂层器械相比,这种表面改性显著降低了凝血酶原的蛋白水解激活和血小板聚集。在血管流动模型中,结果与无器械的对照组大致相同。然而,这些模型系统只测试了血液产品接触激活的内源性路径。需要进行体内建模来研究内源性和外源性路径。最近的兔模型数据显示,即使在未接受DAPT治疗的动物中,Shield涂层器械的血栓形成明显低于未涂层器械,这是通过血管内光学相干断层扫描测量的。值得注意的是,涂层器械还减少了分支血管的血栓形成,这对于植入于远端脑血管的部位来说很重要。该涂层不会对动脉瘤闭塞率产生负面影响,并且与未涂层器械相比,可以减少新内膜增生,并实现更早和更均匀的新内膜生长。在兔模型中,Shield改性不会干扰纵向愈合,这是许多表面改性策略所关注的问题。
鉴于该涂层的功效和抗血栓性已经得到很好的确立,下一步就是评估这种改性是否允许单药抗血小板治疗(SAPT),这对于存在破裂动脉瘤且DAPT存在重大风险的患者来说尤为重要。早期病例报告显示结果存在矛盾,但最近的一些文献结果令人鼓舞。最大规模的多中心回顾性研究报告,使用带有Shield涂层的器械和单药阿司匹林治疗14例破裂动脉瘤的患者,发生缺血和出血并发症较少。需要继续针对更大的患者群体和更标准化的抗血小板方案进行研究,以完全理解这种做法的安全性。监管上的挑战在于找到一种适应症,其风险-收益比对于SAPT是可接受的。ELEVATE试验(临床试验注册号:NCT04391803)将测试对急性破裂浅表硬膜内动脉瘤使用带有Shield技术的支架进行短期DAPT(48小时)的疗效。
聚糖
糖苷是生物系统中无处不在的另一种成分。为了模拟糖萼并减少疏水性相互作用,HPC (Phenox)是一种多层表面,由共价结合p48和p64 FDs的聚糖组成。初步的体外实验显示,基于免疫组织化学,与未涂层的编织丝相比,HPC涂层支架编织丝上的血小板粘附和激活明显较少。考虑到p48器械是为更远端的循环而设计的,因此需要考虑分支血管血栓形成的问题。在一项研究涂层和未涂层器械以及不同抗血小板方案的猪模型中,HPC涂层和全身给予阿司匹林都显著降低了分支血管的血栓形成,两者的组合消除了99.8%的分支血管血栓。
尽管这是目前市场上唯一在某些区域和DAPT禁忌时允许SAPT的表面改性,但文献报告的结果参差不齐。一项针对使用单药阿司匹林治疗远端颅内动脉瘤的前瞻性研究,在治疗8名患者后由于缺血并发症发生率很高而被停止。类似的发现也在治疗破裂动脉瘤的回顾性研究中报告。所有血栓栓塞并发症都发生在单药阿司匹林SAPT下,有证据表明在使用P2Y12抑制剂时,HPC涂层器械可能在SAPT下是安全的。COATING试验(clinicaltrials.gov, NCT04870047)是第一个旨在检验SAPT联合普拉格雷在p64 HPC FDs治疗动脉瘤方面是否与DAPT同样安全有效的随机临床试验。然而,忽略了阿司匹林这种较弱的抗血小板药物,可能会限制SAPT的获益。
聚(丙烯酸2-甲氧基乙酯) (PMEA)
PMEA属于一类合成的柔性生物相容性聚合物家族,包括poly(ethylene glycol),poly(2-ethyl-2- oxazoline),poly(2-methoxyethyl acrylate)等,它们可以干扰与循环蛋白和细胞的正常相互作用。PMEA是一种抗血栓性聚合物,在医疗器械应用评估中已有多年历史,包括体外膜肺氧合机。当任何亲水性聚合物涂层暴露在水溶性环境中时,它会水化形成一层保护层。PMEA吸引中间水分子,这些水分子与PMEA的甲氧基只有很弱的相互作用。当结晶和弱关联时,中间水分子的动力学似乎参与了破坏聚合物与各种蛋白质(如纤维蛋白原和凝血因子XII)之间的相互作用。因此,这些蛋白质不会发生构象改变而被激活,从而启动内源性路径。因此,血小板不太可能被激活或粘附到表面。重要的是,这种涂层似乎不会改变其他结合相互作用,如与内皮细胞和平滑肌细胞的相互作用,因为细胞在细胞粘附分子和表面吸附蛋白之间同时使用多种相互作用。这允许正常的内皮细胞在器械表面生长。
X技术通过共价键将PMEA连接到FRED双层支架(FRED-X; Microvention, Aliso Viejo, California, USA)的所有表面,以赋予其抗血栓性。体外研究显示,通过减少接触激活,FRED-X具有优异的血液相容性。报告的血小板计数、β-血小板球蛋白(β-TG)和凝血酶-抗凝血酶复合物(TAT)水平在Shield和FRED-X器械以及无器械的阴性对照组之间相似。此外,未涂层器械的β-TG和TAT水平显著升高,而血小板计数显著降低。在对器械进行扫描电子显微镜(SEM)分析时,FRED-X器械上发现最少的血小板聚集。免疫组织化学结果表明,该涂层并未妨碍内皮细胞的附着。多中心FRESH研究支持了体外研究的结果,161名接受FRED-X治疗的患者根据各机构的标准接受了不同的DAPT方案。该研究报告了较低的血栓并发症率(4.3%)和主要不良事件率(3.1%),同时在研究终点66%的动脉瘤完全闭塞。这些积极的结果引发了一种可能性,即该涂层的抗血栓性可能使这些器械在SAPT下是安全的,但仍需要临床验证。
药物结合装置
制造抗血栓性器械涂层的另一种策略是将活性药物结合到表面上,以减少或消除全身药物治疗的需求。在这些案例中,药物被永久性地固定在器械表面上,而不是随时间逐渐释放。这种方法的优点是,它解决了异物材料的存在以及器械释放过程中对内膜造成的潜在损伤,这会激活外源性凝血路径。数据显示,简单的微导管置入会导致内皮剥脱,暴露出血栓形成的内皮下结构(图2)。活性药物涂层理论上可以在这种情况下限制血栓形成,或者在血栓形成时将其溶解。

图2:微导管通过后犬脊髓前动脉横切面的扫描电镜图像。沿着微导管路径可以看到血管壁内皮的剥落(白色箭头),也可以看到微导丝路径(黑色箭头)。
肝素化涂层
自20世纪60年代以来,一直在探讨使用肝素涂层来减少器械的血栓形成性。作为一种百年常用的抗凝剂,肝素增强了凝血级联的天然抗血栓机制。具体来说,它激活抗凝血酶III,主要失活凝血因子V和凝血酶,以及其他丝氨酸蛋白酶。这反过来也抑制了血小板粘附和激活。粘附减少可能是由于纤维蛋白原沉积减少,而激活减少则是由于诸如凝血酶等血小板刺激因子的减少。这些额外的性质突出了使用肝素涂层神经血管器械而不需要DAPT的前景。
在药物洗脱设计广泛应用之前,肝素涂层是预防冠状动脉支架血栓形成的一种令人兴奋的方法。尽管较大的注册研究结果尚未定论,但一些研究建议肝素涂层在减少亚急性支架血栓形成方面是安全有效的。此外,HOPE试验在200例接受单药阿司匹林治疗的冠状动脉中,30天支架血栓形成率仅为1%。
为了建立在这项经过证实的技术基础之上,Stryker最近与Carmeda公司(W.L. Gore Associates的全资子公司,位于美国特拉华州纽瓦克)建立了合作关系,试图通过在其Evolve FD支架表面共价结合肝素分子(图3)来改善其性能。一些早期证据支持这种表面修饰在神经血管系统中的安全性和有效性,但尚未应用于特定的神经血管器械。最近在犬模型中,这种涂层显示出良好的前景。涂层和未涂层的FD支架均植入于基底动脉。在植入1周后,涂层支架组动物的敏感性加权成像上的磁化率伪影较裸支架组少,这意味着血栓栓塞较少。与对照组相比,涂层器械在植入后立即进行的光学相干断层扫描中也显示急性血栓形成的趋势较小。这些结果表明,该涂层可降低血栓栓塞事件的风险,而不会影响疗效。未来的研究将继续在这些初步结果的基础上进行探索。
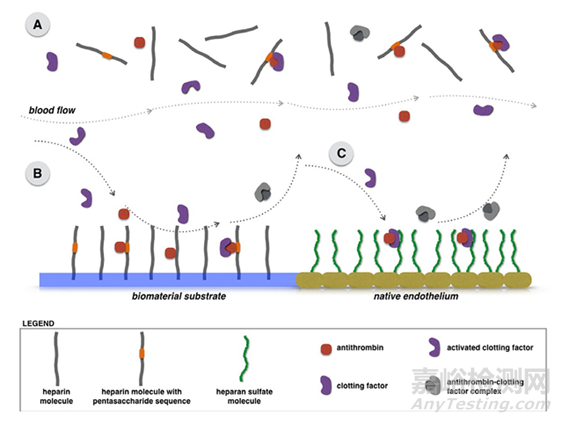
图3:(A)自由可溶性肝素全身用药的抗凝作用,这依赖于浓度和分子量。(B)肝素附着和固定在植入式装置表面,通过抗凝血酶在材料界面抑制凝血因子。(C)内皮的硫酸乙酰肝素蛋白多糖,天然结合抗凝血酶并抑制凝血因子。
结合肝素的纤维蛋白纳米涂层
纤维蛋白-肝素涂层正在被研究,以降低器械的血栓形成性并改善内皮细胞的生长。活化的血小板通过GPIIb/IIIa与纤维蛋白原结合而聚集并开始形成血栓。血小板也通过GPIb和整合素介导的与纤维蛋白的相互作用而聚集。与典型的聚集机制不同,这种替代途径依赖于激活的凝血酶,即凝血级联的最终产物。诱导凝血酶失活的肝素可以共价结合到纤维蛋白涂层上,创造一种有利于内皮细胞生长且对凝血惰性的表面。体外实验中,与未涂层箔片相比,在含有分离的内皮细胞的培养基中孵育后,这种涂层的箔片上结合的内皮细胞明显更多。纤维蛋白-肝素涂层箔片也被发现明显比纯纤维蛋白涂层和裸金属箔片更不易形成血栓。这一点在全血孵育后的血小板计数和扫描电镜成像得到了反映。
Acandis (Pforsheim, Delaware, USA)利用这些原理为其DERIVO 2Heal栓塞装置开发了一种纤维蛋白-肝素纳米涂层。在兔模型中,该装置与裸支架相比表现出类似的生物相容性,但纤维蛋白和血小板沉积明显更少。涂层和未涂层支架上的内皮细胞生长似乎没有差异。为进一步研究这种涂层装置的长期血管造影结果和安全性,Acandis正在赞助REheal观察性试验(临床试验登记号:NCT05543447),即将开始招募患者。单抗血小板治疗(SAPT)与这种装置的结合看起来很有前景,但需要更大规模的研究来证实这些初步数据。
FXa-GPIIb/IIIa抑制剂
EP224238是另一种令人着迷的药物选择,它具有抗血小板药物替罗非班和抗凝血药物伊德拉帕林素的双重作用。这种联合的抗血小板和抗凝血活性可能大幅减少支架血栓形成,而无需全身性药物。涂层和未涂层的盘片在血小板粘附试验中显示出类似的结果;然而,扫描电镜上的定性血小板形态学分析确实显示血小板激活程度降低。此外,药物涂层的盘片在暴露于全血后具有良好的抗FXa活性,而人体内皮细胞粘附也未受影响。理论上,针对FXa激活可能在某些患者群体中比肝素具有优势,因为它不需要依赖于固有的抗凝血酶III活性。尽管我们目前还没有发现任何正在开发使用这种涂层的FD支架,但这个概念在理论上是很有吸引力的。
改善内皮细胞生长的修饰
之前提到的表面修饰主要集中在降低器械的血栓形成性,另一种降低DAPT需求的策略是提高植入物的内皮化速度。理论上,DAPT只需要在器械暴露于循环血液的期间使用。从理论上讲,加速内皮细胞的生长可以减少患者在DAPT上花费的时间和血栓栓塞并发症的风险。
抗CD34抗体
循环CD34+内皮祖细胞已被证明可导致植入器械的内皮化。使用共价结合的抗CD34抗体对支架进行表面改性应该能更有效地结合循环祖细胞,并可能减少血管暴露于设备的时间。OrbusNeich在其COMBO Plus冠状动脉支架上结合了这种抗体涂层和更传统的单向释药聚合物涂层。
早期研究表明,添加抗体表面改性不仅可以维持西罗莫司的抗增殖效果,还可以促进器械上的内皮细胞生长。REMEDEE注册研究的结果进一步支持了这种技术在冠状动脉循环中的应用。在为期5年的研究中,1000名患者中只有0.9%发生支架内血栓,3年后未再报告任何病例。这些结果令人鼓舞,值得考虑将这项技术应用于设计用于脑血管的器械。
紫外线照射过的镍钛
紫外线照射已被证明可以改变二氧化钛表面的润湿性。基于这些发现,通过对镍钛合金进行紫外线照射是另一种可能改善内皮细胞生长的策略。通过紫外线辐照引发的电子转移反应可将Ti4+转化为Ti3+,后者对水的解离吸附有亲和力。经紫外线改性的器械表面导致蛋白吸附增加,而蛋白吸附与血栓形成呈负相关关系。研究还发现,内皮细胞在经过照射的金属表面上迁移更容易,比未经照射的金属表面更易迁移。
CD31类似物
CD31,也称为PECAM-1,是一种跨膜糖蛋白,选择性地表达于血小板、白细胞和内皮细胞上(图4)。这个分子可以降低白细胞和血小板的激活,并可能改善血管内皮的愈合。鉴于这一作用,使用其类似物对器械表面进行改性,可以想象得到会改善器械与血管壁的结合,同时也可减少植入部位的炎症和血栓形成。
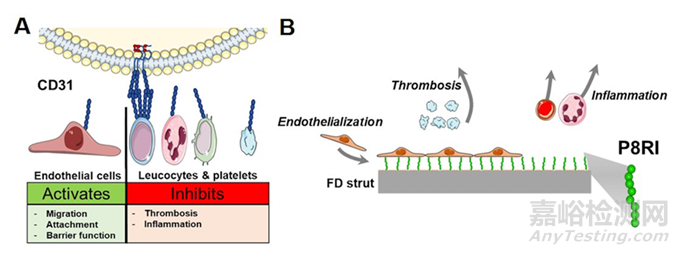
图4:(A) CD31的主要功能。CD31在内皮细胞、血小板和白细胞表面高度表达。对细胞间反式同质结合的循环稳态起关键调节作用。(B)连接到血流导向装置小梁上的P8RI肽的示意图。P8RI通过与近膜CD31结构域结合发挥CD31激动剂的作用。其目的是在预防血栓形成和炎症的同时,更有利于内皮化。
研究表明,P8RI肽,一种CD31膜外部分的类似物,可以连接到Silk Vista Baby器械的表面。体外实验显示,内皮细胞粘附得到改善,与血液成分的反应显著降低。在兔模型中,内皮细胞的生长得到改善,血小板激活也降低了。值得注意的是,尽管该涂层刺激了内膜增生,但血管仍保持通畅和适当的管径。使用CD31类似物对表面进行改性是一种有前景的方法,可快速促进内皮细胞覆盖。
总结
表面改性代表了一组强大的策略,可以减少或消除使用神经血管植入物所需的双联抗血小板治疗(DAPT),以及由血栓栓塞引起的最常见的缺血性并发症。大多数表面改性可分为两大类:1)旨在直接使用血液相容性或结合药物来降低器械血栓形成性的改性;2)旨在促进血管内皮细胞在器械表面粘附和增殖的技术,从而减少所需DAPT的持续时间。虽然这些策略有着相似的目标,但它们可能会相互抵消。最佳的表面改性很可能需要在这两种方法之间达到平衡。当应用于神经血管系统时,这仍然是转化和临床研究的关键课题。

来源:TRA of Neuro


