您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-20 09:27
硫化物电解质分类
硫化物固态电解质通常以晶体结构划分为玻璃态、玻璃陶瓷态和晶态,其中,Li3.25Ge0.25P0.7S4 属 于 thio-LISICON 型硫化物固态电解质,Li6PS5X(X=Cl, Br, I)属于 Li-argyrodite 型固态电解质, Li10GeP2S12属于 LGPS 型固态电解质。
玻璃态硫化物固态电解质通过机械球磨或高温熔融后快速冷却的方法获得,在 XRD 表征下没有明显的峰。玻璃陶瓷类硫化物固态电解质通常为球磨后经过一步低温烧结后获得,属于玻璃态和晶态混合的亚稳相,在 XRD 表征下有少量的峰。研究表明,玻璃态固态电解质主要由正硫代磷酸盐,焦磷酸盐,偏硫代磷酸盐,次硫代磷酸盐四类微小晶体构成,其传导离子的机理尚不十分明确。
晶态的硫化物固态电解质通常经过高能球磨后高温烧结获得,也有部分研究采用高能球磨、研磨 后烧结及液相法制备得到。晶态的硫化物固态电解质按晶体结构主要分为 thio-LISICON 型、Liargyrodite 型和 LGPS 型。这三种类型的电解质都有具体的晶体结构和锂离子传输通道,其结构组成和离子迁移机理都较为明确。
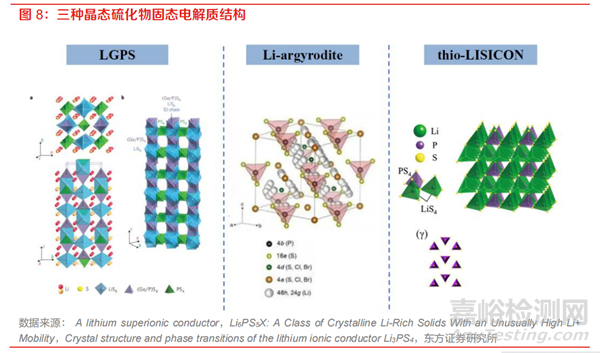
LPSCl 型硫化物电解质低成本量产潜力相对较大。在晶态硫化物固态电解质中,thio-LISICON 型硫化物固态电解质的离子电导率相对较低,通常被认为较难实现商业化应用。LGPS 型电解质具 有很高的离子电导率,但由于含有贵金属锗,规模化应用受到限制;有部分研究尝试用硅或者钛 对锗进行替代,可以实现超越电解液的离子电导率,但其电化学稳定性差,同样难以应用。而硫 银锗矿型电解质 LPSCl 具有优异的力学延展性和较高的离子导电性,同时规避了贵金属的使用从 而更具成本竞争力,综合热安全特性、成本、工艺成熟度等因素来看,是硫化物全固态电池较好的技术路线选择。
硫化物电解质制备工艺及难点
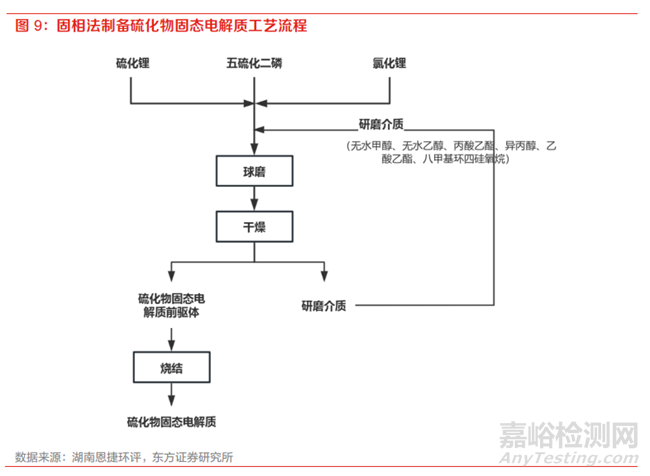
硫化物固态电解质可采用固相法或液相法进行合成。其中,固相法以高能球磨后热处理的方法为主,主要工艺流程包括:
(1)球磨:将硫化锂、五硫化二磷、氯化锂按照一定的比例混入球磨介质中,将混料加入到球磨机中机械研磨后得到浆料;
(2)干燥:将球磨后得到的浆料在保护气氛中干燥,得到硫化物固态电解质前驱体;
(3)烧结:将硫化物固态电解质前驱体置于惰性气体保护下的烧结炉中,高温烧结得到硫化物固态电解质
(4)破碎:将硫化物固态电解质加入到气流粉碎机中经过气流破碎,得到所需粒度的硫化物固态电解质,气流粉碎机单独置于手套箱内,全程密闭运行球磨过程中原材料的化学键被打断,实现原子级别的混合,因此制备的材料可实现较高的离子电导率。但是高能球磨本身设备要求高、研磨时间长、产率低,仍需要改进以适用大规模生产。
液相法通过将材料放入极性有机溶剂中搅拌,之后对溶剂蒸干、热处理得到固态电解质,可减少生产成本。但由于 Li2S、P2S5 等原料较难溶解,往往需要较长反应时间来得到沉淀;并且所得沉 淀为含有溶剂分子的结晶物,在热处理过程中溶剂挥发及结晶溶剂分子的分解逸出,会在电解质颗粒内部产生多孔结构,从而降低离子电导率。
稳定性为制约硫化物固态电解质规模应用的重要瓶颈。晶态的硫化物固态电解质拥有很高的离子电导率,赶上甚至超过液态电解液,因此对于硫化物电解质来说,离子电导率不再是应用于固态电池的关键制约因素,空气稳定性和电化学稳定性才是制约其规模应用的瓶颈。如合成硫化物电 解质的原材料 Li2S 和 P2S5,均存在空气稳定性较差的问题,需要在充满惰性气体、无水无氧的环境中生产,设备要求大幅提升。此外,生产过程中将产生有毒的硫化氢,必须进行回收处理,以防止泄漏造成安全风险。

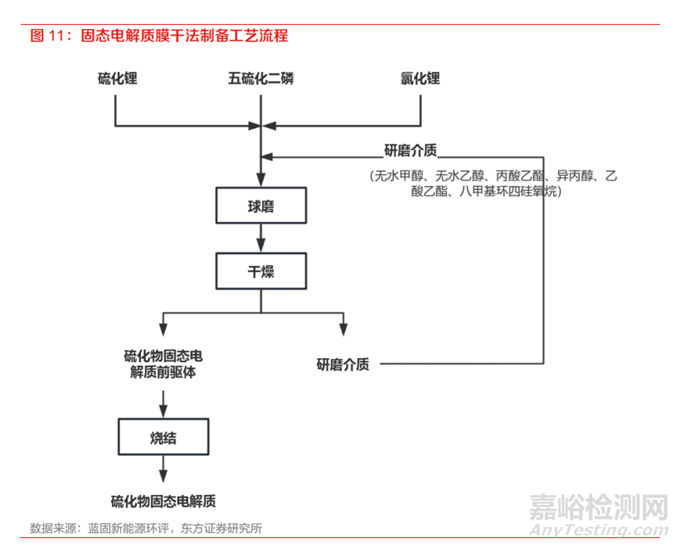
固态电解质薄膜制备是提高电池能量密度的关键。固态电解质多以薄膜形态进行制备,而薄膜厚度的控制是核心,瓶颈在于如何在批量制造过程中避免产生裂纹和缺陷,最终达到一定良率的要求。受到电解质材料力学性能受限等的影响,目前业内能够实现的电解质膜厚度为 20-40 微米。
若考虑到能量密度的要求,接下来还需要进一步降低。与极片制备方法类似,硫化物电解质膜的制备方法主要分为干法和湿法两种。湿法工艺是利用溶剂将粘结剂溶解,添加入固态电解质粉末进行匀浆混合,经过涂布烘干工序形成膜材,其厚度由浆料固含量和涂布缝隙宽度决定。对于湿法涂布,溶剂-粘合剂对和工艺参数对 于硫化物电解质膜的离子电导率和可加工性至关重要。
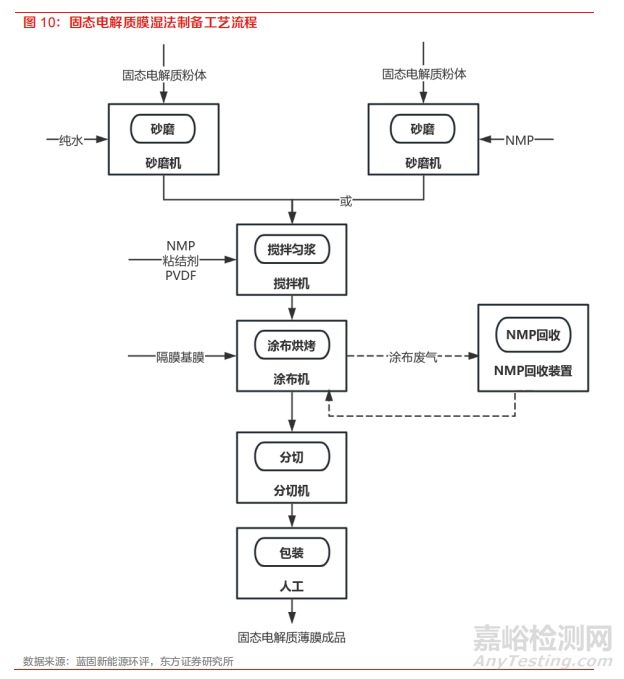
干法工艺主要通过将电解质粉末和粘结剂进行干混和纤维化,然后通过粉体辊压或挤压成膜,膜的厚度由辊压或挤压设备的缝隙宽度决定。干法制膜可以解决溶剂残留的问题、并省去了湿法工 艺后烘干的环节,因此具备提高电导率(粘结剂以纤维状态存在,方便电子和离子通过)、降低成本的双重优势,但相较湿法工艺对于设备的工作压力、精度以及均匀度也提出了更高的要求, 工艺参数和放大设备有待进一步研究。
硫化锂:电解质关键原料,合成难度大。硫化锂为合成硫化物固体电解质的重要原料。硫化锂是硫化物固态电解质的关键原材料之一,其纯度会直接影响硫化物固态电解质的性能。硫化锂为锂的硫化物,分子式是 Li2S,白色至黄色晶体,具有反 CaF2 型晶体结构,可溶于乙醇,溶于酸,不溶于碱。
目前硫化锂的制备基本上采用下面几种方法:
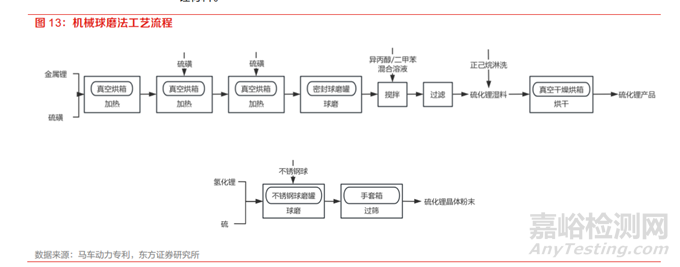
(1)机械球磨法
机械球磨法是在惰性气氛下,将单质硫和金属锂/氢化锂按比例混合后进行机械球磨反应,最终得到硫化锂产品。
若采用金属锂作为锂源,则需要通过高温高压促使硫单质和锂单质发生化合反应,其反应方程式 为 2Li+S→Li2S。制备过程如下:①将金属锂和硫磺按照质量比 1:0.8 加入到惰性高压容器中,将 高压容器放入 250℃~300℃真空烘箱中 2~3h,再加入第一次等量的硫磺保温 2~3h ,最后再加 入等量的硫磺保温 2~3h。②将高温灼烧得到的硫化锂粗产品放入密封的球磨罐中,室温下在转速为 100~500r/min 条件下球磨 12~24h。③球磨后的硫化锂加入到质量比 1:5 的异丙醇/二甲苯混合溶液中搅拌 1~2h。④将硫化锂浆料过滤,后加入一定量的正己烷淋洗,得到硫化锂湿料, 将硫化锂湿料放入 205℃真空干燥烘箱烘干 8~12h ,得到硫化锂产品。该方法的优点是原料便宜且常规,制备过程简单,且不产生任何废气废液。但是这种制备硫化锂的方法成本高昂,生产过程存在高温高压,对设备的选型要求很高,而且工况不易控制,同时也为后续的处理带来了挑战,
在经济和工艺上均不易实现规模化的制备。也可采用氢化锂和单质硫球磨反应,其反应方程式为 LiH+S→Li2S+H2↑。其制备过程如下:①将 LiH和 S按照摩尔比 2:1 装入带泄气阀的不锈钢球磨罐中,再加入适量直径为 10mm 的不锈钢球, 球料比 20:1 螺钉固定密封后在行星式球磨机中进行球磨 2.5 小时。②在手套箱中放出氢气,过筛 200 目,即可获得硫化锂晶体粉末。该方法同样具备工艺简单、无废液产生的优点,但由于反应 放热剧烈,球磨罐容易炸裂,而且容易产生局部的高、低温,高温部生成结晶性的硫化锂、多硫化锂,而低温部生成非晶质的硫化锂和含有未反应的原料,结果得不到纯度高、结晶性好的硫化锂材料。
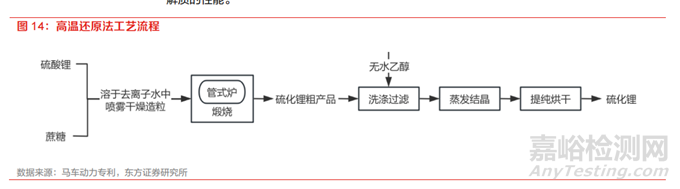
(2)高温还原法
该方法的主要思路为将含硫锂盐和还原剂混合后高温烧结制备硫化锂,又可以称为固相烧结法。含硫锂盐通常为硫酸锂,还原剂可选蔗糖,反应方程式为 C12H22O11→12C+11H2O,Li2SO4+2C →Li2S+2CO2。其制备过程如下:①将硫酸锂和蔗糖按比例溶于去离子水中,然后喷雾干燥造粒;②造粒得到的粉末在管式炉中 750℃煅烧 15h ,得到硫化锂粗产品;③硫化锂粗产品用无水乙醇洗涤过滤不溶的硫酸锂和碳粉,然后将滤液蒸发结晶提纯后烘干,即得到硫化锂,纯度 99.4%。该方法所采用的原材料便宜且常规,工艺流程简单,无有害气体产生,且有效利用了高温高压密闭反应的优势,避免有害溶剂泄漏。但高温高压同样增加了工况控制和设备选型的难度,并且在生产过程中会有大量的副产物 Li2O 产生,导致 Li2S 产品不纯,最终影响使用 Li2S 的硫化物固态电 解质的性能。
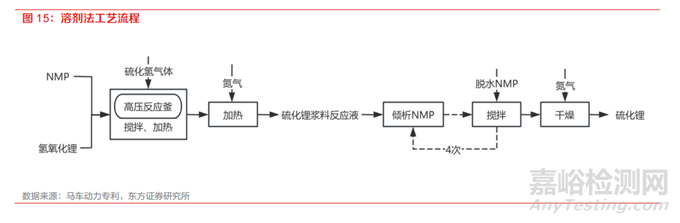
(3)溶剂法
溶剂法是将锂盐混合在有机溶剂中,同时通入硫化氢气体,在加热状态下反应后除杂得到高纯硫 化锂,又可以称为液相法,其反应方程式为 LiOH+H2S→Li2S+H2O。有机溶剂多选用脂肪烃、芳香烃或醚溶剂等,比如乙醇、己烷、甲苯、乙醚、四氢呋喃、氮甲基吡咯烷酮等。
其制备过程如下:①在具有搅拌桨的高压反应釜中加入 NMP 和氢氧化锂,边搅拌边升温到 130℃, 向液体中通入恒定流速的硫化氢气体。接着该反应液在氮气流下升温去除多余的硫化氢。随着升温,反应的副产物水开始蒸发排到系统外。到达 180℃时停止升温,保持恒温,制备得到硫化锂 浆料反应液。②将硫化锂浆料反应液中的 NMP 倾析后,加入脱水的 NMP 在 105℃搅拌 1 小时, 在该温度下将 NMP 倾析,重复相同的操作共计 4 次。③倾析结束后,在氮气流下在 230℃下将硫 化锂在常压下干燥 3 小时得到硫化锂。
该方法中液相反应充分完全,不易残留杂质,产品提纯容易;避免了高温的烧结过程,可减少能 耗;工艺相对简单,适合大规模连续制备。但是由于使用了易燃、易爆、易挥发的有机溶剂,反 应中也用到了有毒的硫化氢气体,不论是有机溶剂还是硫化氢的泄露都容易造成环境污染和人员 伤亡,提高了工况的危险性,增加了设备选型和后续回收处理的难度。

来源:Internet


