您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-21 11:19
摘 要 / Abstract
本文梳理和总结了全球主要医疗器械监管机构和组织对医疗机构内生产医疗器械的监管要求和研究进展,分析了全面监管模式、特殊监管模式、医疗器械生产系统监管模式在我国转化实施的可行性和风险,以期为我国探索医疗机构内生产医疗器械的监管模式研究提供参考。
This article reviews and summarizes the regulatory requirements and recent research progress by major global medical device regulatory agencies and organizations regarding the point-of-care manufacturing of medical devices. It analyzes the risks and feasibility of implementing a comprehensive regulatory model, a specialized regulatory model, and a medical device production system regulatory model in China. This study aims to provide a reference for developing regulatory frameworks for the point-of-care manufacturing of medical devices in China.
关 键 词 / Key words
医疗机构;医疗器械;医疗机构内生产;监管模式
healthcare facility; medical devices; point-of-care manufacturing; regulatory model
医疗器械的设计开发以解决临床实际需求为导向,产品验证和确认环节需要经受临床实践的检验并进一步迭代更新,因此医疗机构在医疗器械产品全生命周期中发挥着重要作用。随着个性化、精准化治疗理念的应用发展,医疗机构纷纷开始探索从被动接受和使用医疗器械产品,到参与和主导医疗器械研发制造的模式转变。基于此,本文梳理和分析了在全球医疗器械监管背景下,国内外医疗机构内开展医疗器械生产的监管和实践要求。
1、我国监管要求
2000 年《医疗器械监督管理条例》颁布实施,其中第十条明确:“医疗机构根据本单位的临床需要,可以研制医疗器械,在执业医师指导下在本单位使用。医疗机构研制的第二类医疗器械,应当报省级以上人民政府药品监督管理部门审查批准;医疗机构研制的第三类医疗器械,应当报国务院药品监督管理部门审查批准”[1]。虽然法规中有明确规定,但在实际工作中并未得到有效落实。
定制式义齿是我国最早被纳入监管的个性化医疗器械。其通常是采用义齿加工材料根据患者个性化解剖尺寸进行生产加工而成。义齿的生产制造可由医疗器械生产企业进行,或由医疗机构在机构内义齿加工中心或口腔技工室内进行,符合医疗机构内生产医疗器械的情形。2009 年,原国家食品药品监督管理局发布《关于加强定制式义齿生产监管的通知》,规定医疗机构所属的口腔技工室加工定制式义齿产品仅供本单位使用,并应建立与其相适应的质量管理体系,保持有效运行。但是,如果该医疗机构接受其他医疗机构委托生产定制式义齿,应取得相应的生产许可和产品注册证书[2]。
2021 年新修订《医疗器械监督管理条例》第五十三条和第一百零五条分别规定,对于“国内尚无同品种产品上市的体外诊断试剂”和“为应对突发公共卫生事件而研制的医疗器械”,在医疗(卫生)机构内研制和使用的相关规定由国务院药品监督管理部门会同国务院卫生主管部门制定[3]。2022 年10 月,上海市深化医药卫生体制改革领导小组办公室发布关于开展上海市公立医院高质量发展试点工作的通知,明确指出:鼓励有条件的医院开展自行研制体外诊断试剂试点;大力发展高新医疗技术,面向再生医学、精准医学、脑机融合等前沿领域尖端科学问题,鼓励药品、医疗器械和设备等研发的医工结合、产医融合[4]。
2、国际监管要求
2.1 国际医疗器械监管机构论坛
国际医疗器械监管机构论坛(International Medical Device Regulators Forum,IMDRF)是由中国、美国、欧盟、日本、澳大利亚、加拿大、巴西等国家和地区医疗器械监管机构组成的国际协调组织,下设多个研究工作组。2020 年4 月, 个性化医疗器械工作组(Personalized Medical Device Working Group) 发布《个性化医疗器械监管路径指南》(Personalized Medical Devices-Regulatory Pathways), 首次提出“ 医疗器械生产系统(medical device production system,MDPS)”概念[5]。具体而言,将医疗器械终产品和医疗器械生产过程所需的原材料、软件和电子文件、主要生产设备、后处理设备以及操作说明等生产过程要素(medical device production process,MDPP) 看作一个整体, 共同组成医疗器械。医疗器械制造商提供MDPS, 医疗机构使用MDPS 进行生产制造。这一模式的提出最早是为了解决新冠疫情期间医疗机构物资短缺的问题,采用医疗机构内3D 打印生产可以快速获得医疗所需防护用品。同时,医疗机构使用MDPS 进行3D 打印个性化医疗器械,可以使医生更好地参与个性化诊疗方案设计和临床应用。
传统医疗器械生产模式和MDPS 生产模式的差异具体体现在医疗器械定义、医疗器械制造商职能和医疗机构职能3 个方面(表1)。MDPS 生产模式中的医疗器械定义类似于医疗器械中“盒”或“系统”的概念,即“包括多个组件或附件的医疗器械在内的产品包装在一起,共同实现同一预期用途”,如手术器械系统[5]。系统内的不同组件可由组件制造商提供,但是医疗器械制造商需要对整个系统及生产过程负责。医疗机构不仅是医疗器械的使用者,同时也是医疗器械的实质生产者。目前,MDPS 生产模式在大部分IMDRF 成员国及地区尚未广泛实施。

2.2 澳大利亚监管要求
作为IMDRF 个性化医疗器械工作组的牵头人,澳大利亚治疗产品监督管理局(Therapeutic Goods Administration,TGA)最早探索和提出MDPS 概念, 并于2022 年8 月首次发布《个性化医疗器械( 包含3D 打印器械)监管要求解读》[Understanding personalized medical devices rules (including 3D-printed devices)], 对MDPS要求进行了详细阐述[6]。值得关注的是,TGA 进一步明确了可使用MDPS 的医疗专业人员(health professional)或适宜的授权人员(qualified person),医疗专业人员可能包括临床医生、牙医或其他注册医疗工作人员,以及生物医学工程师、验光师、矫形外科医生、理疗师等。对于适宜的授权人员,需要结合产品的复杂程度和需求, 以及人员的工作经验和培训情况综合确定。MDPS 制造商应在产品说明书中明确适宜的授权人员范围,包括应当具备的资质和经验、职级或等级,上岗前所需的第三方资质或由制造商组织的培训。根据该解读文件,如果医疗人员研制和生产患者匹配器械,也需要作为制造商向TGA 申请符合性审查,并确保符合安全和有效基本要求清单(essential principles),以获得上市批准。在示例中,TGA也提到了制造商确保MDPS 持续有效运行的措施,如提供培训课程、定期开展上门维护、在设备中安装防护报警系统等。
2.3 美国监管要求
随着3D 打印技术在临床的广泛应用, 医疗机构可以快速、高效地完成医疗器械的设计和生产,如个性化患者匹配医疗器械,或弥补传统生产模式下由物资短缺造成的医疗器械供应不足的问题。在此背景下,美国食品药品监督管理局(Food and Drug Administration,FDA) 下设器械与放射健康中心(Center for Devices and Radiological Health,CDRH) 于2021 年12月发布了《医疗机构3D 打印医疗器械( 讨论稿)》(3D Printing Medical Devices at the Point of Care: Discussion Paper), 阐述了FDA 对于医疗机构自制医疗器械的风险认识,提出了许多问题供业界讨论,以便加强对于医疗机构内生产3D 打印医疗器械的监管[7]。
FDA 认为,医疗机构内生产3D 打印医疗器械可能包括3 种情形:使用MDPS 进行3D 打印、医疗机构委托传统制造商在医疗机构内或附近进行生产、医疗机构作为传统制造商进行生产(表2)。不同场景反映了不同的需求,也存在不同的监管风险。例如,医疗机构采用MDPS 进行3D 打印后完成机械加工、热处理、精密钻孔、灭菌等后处理工艺的可行性,以及传统制造商能否完全符合质量管理体系中对于验证和确认的相关要求。此外,FDA 也考虑将医疗机构内3D 打印的医疗器械限定为风险等级“非常低”的产品,其判定依据可能包括产品的预期用途、管理类别、与人体接触部位和时间、可知的安全使用史、交付状态、是否为患者匹配器械,以及合理和可预期的不良事件。

2.4 欧盟监管要求
根据欧盟2017 年发布的新版《医疗器械法规》(Medical Device Regulation,MDR)和《体外诊断医疗器械法规》(In Vitro Diagnostic Regulation,IVDR)第5(5) 条款, 欧盟内的卫生机构可以在机构内以非工业化规模生产和使用自制医疗器械,以解决市场上已获得欧盟CE 认证的等同器械无法满足或无法以适当性能水平满足的目标患者群体的特定需求的问题。2023 年1月,欧盟下设医疗器械协调小组(Medical Device Coordination Group,MDCG)发布了面向医疗保健专业人员和医疗机构研究人员的《基于医疗器械法规和体外诊断医疗器械法规第5(5) 条款的卫生机构豁免指南》[Guidance on the Health Institution Exemption Under Article 5(5) of Regulation (EU) 2017/745 and Regulation (EU) 2017/746],对上述条款的适用性和要求做进一步阐述[8]。
根据相关法规和指南文件,如果医疗机构遵守欧盟MDR和IVDR 第5(5) 条款规定的条件,其自制器械可豁免MDR 和IVDR 中的大部分规定,只需要符合法规附录Ⅰ中通用的安全和性能要求,具体包括:①建立风险管理体系并评估受益- 风险比,特别需要关注对于使用者的风险。②了解自制器械所需的设计、生产和使用相关要求,医疗机构需要特别关注自制器械所适用的相关要求,这些要求也会支持论证欧盟上市器械的非等同性。③明确器械随附信息的要求,如标签和说明书中的安全使用相关内容,如果无法满足安全和性能要求,应提供合理性论证。④法规要求针对自制器械建立适当的质量管理体系(appropriate QMS)。医疗机构需要向其主管部门提交上述文件。需要注意的是,上述法条适用于医疗器械和体外诊断医疗器械,不适用于定制式医疗器械(custom-made devices)。
3、讨论和展望
在我国,医疗机构是指“从事疾病诊断、治疗活动的医院、卫生院、疗养院、门诊部、诊所、卫生所(室)以及急救站等”[9]。医疗机构内生产医疗器械是以更好地辅助医疗机构救死扶伤、防病治病为主要目的。笔者梳理发现,目前国际上针对医疗机构内生产医疗器械的监管模式主要包括3 类:全面监管模式、特殊监管模式和MDPS 监管模式(表3)。以下将针对3 种模式在我国实施监管的可行性和风险进行讨论。
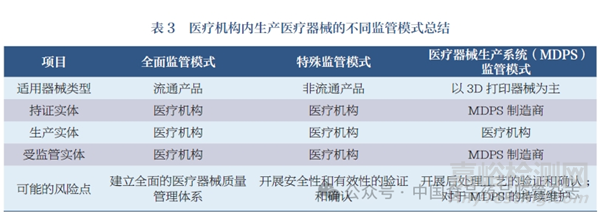
3.1 全面监管模式
传统监管模式中,医疗机构同时作为医疗器械注册证持有人和实际生产者,需要同时满足上述两者的全部要求。根据2021年新修订《医疗器械监督管理条例》,医疗器械注册人需要对产品的研制、临床试验、生产制造、上市后销售、不良事件监测等全生命周期负责,在医疗器械生产活动中的人员和环境、检验检测、质量管理、售后服务、文件要求5个方面进行条件配备。如果医疗机构在传统监管模式下开展生产,虽然承担较大的受监管责任,但能够有效保证全生命周期内医疗器械的安全性和有效性,面临相对较小的生产制造风险。现实中,医疗机构建立和持续运行全面的医疗器械生产质量管理体系需要投入大量的人力和物力,在体制机制、管理运行、监管审计等方面均有一定的难度,需要克服较多困难。
3.2 特殊监管模式
如前文所述,作为对市售医疗器械无法满足临床需求的必要补充,允许医疗机构内生产非流通的自用器械,按照这一特殊路径申报可不遵循一般的上市前审评审批流程。虽然现行法规中已有相应的依据,但具体的实施细则仍在研究制定中。
早在1984 年颁布的《药品管理法》中已经提出了医疗机构制剂的概念,具体是指医疗机构根据本单位临床需要经批准而配制、自用的固定处方制剂。为规范医疗机构制剂配制和注册管理,原国家食品药品监督管理局于2005年颁布实施《医疗机构制剂配制监督管理办法(试行)》《医疗机构制剂注册管理办法(试行)》,对医疗机构制剂的配制、调剂使用、审批、检验和监督管理做出了详细规定[10-11]。国家药事管理专业医疗质量控制中心于2019年开展的调研结果显示,在全国4639 家医院中,设立医疗机构制剂室的占8.15%,具有医疗机构制剂批准文号的占9.36%。在具有医疗机构制剂批准文号的医院中,拥有中药制剂批准文号的占比最高(73.66%),其次为普通化学药制剂(69.93%)[12]。由此可见,虽然医疗机构制剂的数量并不多,但确实是对现有流通药品的有效补充。
医疗机构制剂的应用实践对于医疗机构内生产医疗器械具有参考意义。例如,对化学药制剂和中药制剂实施差异化管理,出台鼓励医疗机构中药制剂的政策等[13]。对于特殊模式下的审评审批,亦可在医疗机构制剂的基础上进行调整和简化,以适应当前的监管趋势。该模式可能的风险点在于对“医疗机构内生产医疗器械作为流通器械的补充,而非替代”的判定,以及在尚无已上市产品作为对照的情况下,医疗机构如何开展医疗机构内生产医疗器械的安全性和有效性的验证和确认工作等。
3.3 MDPS 监管模式
在MDPS 下开展生产时,MDPS 制造商作为注册证持有人负责提供MDPS 中所需的生产物料并进行必要的工艺验证,医疗机构采用经验证的物料和工艺开展生产,既实现了临床机构真正参与医疗器械研制,又能提供一定的安全性和有效性保证。但是, 该模式可能引入两方面的新增风险。
一方面,MDPS 监管模式扩大了当前我国医疗器械定义的范围。根据《医疗器械监督管理条例》,通常只有医疗器械终产品被视为医疗器械,生产医疗器械的原材料、生产设备、工艺文件等通常不作为医疗器械进行监管。口腔充填修复材料、义齿制作材料、口腔治疗辅助材料等可在临床诊疗中加工成义齿用于患者的口腔科材料属于例外情形,具有其特殊性和历史延续性。需要注意的是,在MDPS 中,生产过程要素不能单独作为医疗器械存在,只能作为医疗器械系统的组成部分。事实上,这种情况在医疗器械领域并不是首次出现,一部分医疗器械需要在术中按照要求进行处理、组装后进行使用。例如,用于骨组织填充占位的骨水泥产品,以粉体、液体分包装的形式提供,需要由医务人员按照产品说明书规定在术中进行混合、搅拌,待适当凝固后使用。虽然操作相对简单,但这些步骤在某种角度上也可被视为医疗器械的再加工活动。可见,生产加工和术中操作之间存在一定的模糊地带。从监管角度来说,采用MDPS 生产医疗器械终产品的过程较术中操作步骤等更为复杂,对于生产过程的质量控制要求更高,可能引入更大的安全风险。
另一方面是医疗机构内生产的全生命周期质量控制和监管责权划分问题。在现行医疗器械注册人制度下,注册人和受托生产企业可以分离,这与MDPS 模式下医疗器械生产工艺的制定者(制造商)和实际生产者(医疗机构)分离有一定相似性。但通常情况下,实际生产者需要在注册证中予以明确,并被纳入医疗器械监管中。MDPS 的建立初衷是给予医疗机构操作层面更多的灵活性,从而纳入质量管理体系层面进行管理,而不是直接对医疗机构进行监管。当然,监管模式需要与产品风险相适应,对于低风险和较高风险的产品亦可以在MDPS模式下细化不同的上市前监管要求,明确注册人和医疗机构的职责划分,从而降低生产制造风险,使其能够最大限度地发挥MDPS模式的优势。
现阶段,医疗器械创新发展仍以解决临床需求为导向。合理解决临床实际问题是医疗器械审评审批制度改革的发展动力,保证医疗器械在全生命周期的安全性和有效性是医疗器械监管的底线。目前,我国与其他国家和地区一样都需要积极探索医疗机构内生产医疗器械的不同监管模式和要求,对不同监管模式的风险及受益作进一步评价,以及对转化实施进行可行性评估。
引用本文
闵玥*,吴静,张家振,史新立.医疗机构内生产医疗器械的监管模式研究[J].中国食品药品监管,2024(11):44-49.

来源:中国食品药品监管杂志


