您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2024-12-22 19:48
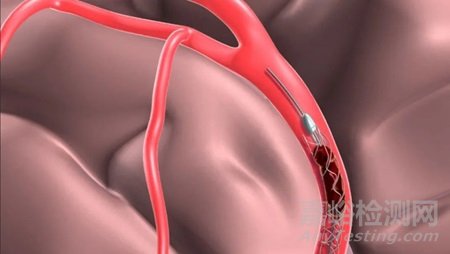
一、支架取栓术所致的血管损伤
使用取栓支架进行AIS的血管内治疗,在取得较高的血管再通率的同时,应考虑到脑血管对机械损伤的敏感性,所以装置本身产生的血管损伤不容忽视。
临床上,取栓装置所致血管损伤的表现多样:
·宏观上:
可导致血管内皮剥脱、夹层、穿支血管损伤和撕裂等,可能造成严重的临床后果,如出血、夹层、再闭塞和再通失败等,导致患者的预后不良。
·微观上:
血管闭塞后血管内皮细胞的血流剪切应力改变以及血栓对血管内皮的毒性作用,会影响内皮细胞间、内皮细胞核中膜平滑肌细胞间的信号传导,可以引起一系列生长因子和细胞因子(如血管内皮生长因子、肿瘤坏死因子α、白细胞介素1β和白细胞介素6)的释放,导致出现一系列级联放大反应最终造成血管内皮的功能障碍、血脑屏障的功能完整性丧失以及继发性神经元损伤。
血管再通后这些损伤可不同程度的恢复,而血管内皮功能难以完全恢复甚至加重。这种机械损伤已在体外细胞模型、动物模型和人类临床影像学资料等不同维度得到证实,如在家兔的颈动脉取栓模型的研究中,于取栓后1周和2周可以观察到血管内膜增厚和水肿,与4mm直径的取栓装置比较,6mm直径的取栓装置造成的血管内膜损伤程度更加明显。
在家猪实验模型的研究中有学者使用血管内光学相干断层扫描观察取栓后的血管损伤表现以及与组织病理学标本进行对照,发现取栓后1、3和6h血管内皮出现剥离,与之相对应的可见组织病理学标本的血管内膜夹层出血和中性粒细胞浸润。
来自取栓术后高分辨磁共振影像学研究发现,取栓可导致病变血管壁增厚和强化。来自体外细胞平台的研究亦证实了体内动物实验的结果,并且展示了不同取栓装置对血管损伤的异质性。
二、取栓装置结构的设计对血管损伤的影响
降低取栓装置对血管损伤的同时,最大限度地发挥其恢复脑血流的作用是取栓装置设计面临的重要问题。取栓装置为超弹性镍钛合金制成的网笼结构,用以捕获血栓并机械地从体内移除血栓,支架筋条的径向支撑力作用于血管壁,在释放支架和打开状态下移动支架的过程中,不匹配血管解剖结构的支架系统可能会造成血管壁的机械损伤。
取栓装置的设计涉及生物力学、力生物学和材料力学等学科,目前学界仍缺乏针对取栓装置的结构对血管壁影响的力学分析和实验研究。有学者针对体外仿真取栓支架的力生物学特性进行了探索,并对半闭环取栓装置的结构、释放、移动过程进行了有限元模拟分析,提出了支架的外部设计应更加平滑,以减少其应变峰值,为取栓装置的设计提供了有益的借鉴。

目前,更多的、可借鉴的信息来自于网孔样镍钛合金血管支架,此类支架(特别是大型号支架)对血管壁的损伤已经在体外数学、力学模拟和不同种属的动物实验中得到证实。
综合现有的有限元模型分析和动物实验结果认为:支架系统大于置人靶血管的尺寸和顺应性差是导致血管内皮严重损伤的两个重要因素。通过有限元分析和评估血管内治疗技术对机械取栓装置减轻血管损伤的设计具有指导意义。
三、机械取栓装置的结构设计现状
目前,常用的取栓装置有Solitaire、Trevo等二代支架取栓装置,为了提高取栓效率和降低并发症的发生率,学者们对取栓支架进行了改良,如 Trevo XP、NeVa""和ERIC支架等,在脑缺血机械取栓试验中取得的良好效果,并广泛应用于临床。
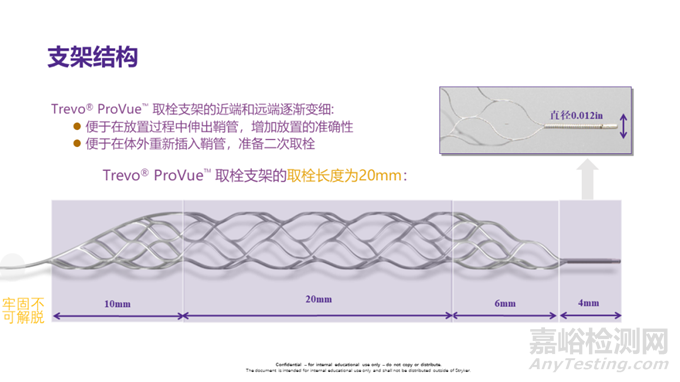
新一代Solitaire取栓支架Paltinum在降低血管损伤上也做出了一定的改进,如显影标记头端更加圆润和可视化更好等。Trevo支架是目前临床上应用较为广泛的取栓装置其头、尾部各以10mm长的半支架形成“锥形”过渡,从而更好地满足较细及远端血管。
也有学者经过长期的研究指出,Trevo支架组的血管开通率高于Merci支架组,疾病可得到更有效的控制,且患者的预后良好率(改良 Rankin 量表评分为0~2 分)高于Merci支架组(40.0%对比22.0%),两组病死率的差异无统计学意义(15%对比23%,P>0.05)。
然而在清除血栓时,脱落栓子可随着血液流动堵塞远端血管,而且取出支架可能会引起其他继发性疾病,如血管壁内膜损伤等,一定程度地增加了治疗风险。
而最新研发的Trevo XP支架已将10 mm的无效段去除,并给予更轻盈的头端无损伤设计,支架推送和操作时对血管的损伤更小NeVa"支架包括3个部分:
1、初始段是一个封闭的细胞支架结构,可以压缩血栓,并即可恢复血流(血流恢复区);
第二部分由2个大的、开放的区域组成,金属覆盖面积最小,被称为“降落区”,它们以90°的角度相互偏移,可为坚硬、白色、富含纤维蛋白的血栓提供入口点;
最后一部分是一个封闭的篮状”结构,用来保留进入扩大的滴入区”开口的血栓该装置采用了 Drop Zone 技术,具有闭合的远端尖端和强大的扩张径向力。
有学者通过回顾性分析认为NeVa支架取栓的首次通过率和最终再通率均较高,且操作迅速、安全,无重大并发症发生,与传统的支架相比,该支架的回收设计可更有效地回收所有类型的血栓。
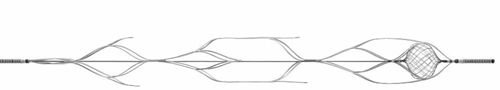
ERIC支架是由3~5个直径为3~6 mm之间相互连接的“球形笼”组成,最终的工作长度为15~44 mm。该装置的设计限制了与血管壁的接触点,可以潜在地减少血管创伤;与经典器械相比,不良事件的发生率相同。
四、血管解剖结构对支架结构设计的影响
以上取栓支架的具体结构和尺寸均有所不同,但均为“直筒形”设计,支架远、近端直径相同,而脑血管近、远端直径往往逐渐变小,故支架远端完全释放后其直径大于目标血管的直径。
反观脑血管其近、远端直径往往具有较大差异,如前循环动脉,从近端颈内动脉颅内段至远端大脑中动脉M2段为渐细的结构[颈动脉末端的直径为(3.6±0.4)mm.大脑中动脉近端起始部的直径为(3.1±0.4)mm,M2 起始部的直径为(2.4±0.4)mm)][32]。
均一直径的取栓支架置人血管后,由于远端血管直径较小,相当于较大直径的支架置人较小直径的血管中,故而远端血管承受的应力较大。
当拉动支架取出血栓时相当于在血管中拉动一个大直径支架,其产生的摩擦力和血管形变对血管损伤的可能性较大。
这一效应可能在弯曲的血管中得到放大,对血管的损伤更大脑血管多迂曲,且颅内、外段血管管径不一,支架取栓时不能与血管壁良好的贴合:还需指出的是,在干预过程中,由于迂曲血管使得支架轴向方向发生形变,容易影响疗效,并且还可能导致血栓碎裂,使其远端血栓脱落的风险增加。
此外,在国人AIS的病因谱中,颅内动脉粥样硬化狭窄(ICAD)的占比较高,文蘭报道可达 46.6%;而在西方国家发生ICAD的比例很低,现有的取栓支架是针对西方患者的血管解剖条件和疾病特点设计,并未考虑ICAD会加剧血管直径的不均匀程度,所以增大了取栓难度,导致国内取栓手术发生再通失败或再闭的概率较高。
来自亚洲人群的研究发现,合并ICAD的取栓手术面临着更加复杂的情况,发生再通失败或再闭塞的概率较高,这与潜在的血管内皮损伤密切相关。特别是我国卒中高发且卒中病因谱中ICAD也高发,使得取栓手术更加复杂和困难。
为了适应血管的解剖结构,学者们对神经介入器材进行了探索,设计了渐变直径的颈动脉支架,其远端直径为6mm,近端直径为8mm,更加贴合颈动脉起始处的解剖结构,通过有限元分析以更好地适应众多颈动脉分叉处病变的管腔形态。
目前已有针对颈动脉支架置人术的有限元分析研究,目前,“直筒形”设计的支架与脑血管近、远端直径逐渐变细的解剖结构不相符,取栓时容易损伤血管壁,且不易与血管壁很好的贴合。
因此,为了适应脑血管的解剖结构,使其更容易到达病变血管处,最大程度地减少对血管壁的损伤,从而提高手术的安全性,可考虑将支架的“直筒形”设计改进为适应血管结构的“锥形”设计,使其直径尺寸与血管直径差值较小,支架置人远端血管后展开的更充分。
内容来源:《机械取栓装置所致血管损伤及相关结构设计的研究进展》DOI:10.3760/cma.i. cn112050-20221125-00552

来源:Internet


