您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2025-03-29 10:21
摘 要
坚持“六统一”,控制中药材生产和质量的各种影响因素,规范中药材生产全过程,中药材全产业链质量可追溯,是中药材生产质量管理规范(GAP)的核心。本文通过对广东省中药材GAP 延伸检查情况进行统计与分析,聚焦延伸检查的内容与流程,探讨了中药材GAP 基地建设工作中的亮点、普遍存在的问题和需要重视的问题,并对中药材GAP 实施与基地建设工作提出了思考。中药材GAP 基地投入恰当合理、运作模式规范适用,中药材品质稳定可控、安全、有效,中药材产业才能可持续发展,进而加强中药全产业链质量管理,推动中药产业高质量发展,促进中医药传承创新发展。
Ensuring the "six unifications", controlling key factors affecting the production and quality of Chinese medicinal materials, standardizing the entire production process, and achieving full traceability across the supply chain are core principles of good agricultural practice (GAP) for traditional Chinese medicine (TCM). This paper presents an analysis of GAP extended inspections conducted in Guangdong Province, focusing on key inspection aspects and processes. It highlights best practices,common challenges, and critical issues in GAP base construction and offers recommendations for improvement. A wellstructured and appropriately invested GAP base, supported by a standardized operating model, is essential to ensuring stable,controllable, safe, and effective TCM quality. Strengthening GAP implementation and base development is crucial for sustainable industry growth, improving supply chain quality management, and promoting the high-quality development of the TCM industry.
关键词
中药材;生产质量管理规范;延伸检查;广东省;工作思考
Chinese crude drugs; good agricultural practice; extended inspection; Guangdong Province; work reflections
2021 年5 月,国家药监局印发《药品检查管理办法(试行)》;2022 年3 月,国家药监局、农业农村部、国家林草局、国家中医药局联合发布《中药材生产质量管理规范》(以下简称新版中药材GAP),并在公告中明确新版中药材GAP 的实施方式为延伸检查[1]。2023 年6 月国家药监局综合司印发了《〈中药材生产质量管理规范〉监督实施示范建设方案》,由安徽、广东、四川、甘肃省药品监管部门作为任务承担单位推进示范建设,以推进中药材GAP 有序实施,强化中药材质量控制,从源头提升中药质量,促进中药材产业规范化高质量发展。国家药监局食品药品审核查验中心于2023 年6 月发布了《中药材GAP 实施技术指导原则》《中药材GAP 检查指南》[2],中药材GAP 延伸检查是中药材GAP 实施成效的检查手段,其目的在于确保中药材从种植到采收、加工、储存等各环节的质量与安全,是中药产业健康、有序发展的重要保障与基础。
2023 年7 月广东省药监局印发《推进〈中药材生产质量管理规范〉监督实施示范建设工作实施细则》,对工作目标、重点任务、进度安排、任务分工、工作要求进行了详细部署。2023 年8月广东省药监局组建中药材GAP监督实施示范建设专家工作组,明确中药材GAP 专家包括从事中药材种子种苗研究、种植/ 养殖、采收加工、质量控制及品质评价和行政管理等领域的专业人员。
中药材GAP 延伸检查的实施涉及多个层面和环节,注重从源头上把控中药材质量。通常包括对企业申报材料的审查、现场检查、记录与文件检查、质量追溯体系检查等多个方面,从而对中药材生产企业的质量管理体系、生产环境、种植技术、采收加工等方面进行全面评估。现场检查主要关注中药材生产基地的环境条件、种植技术、采收加工等,以确保其符合GAP 的要求;文件审查侧重于查看企业的质量管理体系文件、操作规程、培训记录、内审与自检记录等,以验证企业质量管理体系的适用性与规范性;质量追溯体系则是确保中药材从种植源头到工业使用端的每一个环节都能得到有效监控和可追溯,从而保障中药材生产全环节的质量安全,同时对每批中药材的质量进行取样检测,进一步确认中药材的内在质量。本文通过对2023~2024 年广东省中药材GAP 延伸检查情况进行分析,总结了基地建设的成效与不足,并给出了工作思考及建议,以期为推进中药材规范化种植和产业高质量发展提供决策参考。
1. 检查实践与工作亮点
1.1 检查实践
广东省于2023 年8 月启动GAP 延伸检查工作,遴选出8 家企业重点中药材品种21 个(扣除不同企业的相同中药材品种数,实际涉及中药材品种为19 种),均为植物类中药材品种。8 家企业包括中药配方颗粒生产企业2家、中药注射剂生产企业2 家以及其他中成药生产企业4 家。当前,8 家企业21 个重点中药材品种已进行了GAP 延伸检查(流程见图1),企业对缺陷项目进行整改并提交整改报告。经专家评审,最后提交广东省药监局审评审批,8 家企业21 个品种均能达到GAP 要求[3-14]。
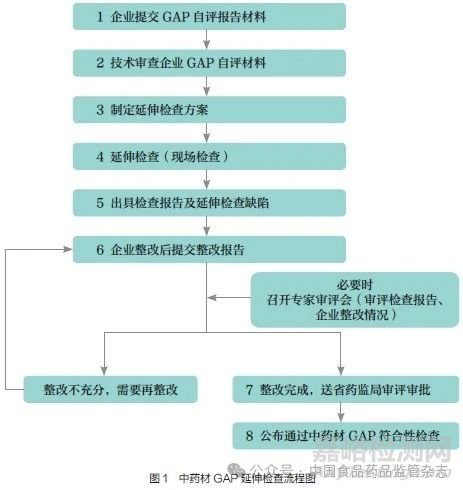
1.2 工作亮点
1.2.1 延伸检查机制创新
广东省药监局药品检查中心创新检查机制,充分发挥中药材GAP 专家在中药材良种、良田、良法、良采等农学领域的专业特长,探索性组建由中药材GAP专家、药品监管部门人员、药品检验机构人员等组成的中药材GAP 延伸检查组,实现中药材GAP 延伸检查全面覆盖各板块专业技术要点,全面检查被检查对象GAP 全环节实施情况。
1.2.2 中药材GAP 延伸检查准备工作充分、检查后整改积极到位
所有企业检查工作准备都很充分,配备了熟悉基地种植情况和质量管理的技术人员专门跟踪检查组的检查。部分企业的技术人员对中药材GAP 检查指南非常熟悉,检查文件资料按照检查章节进行整理,方便检查人员查阅,大大提高了工作效率,检查员可以及时准确地找到所需的文件、记录。对于检查组现场检查中发现的缺陷项目,大部分企业都能立即落实整改,部分企业不能立即整改、需要一定周期进行改进的,也都制定了切实可行的整改计划方案。
1.2.3 种质资源收集、种苗自繁技术、种植模式的探索
广东省云浮市的国家南药种苗繁育标准化示范区建立了三叉苦、广藿香种质资源圃,从广东、广西、云南等主产地收集了不同地区的三叉苦野生种质资源17份;从肇庆高要、四会,茂名化州、电白,阳江阳春,海南万宁等地收集到广藿香种质资源15 份。
三叉苦、九里香、岗梅、两面针相关企业摸索了种苗自繁技术,并申请了多个专利和团体标准;种苗选育方面,九里香选育品种“999华香01”“999 华香02”和岗梅选育品种“999 华岗01”已获得国家林草局植物新品种权授权;采用组织培养技术,实现了广藿香种苗的快速繁殖,并选择出优良植株,通过穴盘快繁技术进行批量化操作,提高了育苗效率,可规模化快速繁育优良一致的种苗。
金银花种植基地由原有的散户粗放式种植,逐步形成了“中药生产企业+ 中药材生产企业+产地加工”的优质原料供应链体系和以优质种苗繁育、规范化种植管理、集中采摘加工的核心示范基地为主,协同带动周边种植合作社、农户的基地生产模式,进一步保证药材质量,提升品种价值。
1.2.4 仓储新技术的研究与应用
以党参为例,利用气调养护技术长期保存对党参药材的质量稳定起到了良好作用。其做法是将待储存的党参包装后放置于多层共挤复合膜底套上,然后在待储存物表面放气调剂、干燥剂等;最后将复合膜热封,形成密闭空间。气调剂短时间内将密闭空间内氧气反应消除,基本达到无氧储存状态并长期维持稳定。气调养护技术的优点是可隔绝空气,长期维持低氧储存,储存过程不受环境湿度的影响,可防虫、防霉、抑制微生物生长、降低有效成分氧化分解速度;过程中使用的气调剂主要成分为亚铁离子,可与氧气反应,使氧气含量极低,无化学药剂残留,绿色环保。
但气调养护技术也存在一定的不足,比如应用时需提前将待储存物规则摆放,且不能有坚硬部位露出,否则储存期间会破坏复合膜,影响储存效果;另外,该技术的复合膜与气调剂均为一次性消耗品,成本较高。因此,各中药材企业需根据中药材的不同特性,自主探索适合本企业的仓储技术。
1.2.5 中药材野生转仿野生种植、野生转家种卓有成效
黄芪的野生转仿野生种植,岗梅、三叉苦的野生转家种,既降低了对野生中药材环境的破坏,也能保证中药材的质量。种植技术规程合理,可操作性强。符合GAP 种植的中药材“专供”下游中成药,可从源头上保证药品的质量安全。
1.2.6 文件体系完整,中药生产企业质量管理体系延伸到中药材产地
部分企业的GAP 管理体系完整、文件规范,中药生产企业与中药材生产企业管理衔接精准流畅,基地管理人员、工作人员等对GAP 要求掌握熟练,对种植基地的培训、监督落实到位。
2. 存在问题分析
《中药材GAP 检查指南》中的“第二节 检查要点”共有13 章,植物类药材检查要点共183 项[2]。检查结果的判定参照国家药监局发布的《药品生产现场检查风险评定指导原则》执行,缺陷分为“严重缺陷”“主要缺陷”和“一般缺陷”。
按照GAP 延伸检查要点,分析检查中发现的主要问题。本文列出了检查中缺陷项目出现频次较高的条款及对应的条款编号,分析问题产生的原因并尝试提出改进方法。
2.1 质量管理部分
大部分植物类中药材由于其自身的特点,需要扩展种植区域,进行轮种,以保证质量与产量,实现可持续发展。但是部分企业在进行种植前质量风险评估时,没有轮种研究及轮种方案,没有长期发展规划,没有提供种植品种本身环境适应性的相关文献材料(0201)。此外,部分企业的质量管理体系中,对种植基地生产单元未建立有效的监督管理机制(0203),对基地的巡查记录不完善(0204),不能确保对中药材生产基地关键环节进行现场指导和监督。种植周期中,不同年份种苗有自留种与外购种,种苗未做到完全统一(0205)。中药材生产质量追溯体系有待完善,对农业投入品(如肥料、农药)施用追溯内容不完善(0208),例如施用投入品的名称、批号等信息记录不全。
2.2 设施、设备与工具部分
部分企业自身的加工场地无法匹配基地产能,如采收时晒场面积不够(0401);临时晒场防鸟、防禽畜措施不足(0808);加工场所生产设备状态标识不完善,维护保养措施不足(0409)。GAP 要求配备必要的设施,包括但不限于种植或者养殖设施、产地加工设施、中药材贮存仓库、包装设施,要求有遮阳、防雨、防鼠、防尘、防虫、防禽畜措施。初加工是药用部位收获后至形成中药材的过程,是保证中药材质量的重要环节之一。绝大多数药材需要在产地进行初加工,目的是清除异物,将药材“杀青”、干燥,以便运输和贮藏。加工场地通常应就近设置,环境须宽敞、整洁、通风良好并配备相应设施、设备。
2.3 基地选址部分
部分中药材种植基地的空气质量情况无气象部门监测数据(0506);无土壤检验检测报告、无禁用农药调查情况报告(0507)。中药材生产基地的选择对药材质量具有关键性作用,药材生产需要在适宜的环境条件下进行,中药材种植应选择空气、水、土壤未受污染,农业生态环境质量良好的地区。企业应按照国家有关标准定期收集大气、水、土壤质量检测数据,并评估中药材种植的适宜性。有些药材在采挖的过程中容易出现水土流失等生态环境问题,企业应提高对保护生态环境的重视程度,并采取相应措施,实现生态种植。
2.4 种子种苗或其他繁殖材料部分
部分企业种子种苗管理规范性方面相对较弱。如基原报告不规范(0601),表现为:基原报告只有文字描述,无图片记录;无标本采集地点、标本份数等记录,或者记录的样本数量不规范(样本只有1 份,不具有重复性);鉴定植物特征完全按照《中国植物志》的描述,没有针对植物特征配以相应的图片进行描述鉴定,或鉴定依据是蜡叶标本而描述的特征在标本上根本没有;鉴定人未手写签名等。建议建立并使用统一的基原报告模板,包括基原植物性状特征(配照片),或蜡叶标本性状特征,复杂品种需要佐以显微鉴定等。企业购买的种苗无基原鉴定记录(0603);种苗标准过于简单,流于形式,可操作性不强, 或缺少种苗分级的具体标准, 如种苗苗龄、苗高、地径等, 不利于实际操作(0606);种子种苗检验报告不规范(0610)。良种繁育问题普遍不重视,未建立中药材种子种苗或其他繁殖材料的良种繁育规程(0607)。种子种苗产地不能做到明确、固定(0609),跨县域检疫证明不规范或缺失(0611)。
GAP 要求种子种苗等繁殖材料应制定检验及检疫制度,在生产、转运过程中进行检验及检疫并出具报告书,种子种苗是中药材生产最重要的生产资料,应严格按照《中华人民共和国种子法》等相关法规的要求制定相应的检验检疫制度并实施。
2.5 种植与养殖部分
投入品管理欠规范是较多企业出现的问题。不少企业使用自制有机肥,但未制定有机肥制作及使用技术规程(0702);较多企业未制定突发性病虫害等的防治预案(0704);没有对种植技术规程中的一些技术条件做探索性研究,以确定最佳种植模式(如播种、套种、轮种等方式)(0710)。企业对种植模式进行优化探索,有利于提高中药材种植的产量和质量,提高种植收益。部分企业在购置农药、肥料等农业投入品时缺少供应商资质和合格证、品牌、种类等信息(0712)。部分企业未按照技术规程使用农药,未开展针对性培训、指导和巡检(0718)。GAP 要求对从事中药材生产的有关人员进行定期培训与考核,企业应加强对各类人员的技术培训,不断提高规范化种植水平。建议根据不同层次的培训对象,制定科学合理的培训计划。培训内容应规范实用,辅以必要的考核,注重实效。种植基地的各级人员,包括管理人员、检验人员、技术人员、田间工作人员等,均应接受规定的培训。
2.6 采收与产地加工部分
采收期管理、加工设施与过程管控等方面存在易被企业忽视的问题。
采收环节:部分企业没有按照传统采收要求采收,但又没有现代研究数据来证明采收规程与对应标准要求不一致的合理性,未明确采收年限范围,未确定基于物候期的适宜采收时间并明确规定采收期(0801、0802)。此外,采收的具体操作(如采收时间、采收标准)与药品标准或者企业标准不完全一致也有培训不到位的原因(0309 )。
加工环节:人员健康管理、防鼠措施等是容易被忽略的方面(0311、0833);加工技术规程需要进一步完善(0801);中药材采收后未及时运输到加工场地,对药材采收后到进行初加工的过程未规定合理的时限(0820)。
2.7 文件部分
部分企业中药材生产过程记录不完整,没有按生产单元进行记录,没有覆盖生产过程的主要环节,必要照片或者图像等佐证资料不足, 可追溯性不强, 电子追溯系统终端可操作性不强(1009);中药材种植记录过于简单,未包括一些重要环节,如农药、肥料的施用时间、施用量和施用方法等(1010)。
GAP 要求每种中药材的生产全过程关键环节均应详细记录,必要时可附照片或图像。企业应该记录每批中药材在生产中各工序的情况,电子追溯系统应当易于现场终端操作。
2.8 质量检验部分
部分企业未能提供购买的种子种苗的检验记录, 未向供应商索取合格证或质量检验报告(1103);委托检验无委托检验合同(1104)。
2.9 小结
综合分析现场检查及企业反馈的问题,主要集中在以下10 个方面:①选址与生产未充分考虑生态环境保护。②中药材品种环境适生性、道地性论证不充分。③种植周期良种选育未得到充分重视。④基原鉴定报告不规范,科学性、严谨性不够。⑤对农药、化肥等农业投入品施用的统一化培训不充分。⑥购买种苗无基原鉴定记录,种苗标准过于简单,专属性要求不明确。⑦技术规程制定不够细化,可操作性不强。⑧中药材生产全过程记录不完善,可追溯性有待加强。⑨政策支持力度不够,对符合GAP 要求的中药材、中药饮片及中成药,在招标采购及其他市场活动中,尚不能充分体现“优质优先、优质优价”。⑩针对野生中药材GAP如何实施与认定,目前尚无明确的技术性指南。
3. 工作思考
3.1 确立中药材GAP 实施的正确路径与方向
各地药品监管、农业农村、林草、中医药管理等相关部门应形成合力,同时需加强培训与宣传,提高企业和社会公众对中药材GAP 的认识和理解。在推进中药材GAP 的实践过程中引入生态农业的理念与方法[15],发展中药生态农业,对落实国家中药农业发展各项部署、转变中药农业发展方式、加强农业生态治理等意义重大。中药材GAP 的实施要大力推广生态种植,促进生态保护与经济发展协调统一[16],要严格在生产基地选址和建设、农药使用、肥料使用、药材采收、药材初加工等方面把关,以实现中药材生产可持续发展。不能仅为了追求经济效益而破坏环境,只有中药材基地持续健康发展,才能保证中药材质量安全均一、供给稳定可控。
3.2 建立健全质量管理体系
中药材的质量受多种因素影响,如种植环境、采收时机、加工方法等,因此需要建立更加科学、系统的质量管理体系,以确保中药材质量的稳定性和可控性。必须提高企业的GAP 质量管理水平和意识,强化中药材生产企业的主体责任。企业应严格按照GAP 标准进行生产和管理,加强内部质量控制和风险管理,确保中药材的质量安全,建立健全质量管理体系[17-18]。
首先,作为生产主体,企业必须把工作重心放在生产的每一个环节上。企业应当配备足够数量并具有和岗位职责相对应资质的生产和质量管理人员。中药生产企业必须对建设的中药材GAP基地进行整体规划,明确基地建设的目标和措施,制定相应的制度、规程等,并形成文件体系加以确定,即“ 写我要做”。其次,企业一定要基于基地建设的实际情况,实事求是确定目标和措施,标准不能低于新版中药材GAP的要求,也不要制定难以达成的目标、提出后续无法做到的措施,一旦“写”下了要做的内容,后续就一定要实施,不能漏,不能少。企业应当按所“写”内容,包括目标和措施等,开展基地建设和生产。坚决实施所“写”内容,即“做我所写”。最后,重要环节必须重点把控,如农药、化肥的使用一定要有规范统一的培训,种植、采收与加工要根据技术标准来做,不能随意更改技术流程和标准。保证中药材生产、质量控制、质量保证等活动可控可追溯,按照实际情况记录关键环节的操作和数据,保证记录真实完整,记录所做过程的关键数据,即“记我所做”,使中药材种植、采收、加工、储运全环节可追溯。
3.3 良种选育,构建“四良体系”
2002 年发布的《中药材生产质量管理规范(试行)》就指出药材种子种苗是最薄弱的环节,进行种质资源优化是最为重要的工作之一。栽培技术不成熟导致的中药材GAP 规模生产风险较大[19-20]。在GAP 延伸检查中发现,种子种苗问题目前仍是药材生产过程中最容易忽视的问题。“六统一”中种子种苗的统一是根本,多数企业对于种子种苗的繁育重视程度不够。优质的种子种苗是优质药材的前提条件,品种不够优良,产量不高,药材品质不够好,投入与产出就无法符合经济效益模式。此外,选址不当(环境污染、环境破坏等),气候环境不适宜(GAP 要求有种植史、一般应当选址于道地产区,在非道地产区选址应当提供充分文献或者科学依据证明其适宜性),以及种植、采收及加工方法不当等,也会影响产量和质量。
为了企业中药材种植与收获长期稳定、优质,本文拟制了中药材生产“四良体系”(良种、良田、良法、良采)模式以供参考,如图2 所示。坚持“四良体系”,更具体地落实中药材GAP 基地各项工作,基地建设才能进入良性循环,持续生产出优质的中药材。在药材种植过程中,中药企业的关注点侧重于药材的质量,而种植户和中药材生产企业则侧重于产量。建议相关企业建立相应的中药基原植物种质资源圃及良种繁育基地,开展区域栽培试验、品种选育等研究,选育出优质高产、抗逆性强的优势品种。
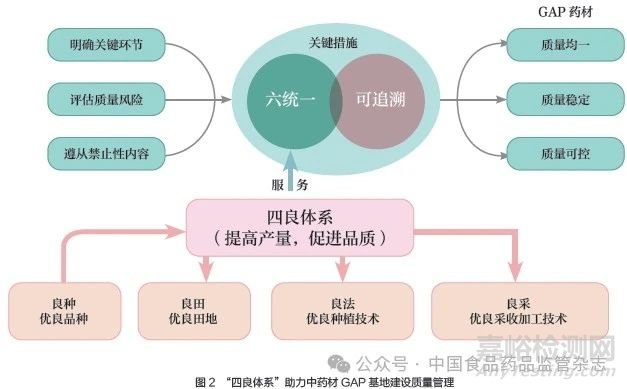
3.4 部门协同,政策支持
中药材GAP 延伸检查涉及多个部门和环节,应加强各监管部门之间的协作与配合,形成中药材质量监管合力。不管是进行GAP 基地的建设,还是对于日常推行GAP 的维护,均需要花费大量的人力、物力、财力,且投资大、周期长,按照GAP 标准种植出来的中药材,在生产种植成本上高于一般中药材,但目前没有相关政策措施保障符合GAP 标准的中药材及人工制成品在招标采购中“优质优先、优质优价”,建议相关部门结合实际情况,制定相应正面激励措施并加强组织实施。此外,当企业遇到技术难题时可予以技术指导或服务。例如,广东的企业科技特派员制度有助于企业获得更科学的种植、采收加工等技术指导;广东省药监局于2019 年开展的“中药饮片全产业链质量标准体系构建”(编号2019KT1261)课题研究,加强了产学研合作,帮助了中药相关企业中药饮片全产业链质量标准体系的构建;广东省的“百县千镇万村高质量发展工程”等相关政策措施,可以有效促进GAP 工作的实施与开展。医保部门、集采平台对于通过GAP 延伸检查、有 GAP 标识的相关品种,可以给予“优质优先、优质优价”激励措施;鼓励GAP 实施主体申报农业补贴和相关优惠政策;行政服务方面(相关社会服务职责履行到位),如农业农村部门的跨县域种子种苗检疫,科技部门可出台政策支持GAP 基地建设主体的良种繁育课题、种植技术优化课题;优化技术服务,如广东省科技厅、广东省农业农村厅、广东省教育厅均出台政策和服务项目支持“百县千镇万村高质量发展工程”“岭南中草药种质资源库建设”“广东南药种植技术服务中心的建设”等项目。
GAP 的实施要坚持产学研结合,强化科技支撑引领作用,加强中药材种植关键技术的研究,提高中药材种植水平,做到在优质基础上高产,在高产基础上优质。建议由各地科技部门和农业农村部门牵头,药品监管、经贸等部门参与,组织有关专家对中药种质资源与良种选育、种植区划与分区布局[21] 等进行深入研究及科学评价。只有在中药材的种植、采收、加工、储存等环节严把质量关,才能保证中药材的质量稳定、可靠。
3.5 细化缺陷风险评级
根据《中药材GAP 检查指南》,检查结果的判定参照《药品生产现场检查风险评定指导原则》执行,主要是工业生产环节的风险等级评定,尚不能完全契合中药材生产实际,尤其是在种子种苗、种植技术与管理等方面,风险评级还需要结合GAP 延伸检查特点进一步改进和细化。
3.6 提升检查能力
《国家药监局 农业农村部 国家林草局 国家中医药局关于发布〈中药材生产质量管理规范〉的公告》中第一次明确“省级药品监督管理部门……必要时对相应的中药材生产企业开展延伸检查”。根据《〈中药材生产质量管理规范〉监督实施示范建设方案》,广东省承担中药材GAP 示范建设任务,需按要求建立和培训一支符合中药材GAP 检查特点的检查员队伍,以确保高效完成示范建设工作以及之后的各项检查任务。目前,广东省已组建由中药材GAP专家、药品监管部门人员、药品检验机构人员等组成的检查队伍,基本覆盖检查需要的各个专业板块。但因中药材GAP 延伸检查仍处在探索阶段,检查组的专业技术能力与现场检查能力仍有待进一步提升。
4. 总结
广东省以承担国家药监局监督实施示范建设为契机,聚焦本省实际,通过统筹监管和服务,优化完善延伸检查模式,以中药生产企业将质量管理体系延伸到中药材生产基地为着力点,强化岭南特色中药材GAP 示范建设与创新发展为突破点, 推动以产地政府为主导的广东省中药材GAP 监督实施重点区域建设,引导中药生产企业使用符合GAP的中药材,促进中药全产业链质量管理与追溯体系构建。2023 年以来共完成8 家中药生产企业申报的中药材GAP 符合性延伸检查,共涉及41 个药品品种、21个中药材品种,派出检査员71 名(含国家药监局中药材GAP 专家3 名、广东省药监局中药材GAP专家13 名)。
实施GAP 的根本目的在于提高中药材的生产质量,保证中药饮片和中成药的质量,确保公众用药安全有效。实施GAP 的基本要求就是中药材生产必须坚持科学化、规范化、规模化,以保证中药材质量稳定可控、资源合理利用和可持续。中药材GAP实施的优劣,取决于对相关文件贯彻执行的程度,特别是生产基地建设和生产技术及质量管理是否到位。实施主体应针对薄弱环节, 根据中药材GAP 的要求,有的放矢地加强软件管理,强化人员培训,改进硬件设施,强化质量管理体系建设。通过以上措施,推进中药材规范化生产,加强中药材质量控制,促进中药产业高质量发展。
引用本文
徐贻权,莫结丽,严振,曾祥卫,欧阳蒲月*,赖盼,郑聪敏.中药材生产质量管理规范延伸检查的实践与思考[J].中国食品药品监管.2025.2(253):118-127.

来源:中国食品药品监管杂志


