您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2018-09-06 09:38
内容提要:MDSAP 是IMDRF 的工作项目之一,旨在协调统一各监管机构的医疗器械检查程序和标准,最终实现国际检查结果的互认,以更好地发挥监管资源的作用。文章对MDSAP 项目进行介绍,重点对IMDRF 已发布的9 个文件进行说明,为我国借鉴和转化其成果提供参考。
国际医疗器械监管机构论坛(International Medical Device Regulators Forum,IMDRF)是2011 年11 月在原全球医疗器械法规协调组织(Global Harmonization Target Force on Medical Devices,GHTF)基础上成立的自愿性国际协调组织。GHTF成立于1992 年,由来自美国、欧盟、日本、加拿大和澳大利亚等国家或地区的医疗器械监管部门、行业协会和业界代表参加,宗旨是交流各国医疗器械监督管理情况,对有关法规和技术标准进行研讨,以达成各国都能接受的基本协议,简化医疗器械贸易中不必要的障碍。通过制定经过协调的指导文件,给各国监管机构提供医疗器械监管的参考性指南[1]。近20 年来,GHTF在医疗器械法规和技术标准的国际协调方面作了大量的工作,为各个国家医疗器械监管体系发展间的交流提供参考和借鉴。
然而,承担着政府公共服务职能的各国医疗器械监管部门,必须以保障公共利益为天职,正确处理公共利益与商业利益,依法监管与产业发展的关系,在制订和实施监管法规时,必须防范各种利益集团以各种形式施加的不当影响和干预。
2011 年11 月,由原GHTF 6个成员国(美、欧、加、日、澳、巴)监管机构发起的IMDRF应运而生。该论坛的使命是从战略层面上加速国际医疗器械监管的统一协调、 促进高效的医疗器械监管模式的建立,以应对新的挑战并最大限度保护公众的健康和安全。我国国家食品药品监督管理总局于2013年3月经国务院同意正式加入了该组织。该组织目前已包括中国、美国、欧盟、加拿大、日本、澳大利亚、巴西、俄罗斯、新加坡等9 个成员国的监管机构。
01 MDSAP项目介绍
医疗器械单一检查项目(Medical Device Single Audit Program,MDSAP)是IMDRF设置的优先工作项目之一。该项目旨在最终实现各监管机构的单一检查程序,以有利于各成员国监管机构更好的发挥监管资源的作用,减少因多重法规检查对医疗器械生产带来的干扰,最终有利于患者健康和患者对医疗器械的使用。通过MDSAP项目的实施,可有效推动各国法规、审核标准的统一及检查成果的互认和共享,有助于建立保护患者安全用械的全球性体系,同时减轻了各国监管机构和生产企业的负担。
MDSAP项目由MDSAP工作组负责,该工作组成立于2013 年。工作组负责人来自美国FDA,工作组成员包括来自美国、日本、欧盟和中国的专家(本文通讯作者即为工作组成员之一)。作为启动单一检查程序的的第一步,也是关键的一部,就是制订一整套标准的检查机构开展医疗器械质量管理体系和法规的检查要求,提供一套监管机构对检查机构认可和监管的标准,以鼓励和支持全球监管法规体系的整合。自IMDRF第三次会议以来,MDSAP工作组已起草了9个文件,均已获得IMDRF管理委员会通过并正式发布。目前MDSAP项目已经过FDA组织的自愿参加方的3 年试点,在IMDRF的成员国,包括美国、加拿大、日本、澳大利亚、巴西等国正式实施。
02 MDSAP相关文件介绍
2.1 对接受监管机构认可的医疗器械检查机构的要求(IMDRF/MDSAP WG N3)[2]
该文件的目的是规定对实施法规检查及其他相关职能的医疗器械检查机构的标准要求。文件规定了对检查机构法规和合约、公平性管理及责任和财务的一般要求,同时对医疗器械检查机构的结构要求、资源要求、信息要求、过程要求、管理体系要求及检查机构认可的撤销进行了具体规定。
2.2 对医疗器械检查机构能力与培训的要求(IMDRF/MDSAP WG N4)[3]
该文件是对从事医疗器械法规检查的检查员及相关人员的能力和培训要求,主要包括承诺、入门级要求、培训要求、经验要求、能力评价、记录和整改等。通过保证检查机构人员在承担检查或作出职责决定前具备必要的条件,以减少对生产企业评价上的不一致性和无效性的风险。人员按类别分为检查组长(Lead Auditor)、检查员(Auditor)、终审员(Final Reviewer)、技术专家(Technical Expert)、项目管理人(Program Administer)进行管理,不同人员职责不同,入门要求、培训要求、能力、经验要求也不同。N3与N4是两个互为补充的文件,这两个文件主要关注在法规体系下,按有关医疗器械法律、法规和程序实施法规检查和相关职能检查机构及人员的要求。
2.3 监管机构对医疗器械检查机构认可和监管的评估方法(IMDRF/MDSAP WG N5)[4]
该文件是对N3和N4两个文件的补充,主要解决监管机构如何对检查机构按照认可标准进行评估的问题。目的是阐述医疗器械监管机构按照IMDRF的框架实施对检查机构的评估项目和评估方法。主要内容包括评估周期和项目、评估方法。对检查机构的过程评估包括管理、外援、测量、分析与改进、能力管理、检查与决策、信息管理等环节。
2.4 对监管机构评估员能力和培训的要求(IMDRF/MDSAPWG N6)[5]
该文件适用于开展医疗器械检查机构评估的监管机构,按照IMDRF认可标准对开展评估的人员和作决定人员的能力要求。内容包括:职责、承诺、入门要求、培训要求、经验要求、能力评价和记录等。 N5与N6互为补充文件,二者主要关注监管机构及其评估员如何去评估医疗器械检查机构对N3和N4两个文件要求的符合性。
2.5 监管机构对检查机构过程评估方法指南(IMDRF/MDSAP WG N8)[6]
该文件是对监管机构的评估员如何按照N5文件的第6部分开展检查机构基于过程的评估提供的指南性文件。主要包括对管理过程、利用外部资源过程、测量分析和改进过程、能力管理过程、信息管理过程相关的指南。
2.6 MDSAP 认可医疗器械检查机构的评估与决定程序(IMDRF/MDSAP WG N11)[7]
本文件阐述了评估程序和结果,包括监管机构对检查机构评估过程发现的不符合项的“评级和管理”的方法,以及对检查机构认可或撤回认可决定程序的记录方法。 主要内容包括评估和决定程序(评估、技术审查、审核决定、通知和公告、申述),评估标准和不符合项分级,评估决定的类型等。
2.7 医疗器械法规检查报告(IMDRF/MDSAP WG N24)[8]
该文件是对检查机构向监管机构提交的MDSAP医疗器械检查报告的格式和内容的说明,相当于检查报告的模板。检查报告作为检查组确定对特定要求符合程度的书面记录,也可用于阐明所认定检查机构评估方案的适用性。统一检查报告模板有利于检查机构为MDSAP项目获得一致的企业提供合规性证据,同时方便各监管机构间信息的交流。 该文件内容包括报告用语言、检查报告内容两大块,其中检查报告内容对生产企业信息、检查相关信息、检查依据、检查总结、发现的不合格项、其他内容、结论、作者信息和日期等进行了详细阐述。
2.8 检查机构认证与评估相关程序流程图(IMDRF/MDSAPWG N22)[9]
该文件对检查机构的认证与评估程序用流程图的形式进行了梳理( 见图1)。
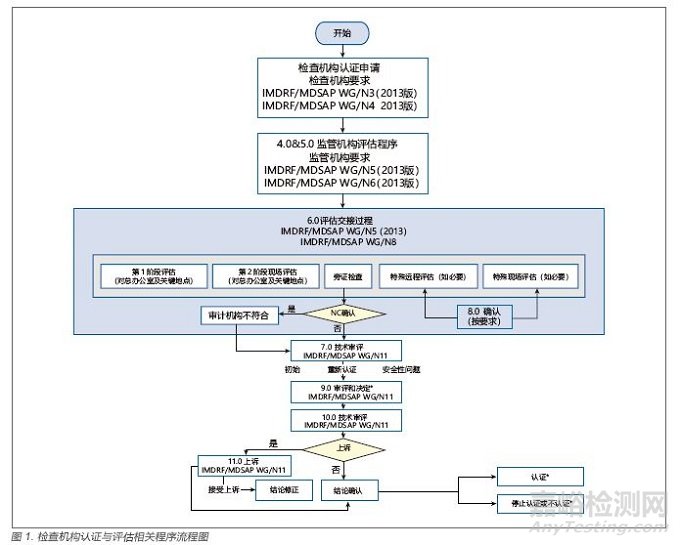
最终决定只能是以下几种:初步认证(给定范围)、维持认证、认证范围扩大或缩小、重认证(保持原范围、范围扩大或缩小)、停止认证、不认证。
2.9 关于MDSAP 认证中“法定实体”一词的说明(IMDRF/MDSAP WG N29)[10]
按照IMDRF/MDSAP WG/N11的规定,申请成为检查机构的申请人视为“法定实体”(legal entity)。该文件对申请人的职责进行了更深层次的明确要求,要求申请人必须有清晰明确的法定实体界限与具体的地址,并聘请人员负责对MDSAP认证计划进行管理,该管理人员必须遵守IMDRF/MDSAP WG/N3中第7.1.3 部分的规定,同时对与医疗器械制造商签订合同、明确内部外部检查员或技术专家执行具体活动的能力要求及按照法规要求进行最终审核和决策直接负责、管理和保留管理权限。
03 MDSAP试点项目及实施
MDSAP试点项目(MDSAP Pilot Program)自2014 年1月1 日起开始试点,试点成员国为美国、日本、加拿大、巴西、澳大利亚。经过3 年的实施,自2017 年1 月开始在这5 国正式实施MDSAP项目。参与MDSAP项目的各国监管机构对检查机构进行评估,认可后授权其对生产企业开展MDSAP检查,对通过检查的生产企业,检查机构对其发放MDSAP证书并将检查报告和证书与各国监管机构分享,生产企业向监管机构提交相应的报告和证书,各国监管机构将根据我国法律批准的流程和政策决定是否采用报告中的相关内容。
04 对我国监管机构的启示
4.1 检查结果互认,企业负担减轻
MDSAP由第三方进行检查,参与实施的监管机构认可MDSAP检查结果,生产企业可以减少应对不同监管机构的检查次数,减轻了负担。 MDSAP的出台,使审核过程国际标准化。
4.2 检查结果共享,监管机构资源利用更加合理
参与国的医疗器械监管部门共享检查结果,可以将检查报告作为判断依据。美国FDA接受MDSAP的检查代替FDA的例行检查,每两年对所有类别的医疗器械,包括体外诊断设备进行MDSAP检查。这使各监管机构减少了例行检查工作的工作量,使监管资源的利用更加合理。
4.3 检查程序标准化,产品质量保证全球性
通过生产企业的不断参与,MDSAP项目将会逐渐完善,预计将于2017年正式运行。MDSAP将会提升第三方机构的公信力,推动各国法规及审核标准的统一,扩展针对患者保护的全球安全网络。

来源:药监局审核查验中心


