您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-06-04 16:26
导读
本文详细介绍了仿制药注射剂稳定性试验方案的设计依据,试验样品、放样方案、记录模板,数据评价等细节。
参照“原料药物与制剂稳定性试验指导原则”(中国药典2015年版四部通则9001)、“化学药物(原料药和制剂)稳定性研究技术指导原则”(国家食品药品监督管理局药品审评中心颁布)、“新原料药和制剂的稳定性试验”(ICH Q1),注射剂稳定性研究内容包括影响因素试验、加速试验和长期试验,必要时应进行中间条件试验考察;对低温下可能不稳定的注射剂建议进行温度循环试验(低温试验和冻融试验);对于包装在半透性容器中的注射剂建议进行失水率试验。
1、试验样品
采用1批中试样品和1批原研制剂进行影响因素考察,采用3批中试样品和1批原研制剂进行了加速试验(中间条件试验)和长期试验考察,对低温下可能不稳定的采用1批中试样品进行低温试验和冻融试验,对于包装在半透性容器中的采用3批中试样品进行失水率试验。
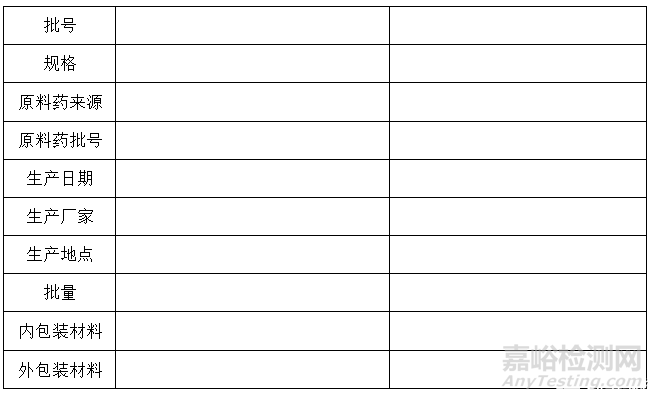
试验用样品基本信息表如下:
试验用样品基本信息
2、稳定性考察项目
0天:性状、装量、装量差异、含量、pH值、可见异物、渗透压摩尔浓度、不溶性微粒、有关物质、无菌、细菌内毒素(或热原)
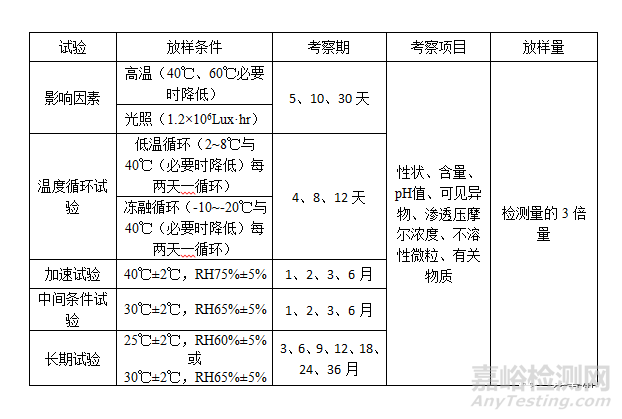
3、稳定性放样方案
a.包装在非渗透容器中的制剂
注:长期6月、12月、24月应检查无菌、细菌内毒素(或热原)
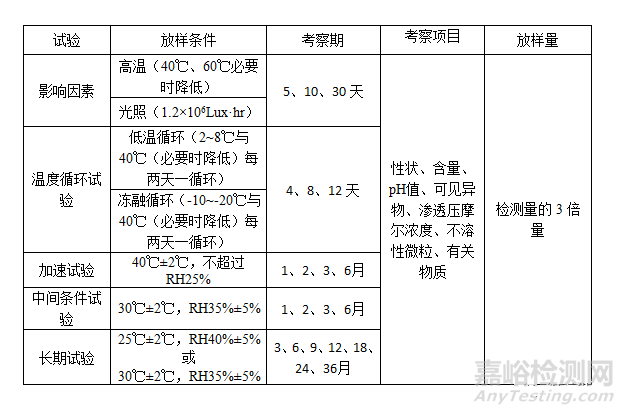
b. 包装在半渗透容器中的制剂
注:加速试验和长期试验应检查失水率,长期6月、12月、24月应检查无菌、细菌内毒素(或热原)
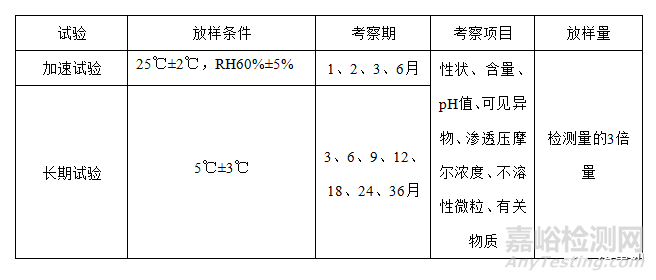
c.拟冷藏的制剂
注:长期6月、12月、24月应检查无菌、细菌内毒素(或热原)
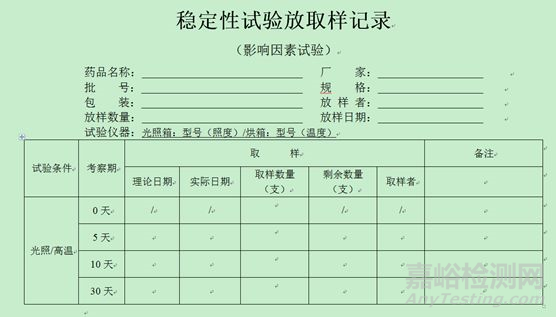
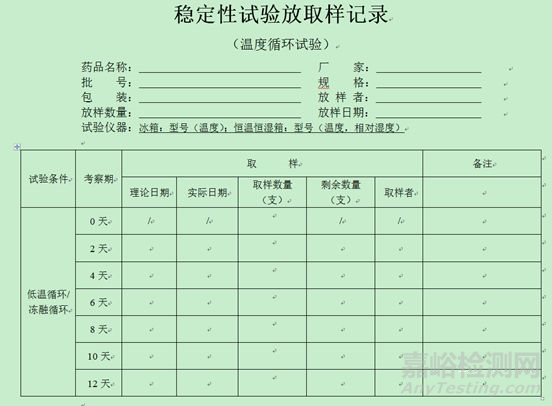
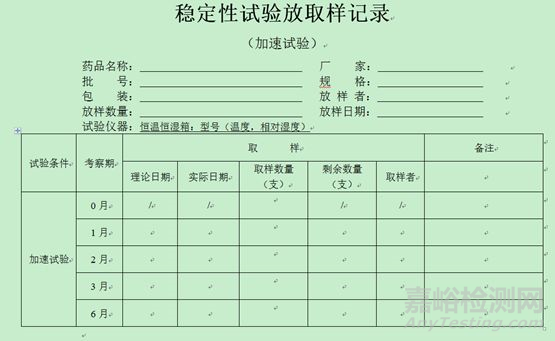
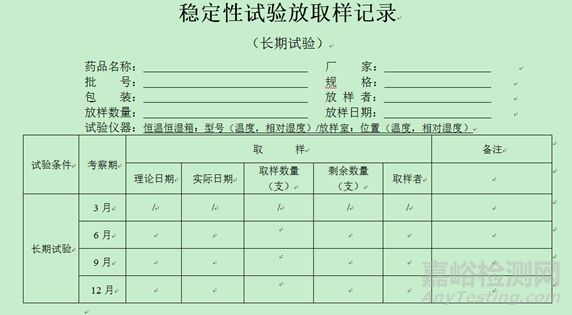
4、稳定性放取样记录模板(仅供参考,考虑品种情况自定)
5、稳定性数据评价
原研制剂最好另外检测一批近效期末的进行检测,与中试样品试验结果对比,证明中试样品在加速试验条件或者影响因素试验条件下优于原研近效期末的样品。
稳定性研究的目的是根据至少三批制剂及一批原研的测定对比结果,确定将来所有在相似条件下生产和包装的制剂的货架期和标签上的贮藏条件。批次间变异的程度有可能产生产品质量的差异,但产品在货架期内应符合质量标准的要求。
任何评价不仅要考虑含量,还要考虑降解产物和其他有关的性能指标。如有必要,应注意考察质量平衡情况和不同的稳定性及降解特性。仿制药的稳定性应不低于原研参比制剂。

来源:药事纵横


