您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-04 09:12
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
我国首个原创阿尔茨海默症新药获有条件批准上市。11月2日,国家药监局有条件批准上海绿谷制药甘露特钠胶囊(GV-971,九期一)上市,用于轻中度阿尔茨海默病(AD)改善患者认知功能,这也是首个中国原创、全球首个糖类多靶抗阿尔兹海默病创新药物。一项III期临床结果显示,GV-971能明显改善AD患者认知功能障碍,与安慰剂组相比,认知功能量表(ADAS-Cog)平均改善值为2.54,具统计学意义。绿谷制药表示其已做好生产、销售的各项准备,药品年内投放市场。同时,绿谷将启动GV-971上市后研究和真实世界研究,并正在积极推进国际多中心临床研究项目。
国内药讯
1.信立泰左乙拉西坦片通过一致性评价。信立泰左乙拉西坦片(0.25g)通过一致性评价并获药品补充批件。左乙拉西坦是一种具有全新抗癫痫作用机制的新型抗癫痫药物,用于成人及4岁以上儿童癫痫患者部分性发作(伴或不伴继发性全面性发作)的治疗,成人及16岁以上青少年癫痫患者全面性强直阵挛发作的加用治疗。该药原研药由比利时UCB公司研制。目前左乙拉西坦片(0.25g)已通过一致性评价的企业还有浙江京新、浙江普洛康裕。2017年左乙拉西坦在全国公立医院销售额为8.42亿元。
2.中外制药A型血友病新药Hemlibra在台湾获批。日本药企中外制药开发的双特异性单抗Hemlibra(emicizumab)在台湾获批上市, 该药可每周、每2周、每4周皮下注射一次,用于体内未产生凝血因子VIII抑制剂的A型血友病患者,预防出血发作。此外,台湾药监部门还批准Hemlibra每2周、每4周一次给药方案,用于体内已产生凝血因子VIII抑制剂的A型血友病患者。目前Hemlibra由中外制药、罗氏及旗下基因泰克合作开发。2017年11月,Hemlibra已获FDA批准,作为一种常规预防性药物,用于体内已产生凝血因子VIII抑制剂的A型血友病成人及儿童患者,预防或降低出血事件发生频率。
3.翰宇药业利拉鲁肽申报生产。翰宇药业利拉鲁肽注射液申报生产的药品注册申请获国家药监局受理。利拉鲁肽是一种人胰高糖素样肽-1(GLP-1)类似物。该药原研药由诺和诺德研制,最早于2009年7月在欧盟获批上市,目前已在美国、日本等几十个国家获批上市,获批适应症包括2型糖尿病、肥胖症等。该品种原研药2011年3月获批进口中国,国内目前仅有原研产品获批上市。2018年利拉鲁肽全球销售额为282.02亿丹麦克朗,在中国公立医疗机构终端的销售额接近5亿元人民币。
4.复宏汉霖曲妥珠单抗乳腺癌III期临床达主要终点。复宏汉霖注射用曲妥珠单抗(生物类似药,注射用重组抗HER2人源化单克隆抗体)治疗转移性乳腺癌的III期临床达到预设的主要终点。该研究评估该新药与原研药赫赛汀的疗效与安全性,结果显示,该新药在治疗复发或既往未经治疗的HER2阳性转移性乳腺癌的疗效与原研药等效,其治疗一年的安全性、免疫原性结果与原研药相似。最终结果及临床试验报告尚待完成。目前,于中国境内上市的曲妥珠单抗为罗氏的赫赛汀。2018年度,赫赛汀的中国销售额约为人民币27.3亿元。
5.恒瑞马来酸茚达特罗获批临床。恒瑞的马来酸茚达特罗吸入粉雾剂获国家药监局临床试验默示许可,该品种此前已完成了人体生物等效性试验。马来酸茚达特罗吸入粉雾剂为支气管舒张剂,该药原研药由诺华开发,最早于2009年11月获欧盟EMA批准上市,2011年7月,分别美国和日本获批上市;2012年6月获批进口中国。目前国内仅诺华生产的马来酸茚达特罗吸入粉雾剂获批进口,规格为150μg。2015年,正大天晴和恒瑞两家企业曾提交该品种的6类注册申请,但最终均获批临床。
6.百济神州与安进达成合作协议。百济神州与安进达成全球肿瘤战略合作协议。根据协议,双方就安进的安加维 (XGEVA )地舒单抗注射液、KYPROLIS 注射用卡非佐米以及BLINCYTO 注射用倍林妥莫双抗在中国的商业化开展合作;双方将共同开发20款安进抗肿瘤管线药物,由百济神州负责在中国的开发和商业化以作为其全球开发计划的一部分;安进将购入价值约27亿美元的百济神州股份;20款在研药物中,百济神州将有权获得除了KRAS G12C抑制剂AMG 510之外的产品在中国以外的全球销售的特许权使用费。至2020年底,百济神州在肿瘤领域的商业化产品有望拓展至8款,包括自主研发及授权引入的产品。
国际药讯
1.诺和诺德胰岛素注射液标签扩展获FDA批准。诺和诺德门冬胰岛素注射液Fiasp 100u/mL标签扩展获FDA批准,允许该药物通过胰岛素泵给药,以改善1型和2型成人糖尿病患者的血糖控制情况。Fiasp是一种速效胰岛素注射剂,于2017年获FDA批准上市。目前,患者可遵循医嘱,通过胰岛素泵进行静脉或皮下注射。一项临床试验ONSET 5结果表明,通过胰岛素泵给药的Fiasp具有较高的安全性和有效性。Fiasp可通过胰岛素泵稳定释放,且患者在药物剂量方面表现出良好的耐受性。Fiasp是唯一一款无餐前给药建议的速效胰岛素注射液。
2.艾伯维JAK1抑制剂治疗银屑病关节炎达Ⅲ期终点。艾伯维公司JAK1特异性抑制剂Rinvoq(upadacitinib),在治疗活跃性银屑病关节炎的Ⅲ期临床SELECT-PsA 2中,达主要终点和主要次要终点。接受两种不同剂量Rinvoq(15 mg或30 mg)12周的治疗后,患者达到ACR20的比例分别为57%和64%,而安慰剂组这一数值为24%;治疗组中达到ACR50的患者比例为32%和38%,而安慰剂组为5%;治疗组中达到ACR70的患者比例为9%和17%,安慰剂组为0.5%。此外,Rinvoq还达到其它多个次要终点。Rinvoq此前已获FDA批准用于治疗中重度活动性风湿性关节炎(active RA)成年患者。
3.Pinteon神经退行性疾病靶向疗法进入临床。Pinteon公司宣布,推进其靶向具有神经毒性的tau蛋白构象cis-pT231-tau的新型抗体PNT001进入临床开发阶段,用于治疗阿尔茨海默病,进行性核上性麻痹,以及中度创伤性脑损伤等神经退行性疾病。cis-pT231-tau是一种神经毒性构象,它已在临床前研究中被证实是引发神经退行性疾病的主要驱动因素之一。PNT001通过精确靶向和中和携带cis-pT231的tau蛋白来阻断毒性tau蛋白的扩散,进而达到保护大脑正常运作,治疗神经退行性疾病的目的。
4.罗氏与Dicerna公司达成研发合作与许可协议。生物技术公司Dicerna与罗氏就拟用于治疗慢性乙肝病毒(HBV)感染的在研RNAi疗法DCR-HBVS达成研发合作与许可协议。Dierna公司开发的DCR-HBVS能够使用一种RNAi序列,特异性敲低与HBV mRNA生成和HBV进入肝细胞相关的多个基因。在临床前动物试验中,该疗法将动物体内的乙肝表面抗原(HBsAg)水平降低超过3.9个指数水平。根据协议,罗氏将获DCR-HBVS的全球独家研发和推广许可。Dicerna将获2亿美元前期付款,可高达14.7亿美元的里程碑付款以及产品销售额分成。Dicerna拥有共同开发DCR-HBVS的选择权。此外,双方将合作开发靶向与HBV感染相关的多个人类和病毒基因靶点。
5.安斯泰来与Pandion合作开发双特性异抗体。Pandion Therapeutics和安斯泰来将合作开发用于治疗1型糖尿病和其它胰腺等免疫性疾病的新型特异性免疫调节剂。Pandion专有的模块化平台能够将免疫调节剂与靶向特定组织的连接子相结合,开发出具精准治疗作用的模块化蛋白质,抗体和双特异性抗体。根据协议,Pandion将负责开发双特异性抗体候选药物,安斯泰来则负责候选药物的开发和商业化;Pandion将获4500万美元的预付款,如果安斯泰来在未来开发并商业化多款候选药物,那么Pandion将有权获得超过7.5亿美元的里程碑付款以及产品销售额分成。
6.GSK Q3业绩出炉。GSK公布2019年前3季度业绩报告,营业收入248.55亿英镑,按固定汇率计算同比增长7%。其中第3季度营业收入93.85亿英镑,同比增长11%;制药业务收入45.31亿英镑,同比增长3%;疫苗业务收入23.08亿英镑,同比增长15%;消费保健业务收入25.26亿英镑,同比增长25%。Q3季报中,带状疱疹疫苗Shingrix前三季度大卖12.78亿英镑,销量增长主要受到美国地区的驱动。带状疱疹疫苗Shingrix已于2019年5月在中国获批,GSK计划于2020年在中国推出该产品。
医药热点
1.《Cell》重磅:北京大学张泽民课题组与BI联合发表研究论文。北京大学张泽民课题组、首都医科大学附属北京世纪坛医院彭吉润课题组以及勃林格殷格翰的多位科学家,在国际期刊Cell上发表了题为Landscape and Dynamics of Single Immune Cells in Hepatocellular Carcinoma(单细胞测序刻画肝癌免疫图谱与动态变化的研究)的研究论文,结合10x Genomics和SMART-seq2单细胞RNA测序技术,对肝癌患者多个组织的免疫细胞做出了系统性的刻画,分析了免疫细胞动态迁移和状态转化的特征,描绘了肿瘤浸润免疫细胞跨组织的动态过程,探索了它们在肝癌治疗上的潜在价值。
2.上海37家医院检验互通互认。从11月1日起,上海37家市级医院之间实现部分医学检验项目、医学影像检查项目和影像资料的互联互通互认。据了解,为了确保医疗质量与安全,上海首先在市级公立医疗机构间对规定的35项医学检验和9项医学影像检查项目实现互联互通互认,并将逐步向区级公立医疗机构扩展,最终实现市、区两级公立医疗机构间的互联互通互认。凡属于互认项目且检验检查质量达到要求的,其检验检查结果在医疗机构间均具有相同的有效性。
3.风湿免疫科建设新标准。国家卫健委发布《综合医院风湿免疫科建设与管理指南(试行)》和《综合医院风湿免疫科基本标准指引(试行)》。《指南》要求,三级综合医院原则上应设立独立的风湿免疫科。三级综合医院风湿免疫科开放床位不少于10张,至少有3名医师。每增加10张床位,至少应增加1名具有风湿免疫专业中级专业技术职务任职资格的医师。每张风湿免疫科病床应当至少配备0.4名护士。医院应具有独立的检验科、放射科、眼科、口腔科及病理科,支持风湿免疫疾病的相应检查。
股市资讯
.
上个交易日 A 股医药板块 +1.84%
涨幅前三 跌幅前三
东诚药业 +10.02% 康芝药业 -7.02%
浙江医药 +10.02% 中牧股份 -5.95%
丽珠集团 +8.22% 瑞普生物 -4.40%
【康弘药业】盐酸文拉法辛缓释片获得药品补充申请批件。
【恒瑞医药】董事及高级管理人员周云曙、袁开红、孙杰平、刘笑含计划在2019年11月25日至2020年5月22日期间减持合计不超过66.48万股(总股本0.0150%)。
【大理药业】自2019年7月12日至本公告披露之日,累计收到与收益相关的政府补助共计270.10万元,超过公司最近一个会计年度经审计净利润的10%。
审评动向
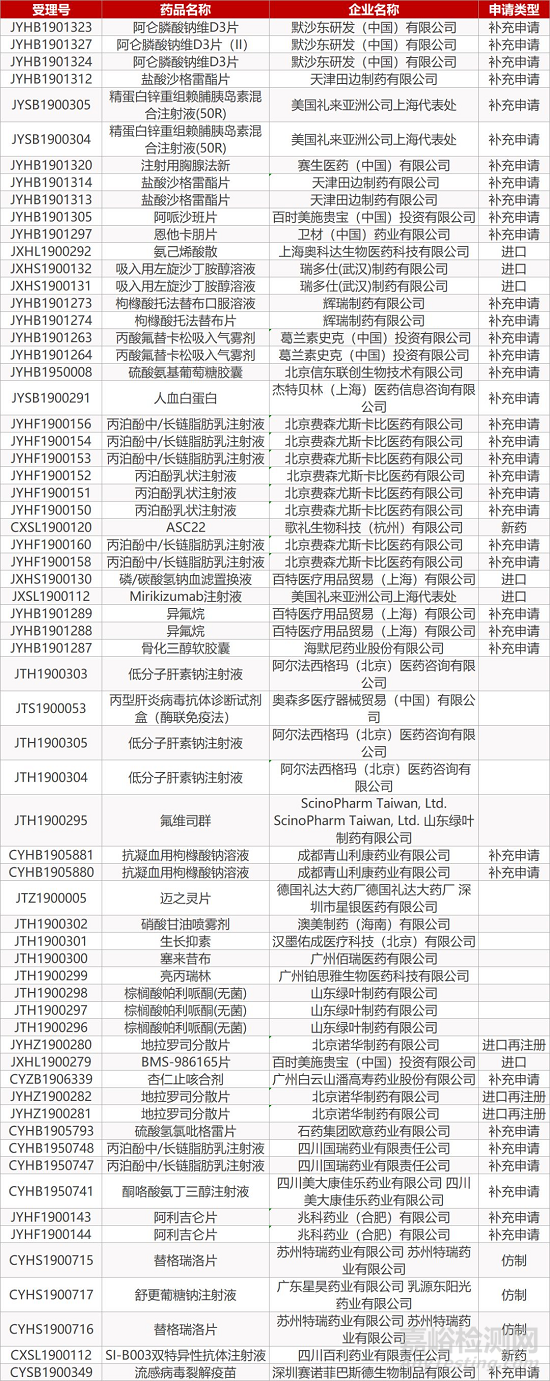
1. CDE最新受理情况(11月03日)
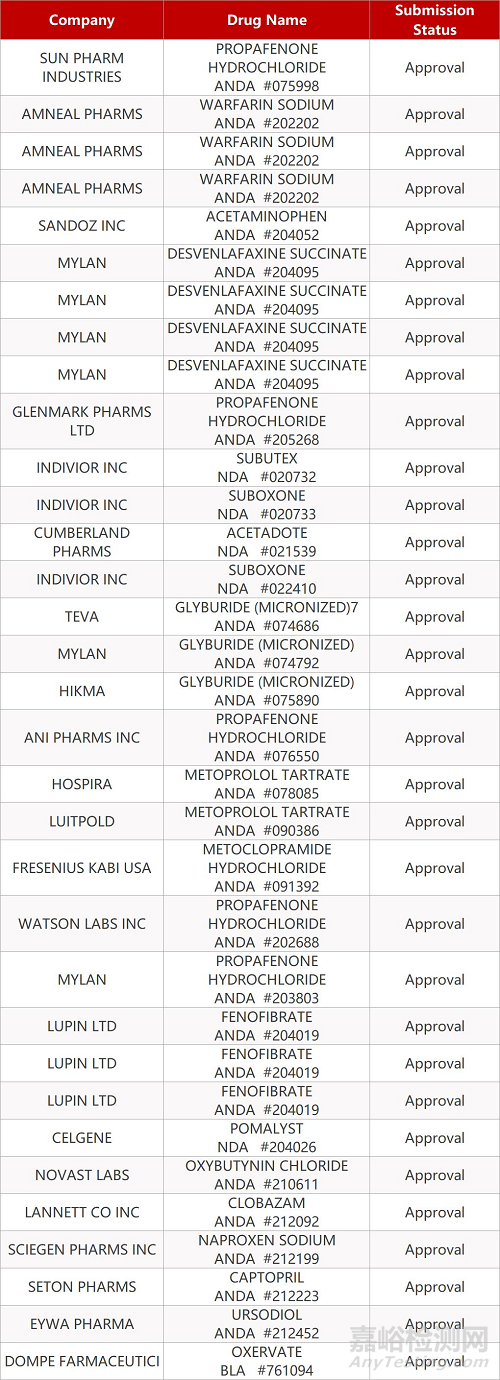
2. FDA最新获批情况(北美11月02日)

来源:药研发


