您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-18 14:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
思路迪可皮下注射的PD-L1拟纳入优先审评。思路迪药业恩沃利单抗(KN035)获CDE纳入拟优先审评公示名单,理由是“符合附条件批准的药品“。恩沃利单抗是一款可用于皮下注射的PD-L1单克隆抗体,本次申请的适应症为:拟开发用于治疗特定的晚期结直肠癌、晚期胃癌及其他晚期实体瘤。目前,恩沃利单抗正在中国、美国和日本针对多个肿瘤适应症同步开展临床试验,今年1月,FDA已授予恩沃利单抗晚期胆道癌的孤儿药资格。
国内药讯
1.华北制药阿莫西林克拉维酸钾片首家通过一致性评价。华北制药复方制剂阿莫西林克拉维酸钾片的补充上市申请获国家药监局批准,成为该品种首家通过一致性评价的产品。阿莫西林克拉维酸钾是治疗产生β-内酰胺酶耐药菌及敏感菌引起的中、重度感染的优选抗菌药物。该品种2019年中国公立医疗机构终端销售额超过60亿元,同比增长6.88%,其中华北制药所占市场份额超过30%。
2.扬子江阿齐沙坦片申报上市。扬子江旗下海尼药业提交的阿齐沙坦片上市申请获CDE受理。阿齐沙坦是新一代选择性AT1亚型血管紧张素II受体拮抗剂(ARBs)类抗高血压药,由武田原研,于2012年1月在日本批准上市,2019年全球销售额超过7亿美元,该产品尚未在中国获批上市。目前,恒瑞医药、百奥药业的阿齐沙坦片上市申请正在审评中,恒瑞医药为该品种首家报产企业。
3.拓臻生物NASH候选药物获FDA快速通道资格。拓臻生物非酒精性脂肪性肝炎(NASH)候选药物TERN-201(SSAO抑制剂)获FDA快速通道资格。一项Ⅰ期临床研究表明,健康受试者单次和多次口服TERN-201耐受良好,没有明显的安全性信号发现。研究中每一个剂量TERN-201都显示出强大的靶向作用,并达到了对血浆氨基脲敏感胺氧化酶(SSAO)活性的近乎完全抑制,且抑制活性在单次或重复给药后可持续一周。这是拓臻生物第二个获得快速通道认证的NASH项目。
4.诺华3款生物靶向新药在华获批临床。诺华三款1类生物新药获得临床试验默示许可,分别是TGF-β抑制剂NIS793,PD-1抑制剂PDR001以及TIM-3靶向单抗MBG453。拟开发适应症为:MBG453、NIS793单药或者与PDR001联用治疗骨髓纤维化。根据诺华官网,目前这项骨髓纤维化的三药联合疗法正在开展Ⅰ期研究,有望在JAK抑制剂之外为患者提供可接受的安全性和有效性疗法。
5.天境生物CD47单抗获批新的临床研究。天境生物1类新药注射用TJ011133(TJC4)获得一项新的临床试验默示许可,适应症为“复发或难治性晚期淋巴瘤”。TJC4是一款CD47靶向单抗,正在中美同步临床开发,其评估TJC4单药治疗复发/难治急性髓系白血病的中国Ⅰ/Ⅱa期临床正在进行当中。9月4日,天境生物刚与艾伯维就TJC4的全球开发和商业化达成一项近30亿美元的合作。
国际药讯
1.前列腺癌新药darolutamide获长期疗效数据。拜耳和Orion公司联合开发的口服雄激素受体拮抗剂(ARi)Darolutamide(Nubeqa)治疗非转移性去势抵抗性前列腺癌(nmCRPC)的Ⅲ期临床ARAMIS获积极结果。中位随访29.0个月时,darolutamide组和安慰剂组的3年总生存率分别为83%和77%,Darolutamide将死亡风险显著降低31%。在其他次要终点上,darolutamide也显示出明显获益。研究期间无新的安全信号出现。详细结果发表于《新英格兰医学杂志》上。
2. 罕见病创新疗法获FDA优先审评资格。FDA受理了Orphazyme公司热休克应激反应诱导剂arimoclomol的新药申请并授予其优先审评资格,用于治疗C型尼曼匹克病,预计明年3月17日之前做出回复。在一项Ⅱ/Ⅲ期临床试验中,该新药将患者疾病进展降低74%(p=0.0506)。而且其扩展试验结果显示,Arimoclomol在为期两年的治疗过程中持续降低疾病进展,原先接受安慰剂治疗的患者,在换为接受arimoclomol治疗后,疾病进展也降低90%。
3.礼来公布新冠中和抗体初步临床试验结果。礼来与AbCellera联合开发的新冠病毒中和抗体LY-CoV555,在门诊治疗有症状的COVID-19患者的Ⅱ期临床BLAZE-1中降低了患者的住院率。中期分析数据显示,接受2800mg LY-CoV555治疗11天后需要住院或接受急诊治疗的患者比例为1.7%,安慰剂组这一数值为6%,LY-CoV555减少72%患者的住院风险;临床中,没有患者进展到机械通气或死亡,无与药物相关的严重不良事件报告。目前该试验仍在进行中,将检测LY-CoV555与第二个礼来抗体LY-CoV016联用的效果。
4.张锋团队发布简易CRISPR新冠检测2.0版。Broad研究所张锋团队在《新英格兰医学杂志》公布了他们进一步改良的基于CRISPR技术的新冠病毒简易检测流程STOPCovid.V2。2.0版的STOPCovid在原有检测的基础上更进一步,在样本制备的过程中通过加入磁珠富集样本中的RNA,从而通过提高PCR反应的起始RNA数量,进一步提高了STOPCovid.V2的检测灵敏度。在一项设盲检测中,STOPCovid.V2能够达到93.1%的灵敏度和98.5%的特异性,而且阳性样本只需15-45分钟就能获得结果。
5.默沙东与西雅图达成联合用药临床研究。默沙东重磅Keytruda拟与西雅图遗传学公司的在研ADC药物ladiratuzumab vedotin(LV)联合开展用于治疗转移性三阴性乳腺癌(TNBC)的临床研究。LV通过靶向LIV-1将vedotin毒性有效载荷传递到肿瘤部位,其中LIV-1在90%以上的转移性乳腺癌病例中表达,并且在其他多种肿瘤中的表达率较低。根据去年SABCS公布的数据,Keytruda和LV的组合在一项正在进行的Ⅰb /Ⅱ期试验中显著缩小了35%的TNBC新患者的肿瘤。
6.Moderna连续达成两项合作。9月16日,Moderna宣布了两项合作,其一是与国际医疗保健集团Chiesi达成了一项超过4亿美元的合作协议,旨在发现和开发治疗肺动脉高压(PAH)的新疗法,以延缓或逆转患者的病情发展。另外一项合作是与Vertex达成的总价值超过5亿美元的新战略研究合作和许可协议,旨在发现和开发脂质纳米粒(LNPs)和mRNAs用于基因编辑疗法的递送,最终用以治疗囊性纤维化(CF)。
医药热点
1.第七版新冠肺炎防控方案发布。国家卫健委发布《新型冠状病毒肺炎防控方案(第七版)》,对新冠肺炎病原学和流行病学特征、疫情监测、疫情处置等内容进行了修订。流行病学调查方面,方案增加境外输入病例、输入继发病例、密切接触者的密切接触者(简称密接的密接)等定义,强调做好个案调查,密接判定、病例主动搜索、聚集性疫情调查及调查信息报告,做好感染来源、污染范围、传播特征和传播链分析。
2.医药商业贿赂案件信息交流共享机制建立。近日,最高人民法院、国家医保局签署《关于开展医药领域商业贿赂案件信息交流共享的合作备忘录》。主要内容是建立医药领域商业贿赂案件定期通报制度,积极拓展医药领域商业贿赂案件司法成果在医药价格和招采领域运用,共同推动全系统各层级开展信息交流共享,持续深化治理医药领域商业贿赂协同合作。
3.长护险试点城市新增14个。国家医保局、财政部公布《关于扩大长期护理保险制度试点的指导意见》和新增试点城市名单,北京市石景山区、天津市、山西省晋城市等14个城市将开展试点工作。《意见》同时明确,人力资源和社会保障部原明确的试点城市以及吉林、山东2个重点联系省份继续开展试点,其他未开展试点的省份可新增1个城市开展试点,于今年内启动实施,试点期限2年。未经国家医保局和财政部同意,各地不得自行扩大试点范围。
4.第四届国之名医系列榜单揭晓。9月16日,第四届国之名医系列榜单发布,来自全国98个学科(含亚学科或疾病组)的顶尖名医组成学术委员会委员参与推举,历经三月,经过学术委员会委员推荐、材料审查、社会公示、所在单位或主管部门函询、主席团评议,最终报联合主席审定等环节,共366位国之名医入选榜单。榜单设特别致敬、卓越建树、优秀风范、青年新锐四类荣誉称号。同时本届特别设立“抗疫·致敬”单元,向逆行武汉抗疫一线的专家代表致敬。
股市资讯
【复星医药】(1)Raziel授权公司参与投资的天津星魅在区域内及领域内独家临床开发和商业化RZL012,产品在美容中,针对腹部、下巴塑形;治疗中,针对痛性脂肪综合症、脂肪瘤及脂肪水肿。(2)公司及控股子公司拟合计出资1亿元对复星健康进行增资;增资完成后,将持有复星健康约63.5%的股权。
【恒瑞医药】公司SHR-1701注射液临床试验获国家药监局批准;产品可改善肿瘤微环境中的免疫调节作用,最终促进免疫系统对于肿瘤细胞的杀伤;研发已投入9,936万元。
【京新药业】控股子公司杭州京瑞的沙美特罗替卡松吸入粉雾剂获国家药监局临床试验批准;产品主要用于可逆的气道阻塞性气道疾病的规律治疗,包括成人和儿童哮喘。
审评动向
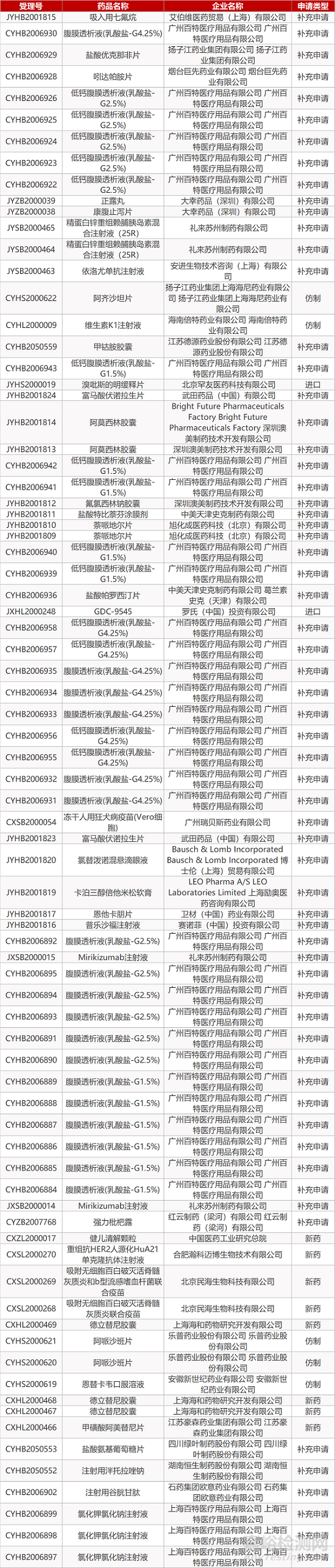
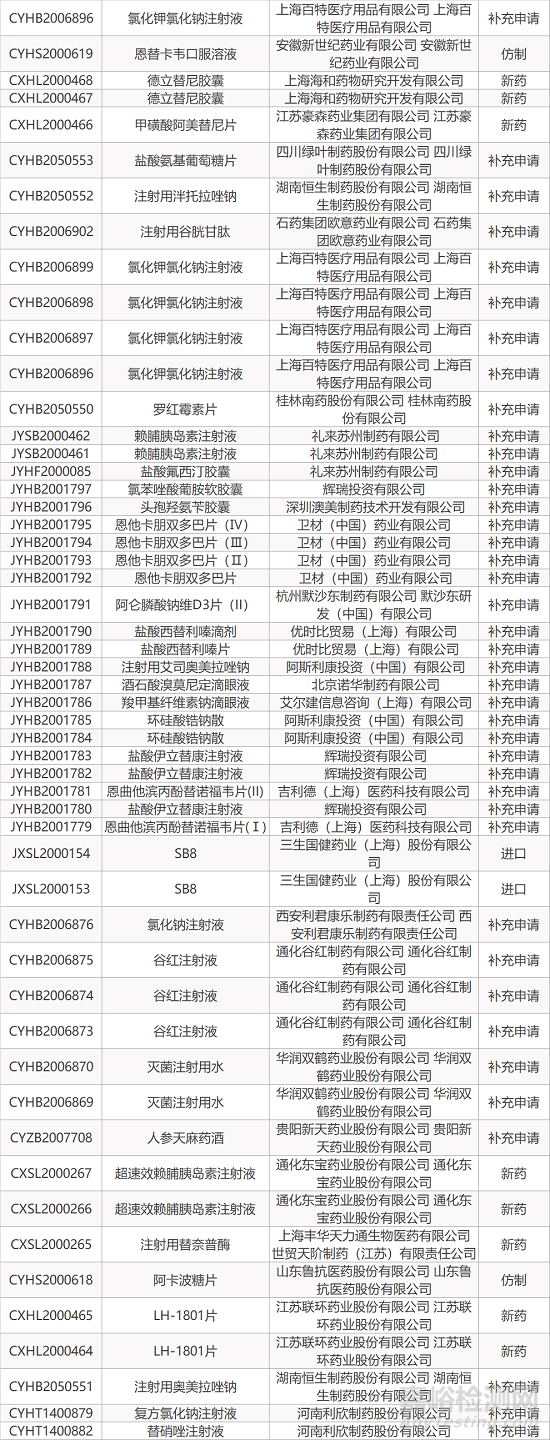
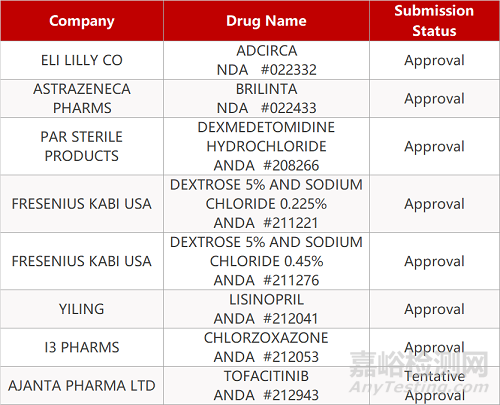
1. CDE最新受理情况(09月17日)
- The End -

来源:药研发


