您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-06 10:03
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.恩格列净新适应症在中国申报上市。勃林格殷格翰和礼来联合宣布,已向NMPA递交其糖尿病联盟旗下SGLT2抑制剂恩格列净片(Jardiance)用于治疗伴或不伴糖尿病、射血分数降低的心力衰竭成人患者的注册申请。恩格列净在中国已获批用于治疗2型糖尿病,此次是该药在中国申请的第二个适应症,该适应症实现了与美国和欧盟同步递交注册申请,递交仅晚于美国6天。
2.卫材抗癫痫药物FYCOMPA在华申报新适应症。国家药监局受理卫材抗癫痫药物(AED)Fycompa®(卫克泰®,吡仑帕奈)单药治疗4岁及以上儿童患者的部分性癫痫发作适应症的新药补充申请。Fycompa是一款AMPA受体拮抗剂,通过靶向突触后膜上AMPA受体处的谷氨酸盐活性,减少与癫痫发作相关的神经元的过度兴奋。Fycompa已在中国获批作为12岁及以上癫痫患者的部分性癫痫发作(伴或不伴继发性全面性癫痫发作)的辅助治疗。
3.联拓生物FGFR抑制剂Infigratinib在华获批Ⅲ期临床。联拓生物1类新药Infigratinib胶囊获国家药监局两项临床试验默示许可。Infigratinib是一款FGFR 1-3选择性抑制剂, 拟用于一线治疗伴有FGFR2基因融合的局部晚期或转移性的无法手术切除的胆管癌,目前正处于全球Ⅲ期临床开发阶段。本次获批的PROOF试验是一项国际Ⅲ期临床研究, 旨在评价Infigratinib在治疗伴有FGFR2基因融合的局部晚期或转移性不可切除的胆管癌患者中的药代动力学特征、疗效和安全性。
4.云顶新耀TROP-2靶向ADC在华获批Ⅲ期临床。云顶新耀TROP-2靶向抗体偶联药物Trodelvy(sacituzumab govitecan)的Ⅲ期临床试验申请获国家药监局批准。这是一项名为EVER-132-002的Ⅲ期注册试验,旨在接受过至少2种但不超过4种既往化疗方案的HR+/HER2-转移性乳腺癌的亚洲患者中,评估和比较Trodelvy与医生选择的治疗(TPC)的有效性和安全性。该试验将在中国大陆、台湾和韩国招募大约330例患者。云顶新耀拥有该药在大中华区、韩国及一些东南亚国家和地区的开发、注册和商业化权益。
5.优锐医药囊获一款在研镇痛药中国区权益。优锐医药与Neumentum公司达成一项许可协议,获得后者一款新型静脉输注酮咯酸(NTM-001)在中国研发和商业化的权益。NTM-001通常在术后环境中使用,可通过预混合袋进行连续24小时静脉输注,用于治疗原本需要使用阿片类药物进行镇痛的中度严重急性疼痛。根据协议条款,Neumentum公司将获最高5300万美元的预付款和后续里程碑付款,以及未来产品的销售分成。
国际药讯
1.选择性补体5a受体抑制剂avacopan在欧盟申报上市。欧洲药品管理局受理Vifor Fresenius Medical Care Renal Pharma(VFMCRP)与ChemoCentryx 联合开发的选择性补体5a受体抑制剂avacopan的上市申请,用于治疗抗中性粒细胞胞质抗体(ANCA)相关性血管炎,包括肉芽肿性多血管炎(GPA)和显微镜下多血管炎(MPA)。EMA预计将于2021年下半年给出审批意见。在一项关键性Ⅲ期试验ADVOCATE中,与泼尼松(prednisone)组相比,avacopan治疗组在第52周维持疾病缓解方面具有统计学优势。
2.二氮嗪新型口服疗法Ⅲ期临床结果积极。Soleno Therapeutics二氮嗪胆碱控释片(DCCR)治疗Prader-Willi综合征(也称小胖威利综合征)的Ⅲ期研究DESTINY PWS(C601)结果积极。治疗13周后,DCCR治疗组患者的脂肪量显著减少(p=0.0027),而且在基线时体重>100 kg的受试者中观察到脂肪量的平均降幅更大(安慰剂校正差异为-4.82 kg);DCCR治疗组患者瘦素水平显著下降,安慰剂组瘦素水平升高;DCCR治疗组患者脂连蛋白水平提高,而在安慰剂组患者中则降低(p<0.0001)。
3.大麻素疗法nabiximols在美启动一项关键Ⅲ期研究。GW Pharmaceuticals与其美国子公司Greenwich Biosciences宣布,大麻素口腔喷剂nabiximols治疗多发性硬化(MS)相关痉挛的一项Ⅲ期临床已在美国启动。该项研究将在12周期间评估nabiximols治疗MS相关痉挛状态的安全性和疗效,预计入组446例受试者。此外,GW公司还计划启动另外两项Ⅲ期研究,分别为安慰剂对照的肌张力研究和安慰剂对照的痉挛频率研究。Nabiximols(Sativex)已在超过25个国家获批,用于治疗MS相关痉挛状态。
4.“first-in-class”小分子化合物devimistat获FDA孤儿药资格。FDA授予Rafael公司小分子化合物CPI-613(devimistat)孤儿药资格,用于治疗软组织肉瘤(STS)。Devimistat旨在靶向线粒体三羧酸(TCA)循环,增加癌细胞对多种化疗药物的敏感性,以达到降低副作用的目的。FDA已授予该疗法治疗急性髓系白血病、胰腺癌、骨髓增生异常综合征、外周T细胞淋巴瘤和Burkitt淋巴瘤的孤儿药资格,并批准其在胰腺癌和急性髓系白血病领域启动关键性Ⅲ期临床。
5.CRISPR基因编辑疗法公布最新临床结果。CRISPR Therapeutics和Vertex 公司联合开发的CRISPR/Cas9基因编辑疗法CTX001将在ASH2020年会上公布Ⅰ/Ⅱ期临床最新数据。5例输血依赖性β地中海贫血症(TDT)患者和2例镰状细胞贫血(SCD)患者在接受CTX001输注后,血液中HbF和总血红蛋白水平都有所提升。而且治疗2个月后,所有TDT患者均没有再接受输血治疗;所有SCD患者均没有发生过血管闭塞性危象(治疗前患者平均每年发生7次血管闭塞性危象)。
6.辉瑞不使用政府指定渠道分发COVID-19疫苗。辉瑞COVID-19疫苗分发工作计划公布。辉瑞与BioNTech联合开发的新冠mRNA疫苗BNT162b2如果获得FDA批准上市,辉瑞决定不使用美国政府选定的分销公司McKesson来帮助其分发BNT162b2。由于mRNA疫苗的储存温度为华氏零下94度,辉瑞计划通过能实时GPS检测温度变化的冷链运输,将BNT162b2直接从其密歇根州工厂运送到接种点。辉瑞此前已与美国政府达成提供多达1亿剂候选疫苗BNT162b2的协议,辉瑞年底之前将分发其中的4000万剂。
医药热点
1.北京协和医院主要领导调整。11月4日下午,北京协和医院召开干部大会,会上宣布主要领导调整决定。任命吴沛新同志为中国医学科学院北京协和医院党委书记、副院长;任命张抒扬同志为中国医学科学院北京协和医院院长、党委常委;赵玉沛同志为中国医学科学院北京协和医院名誉院长。
2.2020何梁何利奖揭晓。何梁何利基金2020年度科学与技术奖评选结果11月4日揭晓,共有52位科技工作者获得表彰。其中,科学与技术成就奖获奖者2位,科学与技术进步奖获奖者30位,科学与技术创新奖获奖者20位。根据获奖人名单,中国科学院院士、国家呼吸系统疾病临床医学研究中心钟南山与敦煌研究院名誉院长、研究员樊锦诗获“何梁何利基金科学与技术成就奖”。
3.新冠疫情下流感诊疗方案升级。近日,国家卫健委发布《流行性感冒诊疗方案(2020年版)》。《诊疗方案》增加了流感与新冠肺炎的鉴别诊断相关内容。《诊疗方案》指出,新冠肺炎轻型、普通型可表现为发热、干咳、咽痛等症状,与流感不易区别;重型、危重型表现为重症肺炎、ARDS和多器官功能障碍,与重症、危重症流感临床表现类似,应结合流行病学史和病原学鉴别。
4.冠脉支架集采结果出炉。11月5日,由国家组织的首次高值医用耗材冠脉支架集中带量采购工作在天津进行。首年意向采购总量为1074722 个。最终10个产品拟中选,涉及9家企业,采购周期2年。支架中选价格700元左右。蓝帆医疗旗下山东吉威Excrossal心跃支架报价低至469元,与最新挂网价格13300元相比,降价超过96%。其他百元支架还包括易生科技548.99元,微创医疗590元,乐普医疗645元,美敦力648元、上海微创750元,深圳金瑞凯利795元、波士顿科学775.98元、波士顿科学776.31元、万瑞飞鸿798元。
股市资讯
【万孚生物】公司新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)获国家药品监督管理局应急审批通过,是我国首次批准新冠病毒抗原检测试剂,产品检测时间在20分钟之内,可以用于对疑似人群进行早期分流和快速管理。
【迪瑞医疗】公司产品环孢霉素测定试剂盒(化学发光免疫分析法)申报医疗器械注册获得受理,该产品用于体外定量检测人全血中环孢霉素的含量。
【以岭药业】公司及全资子公司北京以岭药业有限公司生产的专利药物——连花清瘟胶囊(颗粒)均被列入流行性感冒诊疗方案(2020年版)》推荐用药,用于中医治疗风热犯卫、表寒里热、热毒袭肺三个症型。
审评动向
1. CDE最新受理情况(11月05日)
2. FDA最新获批情况(北美11月04日)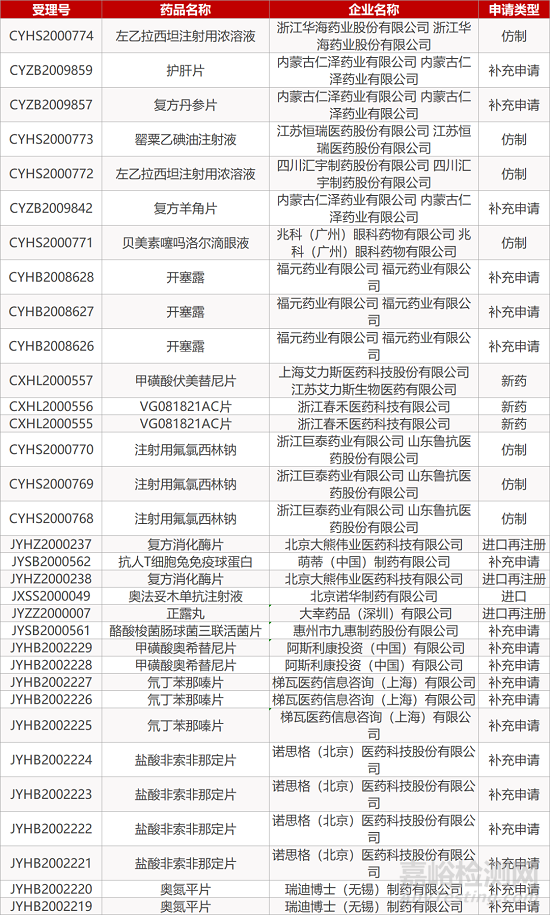
- The End -

来源:药研发


