您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-03-18 08:35
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.西奥罗尼获批软组织肉瘤II期临床。微芯生物1类新药西奥罗尼获国家药监局批准,拟开展用于标准治疗失败的晚期或不可手术切除软组织肉瘤的II期临床。西奥罗尼是一款多靶点多通路的选择性激酶抑制剂,正在III期临床中用于治疗小细胞肺癌和卵巢癌。值得一提的是,该新药用于小细胞肺癌和卵巢癌的临床研究已被CDE纳入突破性治疗品种。在美国,西奥罗尼还获得FDA授予用于治疗小细胞肺癌的孤儿药资格。
2.天演CTLA-4抗体获FDA临床许可。天演药业CTLA-4安全抗体ADG126获FDA批准,即将开展国际Ib/II期临床,评估与PD-1帕博利珠单抗联用治疗晚期/转移性实体瘤的效果。ADG126在肿瘤微环境中被特定酶有条件激活后,才能与CTLA-4特异性结合,提高精准靶向性并最大限度地减低毒副作用。目前ADG126正在澳大利亚开展与特瑞普利单抗联合治疗的临床试验。
3.南京北恒通用型CAR-T获批临床。北恒生物自主研发的CTA101 UCAR-T细胞注射液产品获国家药监局临床试验默示许可,拟开发用于治疗复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。CTA101是国内首款“现货型”UCAR-T产品,使用了CRISPR基因编辑技术,敲除TRAC基因以避免移植物抗宿主病,同时敲除CD52基因并联合使用抗CD52单抗避免患者对CAR-T细胞的排异反应,延长UCAR-T细胞的体内存续时间。
4.百力司康EGFR ADC国内获批临床。百力司康生物治疗用生物制品1类新药注射用BB-1705获国家药监局临床许可,拟开发用于EGFR表达的局部晚期/转移性实体瘤。BB-1705是该公司第二款中美双报、拥有全球权益的新型ADC,靶向EGFR靶点,FDA去年12月已批准其在美国开展临床试验。该公司另一款ADC产品BB-1701也正在中美开展Ⅰ期临床,主要针对局部晚期和转移性HER2阳性实体瘤。
5.百济神州获得诺华5款抗肿瘤药国内推广权。百济神州宣布已完成对诺华5款已获批且已纳入国家医保目录的抗肿瘤产品的许可引入交易,将在中国境内指定地区负责营销、推广和销售。这5款产品包括BRAF抑制剂泰菲乐®(达拉非尼)、MEK抑制剂迈吉宁®(曲美替尼)、VEGFR抑制剂维全特®(帕唑帕尼)、mTOR抑制剂飞尼妥®(依维莫司)以及ALK抑制剂赞可达®(塞瑞替尼)。
国际药讯
1.FDA发布基因组编辑产品指南草案。3月15日,FDA发布一份涉及人类基因组编辑的人类基因治疗产品的指南草案。草案明确产品开发需要注意的三大方面:修改DNA序列的方法,使疗法生效所需的基因组修饰,以及递送基因组编辑元件的方式。基于基因编辑导致的长期影响是未知的,FDA建议在基因编辑治疗后,至少开展15年的长期随访研究以监测潜在风险。同日,FDA还发布了关于CAR-T、CAR-NK和TCR-T细胞疗法的指导文件草案。
2.35家药企可免费生产辉瑞新冠口服药。日内瓦药品专利池(MPP)宣布已与35家药企签署协议,允许其生产辉瑞新款口服药Paxlovid成分之一奈玛特韦(nirmatrelvir)原料药或制剂。这35家公司中6家将重点生产原料药,9家将负责生产制剂,其余20家企业同时生产原料药和制剂。值得一提的是,35家公司中包括5家中国企业,其中普洛药业和九洲药业获批生产原料药,上海迪赛诺、华海药业和复星医药获批可同时生产原料药和制剂。
3.艾伯维JAK抑制剂获批用于肠胃病。FDA批准艾伯维JAK抑制剂Rinvoq(upadacitinib)扩展适应症,这是Rinvoq在胃肠病领域的首个适应症,用于中重度活动性溃疡性结肠炎的治疗。在临床试验中,Rinvoq在治疗8周和52周时达到临床缓解的主要终点,获得无类固醇临床缓解的患者比例更高;更多患者获得关键性内镜和组织学指标的改善。Rinvoq目前已在胃肠病、皮肤病和风湿病领域获批四项适应症。
4.奥拉帕利早期乳腺癌达III期临床OS终点。阿斯利康/默沙东PARP抑制剂Lynparza(奥拉帕利)用于BRCA突变、高风险HER2-早期乳腺癌患者辅助治疗的III期OlympiA试验达到OS次要终点指标。与安慰剂相比,Lynparza将死亡风险降低32%(HR=0.68 [98.5% CI, 0.47-0.97]; p = 0.009);两组3年生存率分别为92.8% (95% CI, 90.8-94.4)和89.1% (95% CI, 86.7-91) ,4年的生存率分别为89.8% (95% CI, 87.2-91.9)和86.4% (95% CI, 83.6-88.7)。详细结果发布在欧洲医学肿瘤学会虚拟会议上。上周六,FDA已批准了该项适应症。
5.渤健Aβ单抗长期疗效积极。渤健抗Aβ单抗Aduhelm(aducanumab-avwa)两项Ⅲ期临床(EMERGE和ENGAGE)扩展期数据发布在The Journal of Prevention of Alzheimer’s Disease上。治疗128周后,Aduhelm持续降低阿尔茨海默病(AD)早期患者大脑中的Aβ水平和血浆中p-tau181水平,而且Aβ沉积清除更为有效的患者中p-tau181水平的降低也更大;78周时采用4种检测(CDR-SB,MMSE,ADAS-Cog13和ADCS-ADL-MCI)的结果显示,p-tau181水平降低患者的认知衰退比p-tau181水平无变化的患者更轻。
6.恩格列净治疗慢性肾病Ⅲ期临床积极。礼来与勃林格殷格翰开发的SGLT2抑制剂恩格列净(empagliflozin)在治疗慢性肾病(CKD)的Ⅲ期临床达到预设的疗效终点。基于中期积极结果,独立数据监察委员会建议提前终止这项试验,详细结果将在今年晚些时候公布。目前,恩格列净已获FDA批准用于降低患有心血管疾病的2型糖尿病患者的血糖,以及他们因心血管疾病死亡的风险;用于减少所有心衰患者的心血管死亡以及住院风险。
7.Keytruda联合PARP抑制剂III期临床失败。默沙东宣布将终止PD-1抑制剂Keytruda联合PARP抑制剂Lynparza(奥拉帕利) 治疗转移性去势抵抗性前列腺癌(mCRPC)的III期KEYLYNK-010研究。与对照组醋酸阿比特龙或恩杂鲁胺相比,Keytruda联合Lynparza未达到总生存期(OS)的双重主要终点。在此前的早期中期分析中,影像学无进展生存期 (rPFS)也没有表现出改善。联合治疗的安全性与已知研究一致。目前,这一组合还被开发用于治疗晚期肺癌、卵巢癌和三阴性乳腺癌等实体肿瘤。
8.赛诺菲联合Seagen开发多款抗癌ADC。赛诺菲与Seagen公司将利用后者专有的ADC技术,合作开发多达三个癌症靶标设计的候选抗体偶联药物(ADCs)。ADCs是经过工程化改造的抗体,可将有效的抗癌药物递送至表达特定蛋白的肿瘤细胞中。根据协议,两家公司将共同资助全球的开发活动,并平分未来的任何利润。赛诺菲将在选定三个靶标时,分别向Seagen支付一笔未公开的付款。
医药热点
1.湖北省公立医院拟新增一个科室。湖北省卫健委印发《关于强化医疗机构公共卫生责任的指导意见(试行)》,要求各级各类医疗机构应当成立由主要负责人任组长的医院公共卫生工作领导小组,将公共卫生工作列入医院重要业务工作,并作为医疗机构内部绩效考核重要内容,二级及以上综合医疗机构、中医医院、专科医院和乡镇卫生院、社区卫生服务中心需设置独立的公共卫生科。
2.张忠德团队发现新冠肺炎潜在治疗靶点。广州中医药大学张忠德团队与北京蛋白质组研究中心秦钧教授团队合作发现新冠肺炎潜在治疗靶点的研究成果刊发在《中国科学:生命科学》英文版上。该研究发现了一个尚未被纳入生物信息学注释常用数据库,但只在新冠肺炎患者尿液中高表达的蛋白CLYBL,并据此推测免疫调节代谢物衣康酸可作为新冠肺炎潜在治疗靶点。
3.2021互联网中医百强榜出炉。中国医药新闻信息协会发布2021互联网中医百强榜单。与2020年同期相比,触网的医生人数、患者人数和问诊量均呈现大幅增长,其中触网的新患者增长超过100%。本次调研样本中涉及线上咨询及诊疗的病症超过1800项,排名前十的病症包括:月经不调、失眠多梦、亚健康、咳嗽、胃炎、痤疮、鼻炎、虚劳、腰痛、胃痛。
评审动态
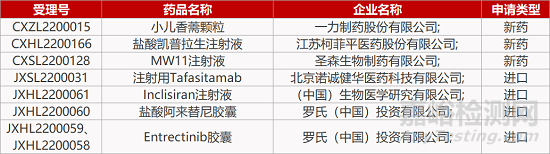
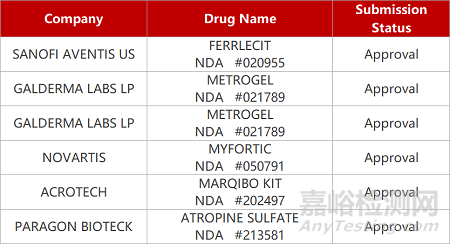

来源:药研发


