特殊注射剂通常为改良型药物,通过对剂型、处方、工艺等进行优化设计解决药物的先天不足,以降低药物不良反应、提高疗效、提升患者顺应性等,具有较高的临床价值。特殊注射剂通常具有复杂的处方或采用特殊的制备工艺,具有较高的技术壁垒,在竞争日益激烈的仿制药市场中具有较大的优势。本文参考国内外指导原则,结合特殊注射剂的制剂特点,简要探讨化学药品特殊注射剂仿制药开发过程中药学研究需要关注的内容和技术要求。
随着我国药物研发水平的迅速提升、化学仿制药一致性评价和国家药品集中带量采购工作的推进和深入,在竞争日益激烈的仿制药市场中,复杂仿制药已成为诸多企业瞄准的目标。根据美国FDA的指导原则,复杂仿制药通常包括以下产品[1]:复杂的活性成分(如肽、聚合物、活性药物成分的复杂混合物、天然来源成分)、复杂制剂(如脂质体、胶体)、复杂的给药途径(如配制成混悬液、乳剂或凝胶剂的局部作用药物,皮肤病用药,复杂的眼科产品以及耳用剂型)、复杂剂型(如经皮给药剂型、定量吸入制剂、缓释注射剂)、复杂的药械组合产品(如自动注射器、定量吸入器)等,以及其他可受益于早期科学参与、存在批准途径或替代方法的复杂性或不确定性的产品。我国目前没有对于复杂仿制药的定义和范围,仅在化学仿制药质量和疗效一致性评价工作中,为与普通注射剂区分提出了特殊注射剂的概念[2]:与普通注射剂相比,特殊注射剂的质量及其活性成分的体内行为受处方和工艺的影响较大,可能进一步影响制剂在体内的安全性和有效性,例如脂质体、静脉乳、微球、混悬型注射剂、油溶液、胶束等。可见我国提出的特殊注射剂为美国FDA所述的复杂制剂或复杂剂型。
特殊注射剂通常为改良型药物,通过对剂型、处方、工艺等进行优化设计解决药物的先天不足,以达到降低药物不良反应、提高疗效、提升患者顺应性等目的,具有较高的临床价值和市场效益。例如:1995年批准上市的第一个脂质体抗癌药物—盐酸多柔比星脂质体注射液,商品名Doxil®/Caelyx®,它采用硫酸铵梯度法将盐酸多柔比星包裹于PEG化脂质体内形成的特殊注射剂,相比普通的多柔比星注射液,抗肿瘤作用增加、药物半衰期延长、心脏毒性降低。由Celgene公司研发的注射用紫杉醇(白蛋白结合型),商品名Abraxane®,则是以人血白蛋白为载体采用纳米分散技术制备的纳米微粒制剂,相比以聚氧乙烯蓖麻油为助溶剂的普通注射剂,过敏反应的发生率显著降低、输液时间缩短、耐受性明显提升。
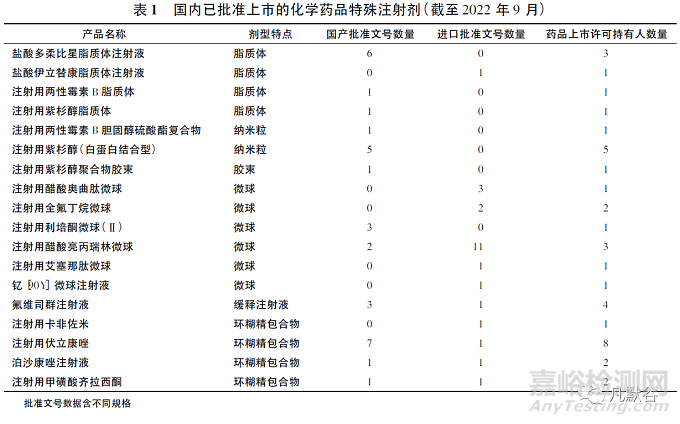
无论是前期产品开发还是商业化生产过程控制和质量保证,特殊注射剂都有着较高的技术壁垒,能够成功上市的品种并不多。目前国内已批准上市的特殊注射剂主要有脂质体、微球、胶束、油溶液、包合物等,而且每个品种药品上市持有人数量均较少,甚至多个产品无仿制药上市,存在原研药垄断及尚未满足的临床需求,详见表1。
由于特殊注射剂通常具有相对复杂的处方或采用特殊的制备工艺,每个产品都具有特殊的性能和特点,药学研究方面需要结合制剂特性个性化地考虑研究和开发方案,进而确定不同于普通注射剂的关键质量控制策略。在化学药品特殊注射剂仿制药研发的整体思路方面,药学研究是基础,若仅通过药学研究不能充分确保与参比制剂质量和疗效的一致性,则可能需要进一步的非临床和/或临床研究。若药学研究结果提示仿制药与参比制剂不一致,可能需要对仿制药的处方工艺进一步优化后重新开展后续非临床和/或临床研究[2]。本文即以特殊注射剂为例简要介绍化学药品复杂仿制药药学研究的一般要求。
需要指出的是,部分特殊注射剂要真正做到与参比制剂做到质量和疗效一致存在极大挑战,比如醋酸亮丙瑞林缓释微球,在有些情况下企业或许会考虑突破仿制药的研发思路按改良型新药进行开发,此类情形不在本文讨论范围之内。
1、参比制剂选择
参比制剂是指经国家药品监管部门评估确认的仿制药研制使用的对照药品。仿制药应具有与参比制剂相同的活性成分、剂型、规格、适应证、给药途径和用法用量,并证明质量和疗效与参比制剂一致[3],临床上可替代参比制剂发挥相同的临床作用。因此,选择参比制剂是仿制药研发的开始,参比制剂选择是否正确决定仿制药的成败。
参比制剂的遴选与公布由国家药品监管部门负责,随着我国参比制剂遴选工作的日益成熟,国家药监局在原国家食品药品监督管理总局《关于发布仿制药质量和疗效一致性评价参比制剂备案与推荐程序的公告》(2016年第99号)的基础上,优化工作程序,于2019年和2020年相继发布了《化学仿制药参比制剂遴选与确定程序》和《化学仿制药参比制剂遴选申请资料要求》,以进一步提高参比制剂遴选工作的质量和效率[4-5]。截至2022年9月,国家药品监督管理局已正式发布60批参比制剂,包括脂质体、微球、包合物等多种特殊注射剂。
2、处方研究
根据国内外监管机构的技术要求,注射剂仿制药的处方组成通常应与参比制剂相同,即辅料种类和用量通常应与参比制剂相同,辅料的用量相同是指仿制药辅料用量为参比制剂相应辅料用量的95%~105%[2,6]。特殊注射剂仿制药也应满足上述要求,同时还应关注影响制剂关键质量属性和/或体内行为的辅料(如载体材料、药物释放调节剂)的研究与控制。例如:注射用紫杉醇(白蛋白结合型)参比制剂说明书中明确每瓶含紫杉醇100mg及人血白蛋白约900mg,紫杉醇是药物活性成分,人血白蛋白起分散、稳定和运载主药作用。关键辅料人血白蛋白所引入的稳定剂同样对制剂中白蛋白起到稳定作用,由于不同来源的人血白蛋白使用的稳定剂(辛酸钠、乙酰色氨酸等)可能存在差异(种类及用量),因此需要关注不同来源的人血白蛋白对制剂质量的影响[7]。又如,由阿斯利康公司研发的缓释产品氟维司群注射液,商品名Faslodex®,经肌肉注射后在局部形成药物贮库,缓慢吸收,发挥长效作用,终末半衰期约为50d。该产品处方中非活性成分蓖麻油作为共溶剂的同时,也是释放调节剂[8]。蓖麻油是由多种脂肪酸组成的植物来源脂肪油,其主要成分包括蓖麻油酸、亚油酸、油酸、硬脂酸、棕榈酸、亚麻酸、二十碳烯酸以及其他脂肪酸等[9]。根据氟维司群注射液的释药机理,溶解于油溶液中的药物随着局部组织的油水平衡而吸收,蓖麻油中脂肪酸的组成也将影响药物在体内的扩散和吸收。因此,如果要基于与参比制剂处方相同而豁免仿制药的人体内生物等效性试验,则需要进行充分的研究来证明仿制药所采用的蓖麻油与参比制剂所用蓖麻油的脂肪酸组成一致[10-11]。
3、生产工艺开发
对于复杂工艺的特殊注射液,特别是使用载体材料制备的脂质体、胶束、微球等,需根据参比制剂工艺原理、剂型特点、给药途径等考虑生产工艺的技术要求[12]。例如:多柔比星脂质体可以通过不同原理的方法制备,相应形成脂质体的尺寸、形态、释药机理等各不相同,进而影响药物的安全性和有效性。我国已批准上市的盐酸多柔比星脂质体注射液的参比制剂采用硫酸铵梯度法制备,主要步骤包括:①空白脂质体的制备。②硫酸铵梯度的形成。③活性药物的装载[13]。活性药物的装载是多柔比星在脂质体内外相的硫酸铵浓度梯度驱动下扩散到空白脂质体内完成的[14-15]。为保障质量和疗效的一致性,仿制药需采用与参比制剂相同原理的生产工艺,并通过工艺研究确定内水相溶液、脂相溶液、透析液、药物溶液等过程配制溶液的处方组成,确定油水两相混合温度和流速,高压挤出次数、温度和压力,透析倍数、载药温度和时间、除菌过滤压力和温度等关键步骤的工艺参数;并且空白脂质体和载药脂质体均应作为关键中间产品,控制粒度和粒度分布、载药量等。又如Celgene公司研发的注射用紫杉醇(白蛋白结合型)采用乳化-溶剂蒸发工艺制备[16],由于构建人血白蛋白二硫键的方法较多,如有机溶剂、离子强度、pH、高剪切力等[17],仿制药可能采用不同于参比制剂的工艺。考虑制备工艺对产品质量与疗效差异的潜在影响,因此在仿制药开发时需分析其工艺与参比制剂工艺的异同,提出合理支持依据。
由于复杂工艺的变更及批量放大可能影响特殊注射剂的质量和疗效,根据《已上市化学药品药学变更研究技术指导原则(试行)》,特殊剂型制剂生产批量的变更属于重大变更[18],因此对于复杂工艺生产的特殊注射剂,注册批生产规模应与拟定商业化生产规模一致[19]。
4、质量研究与控制
仿制药的质量研究应根据产品特性和相关指导原则科学设计试验,证明仿制药与参比制剂的质量一致性。原则上应提供至少3批次参比制剂样品的质量对比考察数据[2]。特殊注射剂的考察指标除了普通注射剂关键质量属性外,还应提出与其特性相关的质量控制研究项,以及在药物生产、临床使用、稳定性保障等环节应关注的质量控制指标[12]。例如:微粒制剂集中于粒子属性的对比研究:粒子形态、粒度和粒度分布、表面性质(电位、比表面积、包衣及厚度、配体及密度等)、包封率和包封药物状态、药物/载体摩尔比、载药量、药物释放和泄漏等。粒度和粒度分布建议采用群体生物等效性分析方法证明与参比制剂等效[20]。通过采用环糊精包合方式增加活性成分溶解度的注射剂,建议考察环糊精的取代度和取代度分布,结合临床使用方法考察仿制药与参比制剂在不同pH介质中包合稳定常数和复溶后药液的配伍稳定性,并关注仿制药与参比制剂释放动力学的相似性[21]。溶液型缓释注射剂方面,以氟维司群注射液为例,还应关注可能影响给药后所形成的药液贮库性质的因素,如药液黏度对给药后药液贮库扩散和总表面积的影响,给药器械(如注射针头的长度与内径、注射器活塞的滑动性能、实际给药体积等)对注射后贮库位置的影响,仿制药应与参比制剂一致,以避免影响活性成分在体内的扩散和吸收[11]。
5、稳定性研究
在常规药物稳定性研究要求的基础上,特殊注射剂应考察质量研究与控制中确定的影响制剂特性的关键质量属性,结合药物自身的特点建立符合要求的评价方法和指标。需要指出的是,应关注可能降解、聚集的非活性成分在贮藏、配制和临床使用中的变化。例如:氟维司群注射液应考察油性溶剂降解情况,考察指标包括酸值、皂化值、过氧化值、碘值等[11];由于人血白蛋白中单体、二聚体、寡聚体和多聚体等与紫杉醇的结合属性不同,稳定性研究中也应对注射用紫杉醇(白蛋白结合型)中白蛋白的低聚物状态进行表征[7,22]。
注射剂在临床使用过程中,通常需要采用基础输液等溶解、稀释后使用,特殊注射剂仿制药的使用中稳定性研究应根据参比制剂说明书中明确的临床用法用量进行试验设计和模拟研究,考虑最高/低使用浓度、临床使用温度、最长使用时间(包括输液时间)等,并与参比制剂在上述条件下进行对比研究。
6、结语
特殊注射剂具有较高的技术含量和临床价值,其仿制药是对市场有效的补充和调节,防止出现药物短缺,减轻患者负担。注射用紫杉醇(白蛋白结合型)自2018年首家仿制药按照“临床急需、市场短缺”纳入优先审评批准上市,至今已有5家仿制药获批上市,曾经的万元药物在2022年集中采购单价已降至百余元。
特殊注射剂制剂特性复杂,产品开发和审评的关注点与要求需要具体品种个性化考虑。目前我国已发布《盐酸多柔比星脂质体注射液仿制药研究技术指导原则(试行)》、《注射用紫杉醇(白蛋白结合型)仿制药研究技术指导原则(试行)》、《氟维司群注射液仿制药研究技术指导原则(试行)》等个药指南,以期更有效地促进仿制药开发,加快仿制药的批准上市和质量提升,以期更好地满足临床需求。
本文简要探讨了特殊注射剂仿制药开发中药学研究需要关注的内容和技术要求。药品上市许可持有人对药品质量在其整个生命周期内承担主体责任,应充分调研所研发品种包括参比制剂的特点,基于科学的原则进行仿制药的研发,以充分保障药品的安全性、有效性和质量可控。