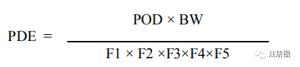一旦第一阶段清洁工艺开发和设计完成,就可以进入清洁验证生命周期的第二阶段清洁验证/确认阶段,这也是我们传统的清洁验证阶段。
我们按照FDA工艺验证的行业指南,同样将清洁验证/确认阶段也分为2个部分:
2.1 阶段 设备/设施确认;
2.2 阶段 清洁工艺性能验证/确认。
由于目前国内MAH制度的实施,第二阶段往往需要由研发机构向生产工厂或CDMO进行技术转移。在进行技术转移的时候,我们会对设备和清洁工艺进行差距分析,并根据差距分析来确认是否需要进入2.1阶段,还是直接跳过2.1阶段进入2.2阶段。
就像上文说的,由于研发机构在进行清洁工艺开发时有可能并不知道生产工厂或CDMO的设备情况,在进入2.1阶段之前,可能还需要生产工厂或者CDMO继续进行第一阶段的延伸设计和开发。并根据延伸设计和开发的结果确认是否需要重新对设备进行确认。
当设备确认完成后,就要进入2.2阶段,在正式进入2.2阶段之前,我们还需要额外解决几个问题:
清洁残留标准的确定
取样方法的分类及回收率研究
最差品种的选择
1.清洁残留标准的制定
在清洁工艺开发和设计阶段我们已经讲到了清洁残留标准的制定,但是由于篇幅问题,我们还是把部分细节内容放到这个章节来讲,读者请结合这两个章节来共同阅读清洁残留标准的制定。我们在本章节使用问答的模式来解释这些细节问题。
(1)使用上述清洁残留标准计算公式时,是否还需要增加额外的安全因子?
在PIC/S的备忘录PI 052-1中,其写明“评估HBEL值与清洁限度之间的安全系数。采用10作为系数可能是合理的,可相信不会超出允许暴露限”。
在ISPE清洁验证指南中也写明”由HBEL证明的清洁残留SL不能用作CPPQ之后的常规清洁限度”。
综上所述,作者认为使用HBEL来进行清洁限度计算时,应使用额外的安全因子。因为HBEL本身是基于健康的暴露限值,意味着人员在每天接触该浓度化合物的情况下,终生(80年)是不会对健康造成伤害的。但是污染源不仅仅是清洁残留,空气传播、机械传播等都会带来化合物的污染,因此使用HBEL作为清洁残留限度来说是不恰当的,因为结合其他污染源可能就超出了HBEL。所以在使用HBEL的方法时,建议增加2-10之间的安全因子是更准确的。
(2)如果化合物的HBEL我们不清楚的话,应该如何计算残留限度呢?
PDE=(NOAELx Weight Adjustment)/(F1x F2x F3x F4x F5x)
如果我们有NOAEL值,我们可以根据NOAEL值推导出HBEL。
如果我们没有NOAEL值,我们可以使用NOEL、LOAEL、LOEL值代替NOAEL推导,但是需要修改F5的对应取值(参见ICH Q3C)。
如果以上数据都没有,我们仍可以使用OEL值来进行推导,详见下方公式:
PDE (μg/天) = OEL (μg/立方米) x 10 立方米(在8小时内工人吸入的体积)
需要注意的是,OEL值计算PDE并不是一个太准确的方法,主要原因是由于OEL值是根据生产工人来计算的,而PDE是针对所有人群计算的,有可能存在老人和小孩,两者是有差别的,且相比于OEL,PDE有更多的获取途径。
但是如果OEL值也没有,特殊情况下我们可以使用LD50来推导HBEL值。
(3)是否可以使用LD50推导HBEL值?
在PDA TR29中给出了LD50推导PDE的公式:
但是在EMA发布的HBEL问答和PIC/S PI 053-1中有如下要求:
Q:是否可使用LD50计算药品HBEL?
A:不可以,LD50用作药品HBEL计算起始点是不够的。
在APIC清洁验证指南中其进一步的解释:
制剂和API应该至少有一个或多个NO(A)EL或LO(A)EL值。只有非常少情况下,例如药品早期开发阶段,可能没有NO(A)EL或LO(A)EL,这时可使用LD50值,但需要使用非常保守的不确定性因子。无论如何,在此类情形下强烈建议限制将LD50作为POD,因为LD50值在预测长期效应方面并不可靠。
因此我们可以看出,就目前业界的认知,LD50用来推导HBEL是不太被认可的,但是结合APIC的解释,如果在所有数据都没有的情况下,且后续产品是一次性服药或短期用药的话,是可以使用LD50来推导HBEL值的。
(4)如果LD50也没有或者不可用,我们应如何制定清洁合格限度呢?
如果什么数据都没有,我们仍可以选择以下的方法制定清洁合格限度:
根据污染物结构,查询类似结构化合物的ADE/PDE值,然后进行预估;
用TTC进行清洁合格限度的计算;
根据1/1000日剂量或者10ppm的方式进行清洁合格限度的计算。
(5)既然所有指南都推荐使用HBEL作为清洁合格限度,那么我们之前清洁验证的限度应如何处理?是否还有必要保留1/1000日剂量和10ppm的限度制定方法?
需注意的是,HBEL的方法仅适用于具有药理活性的污染物。不具备药理活性或者灭活破坏药理活性的污染物不能使用HBEL的方法推导清洁合格限度。
在EMA HBEL问答和PIC/S PI053-1中,有如下规定(ISPE也发布了此观点):
对于已有产品,生产商可保留其历史曾使用的清洁限度,将其作为警戒限,前提是在考虑清洁工艺能力时,它们足以保证不会高于HBEL水平。为首次引入某个设施的产品建立清洁警戒水平时,可采用类似的方法。
但是在2021年发布的WHO指南中,其给出了不同的观点:
在历史GMP文件中所建议的清洁验证可接受标准并未考虑HBEL。现在应计算基于HBEL的清洁限度,并与正在使用的清洁限度进行比较。
之前建立的清洁限度如果比HBEL更为严格,也是可以使用的。如果有数据存在(即统计学过程控制),所有警戒限和行动限均不应该依据历史上建立的清洁限度,而应基于统计学分析。
从上面2种不同的观点来看,作者更倾向于WHO的观点,既在没有任何改变的情况下,我们不应该人为的允许其超出之前的限度。警戒限和行动限也不应该由之前不合理的标准所代替,应该基于统计学的数据。
另外,由于EMA、PIC/S和ISPE都表述了可以使用HBEL推导的合格限度,舍弃历史更严格的限度,但是基于污染本身只有负面影响,作者不建议大家在可以控制更严格的基础上放宽清洁残留的限度。
(5)如果车间设备材质不同,导致某几个设备不好清洁至合格标准,是否可以设立额外的限度?
是可以的,在PDA TR29中,有如下描述:
为了评估一个由多个操作单元组成的操作步骤,重要的是计算每一操作设备中的累积残留。MACO是可能存在于不同设备的共用面积上所有目标残留的总和。通常一个设备组中每一共用表面都采用相同的限度。另一种选择是将MACO的总量不平均地分配给不同的设备,其总量依然可以有效反应出MACO。例如,如果一个设备组包含三个独立容器,三个容器具有相同的表面积,如果将MAC按照总表面积平均分配,则限度可能为 1.0 μg/cm2,相反,可以不平均地分配MACO,使设备A的SAL为 0.5 μg/cm2,设备B是 1.0 μg/cm2,设备C是 1.5 μg/cm2。
(6)HBEL的推导公式以及查询方法
HBEL主要是ADE和PDE,ADE的推算公式如下:
▲(EMA HEBL指南)
PDE的推算公式如下:
▲(ICH Q3C)
需注意的是:
起始点(POD)是外推得到HBEL的剂量水平。起始点可以有多种形式,它可以来自动物或人体数据,剂量水平可以对应不同的反应水平。它亦可依据评估当时药品的开发阶段。药品开发后期,会有越来越多的数据,就有几个POD供选择。在此情况下,应采用最相关或最保守的HBEL。当然,最恰当的POD应该由专家判断谨慎选择。
在PIC/S的指南中,其给出了目前欧盟推荐的查询网站和网址:
如果制造商是原研厂家(或原研厂家的受托方),应使用/提供原研的药理和毒理数据。
如果制造商不是原研厂家,则应查询多个数据源,例如:
欧盟公共评估报告:https://www.ema.europa.eu/en/medicines/field_ema_web_categories%25253Aname_field/Human/ema_group_types/ema_medicine_en
产品特性摘要:
https://www.medicines.org.uk/emc/
毒理在线:
https://toxnet.nlm.nih.gov/
毒性文献数据库(ToxRefDB):
https://catalog.data.gov/dataset/toxicityreference-database-bcf19
ACToR:
https://www.epa.gov/chemical-research/actor
综合风险信息系统:
https://www.toxnet.nlm.nih.gov/newtoxnet/iris.htm
主管当局或原研厂家给出的用以确保工人安全的职业暴露水平(OEL) (WHO, OSHA, MAK)
ECHA 注册化合物数据库
(https://echa.europa.eu/information-onchemicals/registered-substances)
(7)HBEL推导人员资质要求及注意事项
EMA和PIC/S在指南中给出了他们对于HBEL推导人员的资质要求:
“基于健康的接触限值应由在毒理学/药理学方面具有足够专业知识和经验,对药物熟悉并且具有确定基于健康的接触限值(例如职业接触水平(OEL)或每日允许摄入量)经验的人来确定(PDE)”。
另外,关于使用外部毒理学顾问,EMA 和PIC / S 还要求:
“如果与专家签订合同以提供 HBEL,则在进行工作之前应已达成符合 GMP 第 7 章要求的合同协议。对于制造商“购买” HBEL 评估而不记录对 HBEL 适用性的评估,不被认为是可以接受的。提供者(包括特定的技术专家)作为合格的承包商”。
美国ASTM(美国材料与试验协会)在其指南E3219-20中也对HBEL评估人员资质提出了要求:
应要求提供可证明其教育背景的履历(例如,毒理学,药理学,医学或其他与健康有关的学科) ;
在该领域的多年经验 ;
多年积累 HBEL 的经验 。
以下专业信息也可能会有用:
诸如美国毒理学委员会(DABT)或欧洲注册毒理学家(ERT)的证书
与该领域有关的出版物。
拥有认证和/或出版物并不能直接证明其在 HBEL 推导中的能力。但是,认证注册机构通常需要相关学科的学位,毒理学主要领域的基础知识,至少五年的相关毒理学经验,是否适合注册(例如,通过发表的作品,报告或评估),以及目前从事毒理学实践的专业人士。因此,拥有证书确实可以支持资质要求。
尽管“合格专家”并不需要所有上述条件,但是有关这些领域的适当文档证明了拥有在该领域工作所需的专业知识。
(8)其他项目的清洁限度
除了化学污染物的清洁残留限度外,我们还应该建立其他项目的清洁限度,一般包括但不限于:
目视清洁;
微生物限度;
细菌内毒素;
清洁剂(等同于API残留,限度及算法参见ICH Q3C);
降解产物(等同于API残留,若无HBEL值可采用其它方法)。
对于目视清洁,是清洁验证/确认必须执行的一项操作,如果目视清洁不合格,化学残留检测合格,也是不允许放行设备的。
而在EU GMP附录15和中国GMP附录11中,都明确规定目视检查通常不得作为单一可接受标准使用。
在EMA和PIC/S的HBEL问答中,其对目视检查提出以下要求:
在进行目视检查确定设备的清洁度时,生产商应建立产品易于目视残留的阈值。这时也可以考虑目视检查设备的能力,例如,现场的照明条件和观察距离。
目视检查应包括所有可能留有清洁的产品接触表面,包括需要拆卸以进入检查和/或使用工具进行检查的设备(例如,镜子、光源、管道镜)以观察这些目视不可及的区域。目视检查中应包括可能残留产品的非产品接触表面,而残留可能在未来掉落或转移至后续批次中的情况。
应制订书面指令指明需要目视检查的所有区域,记录应清楚确认已完成所有检查。
执行目视检查的操作人员需要进行特定培训,包括定期视力检查。应通过实际评估来证明其资质。
对于目视检查的注意事项见下表:
|
SOP |
应建立SOP,规定目视的注意事项及相关要求。 |
|
照度 |
低光照往往会导致某些明显的残留无法识别。 |
|
角度和位置 |
目视的角度、距离和位置,都会影响到目视的检查结果。 |
|
明确的指令能够减少目视检查人员彼此之间的差异。 |
|
样板 |
不同的残留物在设备上的残留现象不同,应提供照片、影像资料或样板给目视检查人员,以对其进行正确的识别。 |
|
检测限 |
应建立目视检查的检测限,以确保其远远低于污染物的残留限度。 |
|
方法选择 |
一般目视检查作为唯一的一种检测方法是不充分的。 |
|
表面 |
目视检查一般都是检查干燥的表面,因为湿润的表面往往更难看出污染物。 |
|
人员资质 |
进行目视检查的人员应具备足够的资质,视力应满足公司内部的要求,且经过SOP的培训并考核合格。 |
|
需注意的是,部门之间的差异也有可能导致目视能力的差别。 |
对于微生物限度和细菌内毒素的合格标准,目前有2种主流方式:
参照化学残留的计算方法,通过成品标准反推设备所允许残留;
按照清洁用水的微生物限度和细菌内毒素标准执行。
2.取样方法的分类和回收率研究
(1)取样方法的分类
清洁验证的取样必须遵循批准的方案或SOP,该方案或SOP应明确定义在何处取样以及如何取样。
取样方法一般分为以下4类情况:
直接表面取样法:包括目检法和仪器法
擦拭取样:也算直接表面取样的方法,但与其它直接表面取样法有较大的区别
冲洗取样:间接取样方法
安慰剂取样法
安慰剂取样法在FDA的清洁验证检查指南中明确被拒绝了,FDA认为安慰剂取样法存在灵敏度低以及污染物分布不均匀的情况,故我们今天在这里不讨论安慰剂取样法。
对于目检法参见上文合格标准内容。
擦拭法和淋洗法的优缺点对比:
|
取样方法
|
优点
|
缺点
|
|
擦拭法
|
物理去除表面上的残留物
残留物可溶于所选溶剂
从最差的位置取样,更具有代表性
萃取量少,具有更高的灵敏度
小范围的取样
|
某些位置无法进行取样
需要侵入封闭式设备
某些萃取液擦拭后造成二次污染
|
|
淋洗法
|
更大的表面积采样,且可以采取无法拆卸的系统
保持系统密闭
更容易操作
取样后有可能不需要重新清洁
可获得整体情况
适用于在线监测
适合对不规则表面进行取样
标准容易调整
|
只能检测到溶于冲洗溶剂的污染物
必须确保冲洗液能够接触到所有表面
无法确认污染物残留的分布
冲洗溶剂量大,有可能稀释残留,导致无法检出
部分设备无合适的取样口
冲洗取样同样可以对部分不规则的器具进行取样
|
擦拭法和淋洗法的选择依据:
|
取样方法
|
擦拭法
|
淋洗法
|
|
选择依据
|
1.设备或部件可进行直接采样(例如拆卸零件、开放式设备),包括使用延伸杆能够达到的区域;
2.最差情况或点可以被识别或被擦拭。
|
1.当直接取样方法不可行或不切实际时,应选择冲洗取样;
2.想要了解整个设备的清洁残留情况时,可选择冲洗取样。
|
擦拭取样的注意事项:
|
器具
|
棉签、容量瓶等器具均不应当对污染物产生不利的影响(例如吸附或者释出物影响污染物含量)。
为防止人为的污染,取样人员擦拭时应佩戴手套。
|
|
取样框
|
不建议使用取样框,缺点如下:
1.当取样框与棉签接触时,取样框会被污染;
2.在每个样本之间需要进行清洁或者更换;
3.棉签接触到取样框时容易造成样品流失;
4.取样框不能用于不规则的取样区域。
|
|
棉签材质
|
1.方便易用;
2.能够将污染物从设备表面提取出来;
3.能够将污染物释放到溶出液中;
4.棉签本身不会出现溶出物影响检测结果;
5.棉签应不会脱落颗粒;
6.棉签的大小和无菌性根据污染物的残留水平而定。
|
|
棉签数量
|
1.原则上建议使用一个棉签取样;
2.仅当一个棉签不能回收到可接受水平的残留物时,才可使用多个棉签。
|
|
棉签溶剂
|
1.棉签溶剂应能溶解目标污染物并溶于萃取液溶剂;
2.应优先选择挥发性有机溶剂,减少溶剂残留的风险;
3.TOC检测必须使用水作为溶剂;
4.擦拭前先用棉签溶剂容器颈部排出多余的溶剂;
5.擦拭后注意去除设备表面的残留;
6.通常不需要对棉签进行预浸泡,但如果棉签有浸出物影响检测时,该方法有可能会去除其影响。
|
|
擦拭顺序
|
擦拭顺序对于控制样本污染很重要。
1.微生物负载的取样应优先进行,其对任何污染最敏感;
2.TOC擦拭取样应在使用有机溶剂的棉签擦拭前完成;
3.使用有机溶剂的擦拭取样应最后完成。
|
|
擦拭方法
|
1.应建立书面的擦拭SOP用于指导员工进行操作;
2.擦拭应覆盖规定的擦拭表面。
|
|
人员
|
1.人员应具备取样的资质;
2.资质应来源于培训和模拟考核;
3.一般推荐进行模拟擦拭,要求擦拭回收率在已经验证的方法的±10%(建议值),且RSD≤15%。
|
|
样品容器
|
1.样品容器必须足够大以容纳萃取溶剂的体积;
2.样品容器(包括盖子)应不会影响萃取的样品,例如不会进行吸附或产生浸出物。
|
|
样品稳定性
|
1.提取前的样品稳定性;
2.提取后的样品稳定性;
3.回收率研究应证明并符合其稳定性。
|
|
提取过程
|
1.常见的提取方法包括:涡旋混合、机械摇动、超声处理;
2.一般来说,提取过程的便利性和时间是考虑的因素,随着时间延长,样品变干的可能性就越大,会影响其回收率。
|
|
分析方法
|
1.一般优先选择专属性的分析方法,例如HPLC;
2.当污染物比较复杂,可选用非专属性的方法,例如TOC。
|
|
擦拭位置
|
1.应当擦拭残留最多的位置;
2.不易清洁、污染物容易累计、污染物持续接触的部位往往是污染物残留最多的位置;
3.企业应进行风险评估选择擦拭位置;
4.擦拭位置最好能用图片的形式展现出来。
|

▲ 来源于ISPE清洁验证指南
淋洗取样的注意事项:
淋洗取样一般分为2种取样方式,一种是取末次清洗液,即最后一遍的清洗溶液。另一种取样方式则是在常规清洁流程之后再次加入提取液,对提取液进行检测。
两种方法各有利弊,在PDA TR 29中其列明了两种取样方法的优缺点:
|
取样方法
|
末次清洗液
|
独立冲洗取样
|
|
优点
|
1.代表通常的清洁过程
2.不需要额外的冲洗溶剂
3.不需要额外操作,设备即可进一步使用
|
1.结果容易用来计算残留量
2.体现清洁结束后残留在表面的污染物
3.如果操作正确,更更容易获得合格的结果
4.循环冲洗回收率更高
5.可以采用其他样品溶液,而不是清洁工艺冲洗溶液
|
|
缺点
|
1.样品代表了可能转移至下批产品的残留的最差条件,因为它反应了最终冲洗液中的残留量,而不是最终冲洗后的表面残留(但是可以证明清洁工艺的耐用性)
2.残留量计算需用到“假设”
|
1.需要额外的步骤
2.需要额外的冲洗溶剂
3.冲洗剂加入方式可能带来污染
|
(2)回收率研究
回收率分为擦拭法回收率和淋洗法回收率,目前国内很多企业都对擦拭法回收率进行了研究,但是并未对淋洗法回收率进行研究,但是实际上,早在1993年FDA发布的清洁验证检查指南中,其就给出了一个“脏罐子”的比喻。
FDA认为如果只对清洗水进行检测,但是实际上脏罐子里的污染物并不溶于水,即使清洗水检测合格了,也无法证明脏罐子是干净的。这实际上就对淋洗水回收率的一个要求,FDA认为取淋洗液样品是有缺点的:
残留物或污染物可能不溶解或被堵塞在设备中,可以推断“不干净的罐”可以被使用。在评价对不干净的药罐的清洁时,特别是那种有干透残留物的,不应该只看淋洗液样品是否干净,而应该看药罐是否干净。
因此,我们也应当对淋洗法的回收率进行研究。
擦拭法回收率的注意事项:
进行正式回收率试验之前,可优先对棉签进行提取率试验,确认棉签提取率符合要求后,继续进行回收率试验;
不同的设备材质会影响回收率的结果,应结合生产设备的材质进行回收率的研究;
回收率的常规做法是至少两人选择三个浓度进行回收率研究,每个浓度擦拭三次,选择单次最低平均回收率作为回收率进行计算;
浓度选择建议从LOQ开始,最高浓度应大于污染物残留限度;
回收率应大于50%(最佳回收率范围70-100%),相对偏差应<15%(PDA TR29中要求RSD应为15-30%)。
当回收率高于90%时,计算限度可不折算回收率(PDA TR29规定>70%时);
回收率会受污染物浓度影响,高浓度或低浓度都有可能具有较低的回收率;
回收率也会受到取样面积的影响,当使用擦拭取样时,擦拭面积会影响到回收率的结果,一般建议的允许范围是擦拭面积的25%-150%;
对于一些可溶性的污染物(例如USP或Merck索引中定义的)且用量远低于溶解度的污染物,可不进行回收率研究,假如这些污染物不会与表面发生反应或被表面吸附。(来源于PDA TR29)
取样人员资质确认时需重复进行回收率研究,标准要求擦拭回收率在已经验证的方法的±10%(建议值),且RSD≤15%。
淋洗法回收率的方法:
模拟冲洗过程的一个方法是在干净的收集容器上方悬挂一个已涂布的材质试样,然后将冲洗液从表面冲过,并收集在收集容器中。另一个方法是在合适材料的烧杯底部涂布残留物,让残留自然晾干,向烧杯中加入冲洗液并轻轻搅拌,搅拌时间同最终冲洗相同。采用移液管移出或从烧杯中倒出冲洗液并分析。第三种方法适用于没有合适材质烧杯的情况,在烧杯底部放置一个材质试样然后同第二种方法一样模拟冲洗。
▲ 来源于PDA TR 29
3.最差品种的选择
在清洁验证中,为了降低工作量和成本,往往会使用产品分组的情况,选择最差品种来进行验证。
作者对统计了FDA在2020年发布的关于清洁验证的警告信:
|
序号
|
时间
|
检查公司
|
|
1
|
2020.02.04-03.13
|
KVK-Tech.Inc
|
|
2
|
2020.02.17-02.20
|
Mayon's Pharmaceuticals.Pvt.Ltd.
|
|
3
|
2020.02.24-03.17
|
Cosmax USA.Inc
|
|
4
|
2020.02.26-03.10
|
Coupler Enterprises
|
|
5
|
2020.03.02-03.06
|
LEC Custan Products Inc
|
|
6
|
2020.03.09-03.12
|
Calvin Scott and Company Inc
|
在所有的警告信中,FDA都有相同的一个描述:
对清洁验证程序进行了适当的改进,特别着重于纳入在药品生产过程中确定为最差情况的条件。最差情况的识别和评估,应包括但不限于:
具有较高毒性的
产品具有较高活性的
产品在清洁溶剂中溶解度较低的产品
具有使其难以清洁的特性的产品
清洁最困难区域的擦拭位置
清洁前的最长放置时间
在其他法规指南和指导文件中也给出了类似的考虑点,见下表:
|
法规或指南
|
考虑点
|
备注
|
|
EU GMP附录15
|
决定采用最差条件的标准可能包括溶解性,清洁能力,毒性和效能。
|
N/A
|
|
PDA TR29
|
溶解度、清洁难易程度
|
应进行实验室研究和试验
|
|
ISPE清洁验证指南
|
溶解度、ADE/PDE、清洁难易程度(残留物特性)、残留物负荷
|
应进行实验室研究和试验
|
|
APIC清洁验证指南
|
溶解度、清洁难易程度
|
ADE/PDE用来评估最小残留标准的运算
|
综上:最差品种的选择评估应至少考虑:溶解度、清洁难易程度、残留物负荷(批次量)、ADE/PDE值,并应当进行实验室研究,以证明评估数据的可靠性。需要注意的是,纯理论性的分析最差品种目前来看是不充分的,所以一定要进行相对应的实验室研究。
同样需要注意的是:最差品种的评估是取最差值,而不是评估“综合实力”。当不同的最差值分别指向不同的品种时,我们应当分别进行验证,而不是选择综合评分最差的品种。
举例:
|
品种
|
ADE/PDE
|
溶解度
|
清洁难易程度
|
批次量
|
|
A
|
7.2
|
3.3
|
6.6
|
200kg
|
|
B
|
6.3
|
7.9
|
3.3
|
150kg
|
|
C
|
2.2
|
2.2
|
2.7
|
100kg
|
|
D
|
5.4
|
4.3
|
7.9
|
200kg
|
|
E
|
3.0
|
6.5
|
1.1
|
250kg
|
* 数值越高证明越恶劣的条件。
从上图可以看出,我们选择最差品种应当选择A、B、D和E,这4个品种都需要研究,而不是选择综合实力最差的A或者D品种。
某些行业专家认为不应当将毒性(ADE/PDE值)作为清洁最差品种来考虑,是因为毒性影响的是清洁残留限度,而不是清洁难易度。但是考虑到部分监管方期望我们将最毒的产品也来进行清洁验证以减少对患者危害的可能性,所以一般还是建议将毒性作为产品最差条件之一。
4.清洁验证/确认的实施
一个完整的清洁验证包含以下3个项目的验证:
清洁方法的验证
DHT(肮脏放置时间)验证
CHT(清洁效期)验证
其中清洁方法的验证就是传统的清洁验证,我们根据风险评估的取样点进行擦拭或淋洗取样,并进行检测,合格后即认为清洁方法是适用的。
但是DHT和CHT研究都是清洁验证不可或缺的部分,需要注意的是,清洁验证不仅仅是验证清洁方法,它还包括整个储存过程,如果清洁干净了,但是后续的储存过程中被污染了,同样不是我们期望的事情。
DHT(肮脏放置时间)验证是清洁验证的一部分,不需要进行额外的研究,只需要在设计清洁验证方案的时候将设备生产结束的时间到清洁的时间进行记录和规定(肮脏放置时间),日常所允许放置的肮脏时间不应大于验证时候放置的时间,例如,我们在进行清洁验证的时候肮脏放置时间验证了24小时,那么在日常清洁过程中,我们应当在生产完毕24小时内完成设备的清洁。
DHT研究的原因是由于对于一般的污染物来说,放置时间越长,其越难被清洁(读者可以想象一下我们煮粥用的锅)。但是同样需要注意的是,DHT时间不应该设置太长,因为化学污染物在长期放置情况下会降解,导致污染物种类发生变化,一般来说,放置24小时是默认不会发生降解的,读者也可以结合自家产品的强制降解试验的数据来评估。
CHT(清洁效期)验证往往是与产品无关的,即对于同一设备,多个产品可使用同一个CHT的报告,即不需要每个产品都进行CHT研究。之所以这样是因为我们在验证清洁方法的时候就已经将化学污染物清洁合格了,故CHT的研究主要是考虑微生物限度和细菌内毒素(若适用)。常规的做法是清洁验证完毕时检测微生物限度及细菌内毒素,等到了放置时间后继续检测微生物限度及细菌内毒素(可在放置过程中增加取样点),均符合标准即可。对于非洁净区内的设备可参考洁净区设备或设置单独的微生物限度标准即可。
还有一个需要考虑的问题是清洁验证/确认设备的放行问题,很多人员在问,是否清洁验证/确认报告完成之前不允许对清洁后的设备进行使用,以避免影响后续品种。实际上这种说法是对的,原则上,清洁验证结束后,设备方可放行用于生产。但是目前很多企业为了生产效率,都将风险控制在工厂内部,提前将设备放行掉,但是在完成清洁验证/确认之前,该设备生产的所有品种暂不放行。
清洁验证/确认完成后,应形成书面的验证报告,并结合数据,来评估验证是否通过,一般来说,清洁验证需要至少3个连续的批次,但是目前工艺验证的批次都是基于统计学来确定了,后续清洁验证的批次估计也要基于统计学来设计,但是目前行业内基本还是按照连续3个批次来执行的。