今日头条
君实PARP抑制剂妇科癌症III期临床积极。君实生物与英派药业合作开发的聚腺苷二磷酸核糖聚合酶(PARP)抑制剂senaparib用于维持治疗晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者的III期临床(FLAMES)达到主要终点。期中分析显示,senaparib可显著延长患者的无进展生存期(PFS),无论患者BRCA突变状态如何,均可获益。两家公司预计近期递交该新药的上市申请。
国内药讯
1.礼来N3pG淀粉蛋白拟纳入突破性治疗品种。礼来新一代N3pG淀粉样蛋白抗体remternetug注射液(包括静脉注射)获国家药监局拟纳入突破性治疗品种,针对的适应症为早期阿尔茨海默病。今年3月,remternetug在中国登记启动一项国际III期研究(CTR20230785),拟评估用于静脉输注治疗具有脑淀粉样蛋白和tau蛋白病理的早期症状性阿尔茨海默病(AD)受试者中的安全性和有效性。
2.华辉安健乙肝中和抗体拟纳入突破性品种。华辉安健乙肝病毒中和抗体新药HH-003注射液获国家药监局拟纳入突破性治疗品种,用于治疗慢性丁型肝炎病毒感染。HH-003拥有双重作用机制,能够阻断病毒入侵肝细胞,打破病毒在肝脏中持续存在的感染和再感染循环;它还潜在具备Fc介导的免疫效应功能,能够清除游离病毒/已感染的肝细胞。该新药目前处于Ⅱ期临床阶段。
3.艺妙神州CAR-T疗法报实体瘤IND。北京艺妙神州1类生物制品IM83嵌合抗原受体T细胞注射液(IM83 CAR-T细胞注射液)的临床试验申请获CDE受理,拟开发用于实体肿瘤的治疗。IM83采用新一代CAR分子设计,提高了CAR-T细胞在体内抑瘤的持续性。在研究者发起的临床研究中,该产品展现出积极的疗效和良好的安全性,被证实能够有效杀伤靶点阳性的肝癌细胞。
4.信达BCMA-CAR-T疗法报IND。信达生物旗下子公司信达细胞制药申报1类生物制品IBI346的临床试验申请获CDE受理。IBI346是信达生物利用罗氏的细胞技术平台开发的新一代CAR-T细胞治疗药物,由P329G BCMA抗体和P329G CAR-T细胞两个部分组成。此前,信达与罗氏基于通用模块化CAR-T平台开发的首款产品Claudin18.2 CAR-T疗法IBI345已于去年2月完成首例患者给药。
5.正大天晴康方PD-1单抗海外授权。康方生物与中国生物制药旗下正大天晴共同合资的正大天晴康方与Specialised公司签署一项合作与许可协议,授予Specialised公司在澳大利亚、新西兰、巴布亚新几内亚,以及新加坡、马来西亚等东南亚11个国家独家商业化PD-1单抗安尼可(派安普利单抗注射液)的权益。正大天晴康方仍保留安尼可在全球范围内的开发权益。该合作总对价约7300万美元,同时正大天晴康方将获得安尼可于授权地区销售净额15%的提成。
6.传奇生物任命Mythili Koneru为CMO。传奇生物宣布任命Mythili Koneru博士为首席医学官,负责监督公司临床开发和医学事务项目。加入传奇之前,Koneru曾担任Marker Therapeutics首席医学官,领导其免疫肿瘤产品组合中细胞疗法和肽疫苗的开发。此前,Koneru还曾担任礼来公司肿瘤免疫学副总裁,主要负责公司早期肿瘤学组合中免疫肿瘤产品的临床开发工作。
国际药讯
1.FDA将审查卫材Aβ抗体上市批准。FDA即将在6月9日召开外周和中枢神经系统药物咨询委员会会议,讨论关于卫材与渤健开发的阿尔茨海默病(AD)药物lecanemab(商品名:Leqembi)上市申请完全批准的决议。Lecanemab是一款Aβ抗体,能与可溶性Aβ聚合体结合以促进它们的清除。今年4月,一项AD患者长期疗效数据显示,与标准护理相比,lecanemab治疗能够延缓(大约延缓两到三年)患者进展到更严重的疾病阶段。
2.默克BTK抑制剂RMS临床被暂停。FDA暂停默克BTK抑制剂evobrutinib治疗复发性多发性硬化症 (RMS) 的部分III期临床试验。临床暂停是因为有2例患者在III期研究中被确定了因药物引起的肝损伤。在美国正在进行的evobrutinib治疗RMS的III期EVOLUTION研究因受试者均已给药超过70天,将按计划继续进行,试验结果也将于2023年第四季度公布。
3.莫德纳mRNA流感疫苗Ⅲ期临床失败。Moderna公司季节性流感疫苗mRNA-1010在北半球开展的III期研究(P302)未达到疗效终点。独立DSMB评估的第一个疗效中期分析显示,mRNA-1010没有达到统计学阈值;临床中未发现新的安全问题。目前,Moderna已开发mRNA-1010的升级版,预计对乙型流感病毒株的免疫原性会有所改善,并计划本月启动一项验证性III期试验。
4.渤健引进可入脑Aβ靶向药物。渤健行使选择权,获得Denali公司抗体运输载体(ATV)平台开发的淀粉样β蛋白(Aβ)靶向药物ATV:Aβ的研发和商业化独家授权。ATV:Aβ可穿越血脑屏障,旨在增加靶向Aβ的抗体疗法在大脑中的暴露和靶向作用,从而可能实现改善斑块清除和/或减少淀粉样相关影像异常(ARIA)。Denali将获得一次性选择权行使付款,以及潜在的研发和商业里程碑付款。
5.诺和诺德引进糖尿病生物打印组织疗法。诺和诺德与加拿大生物技术公司Aspect Biosystems将利用后者专有的生物打印技术平台,开发多达4种生物打印组织候选疗法,以替代、修复或补充体内的生物功能,用于糖尿病和肥胖症的治疗。根据协议,Aspect将获得7500万美元的首期付款,每款产品最多6.5亿美元的开发、监管、商业和销售里程碑后期付款,以及产品的销售分成,交易总价值高达26亿美元。
6.基因治疗药物公司Function完成A轮融资。Function Oncology公司宣布完成2800万美元的A轮融资。Function Oncology的功能基因组学平台能够利用CRISPR技术直接对患者的临床样本进行基因调控,对患者的肿瘤进行个体化、全面的分析,揭示无法通过传统基因组分析完全确定的药物靶点依赖性。此轮融资将进一步推动该公司针对已知或新型癌症驱动因子的新药研发。
7.生技公司VintaBio获6500万美元融资。生物技术公司VintaBio宣布完成6400 万美元融资并聘请David Radspinner担任首席执行官一职。VintaBio是一家位于费城的 CDMO,服务于细胞和基因治疗市场, 由Junwei Sun博士和Shangzhen Zhou博士创立。Radspinner曾在赛默飞世尔和通用电气医疗集团(GE Healthcare)担任多个领导职位,还曾担任生命科学产品和服务提供商Cytiva的美洲副总裁。David在获得亚利桑那大学分析化学博士学位后,曾在礼来和赛诺菲工作。
医药热点
1.预防新冠公众佩戴口罩指引发布。4月12日,国务院联防联控机制疫情防控组发布《预防新型冠状病毒感染公众佩戴口罩指引》,明确了应佩戴口罩、建议佩戴口罩、可不佩戴口罩的常见情形或场景。《指引》指出,露天广场、公园等室外场所,以及人员相对固定的室内工作场所和会议室等7种情形或场景可不佩戴口罩。
2.上海市产科临床质量控制中心成立。4月12日,上海市产科临床质量控制中心正式挂靠上海市第一妇婴保健院,上海市第一妇婴保健院副院长应豪任上海市产科临床质量控制中心主任。未来,上海市产科临床质控中心将围绕母胎一体质控模式,加强“产科—助产—围产麻醉—新生儿”核心科室、支撑学科群和辅助科室联动的质控体系,同时建立危重孕产妇多学科团队抢救机制。
3.“泛血管介入复杂系统”基础科学中心启动。4月12日,由葛均波院士领衔的国家自然科学基金委员会“泛血管介入复杂系统”基础科学中心启动会在复旦大学附属中山医院举行。这是我国交叉科学领域的首个医学类基础科学中心,该中心的成立对突破我国当前泛血管介入器械进口依赖度高、原创能力不足、临床转化效率较低等关键问题具有重要意义。
评审动态
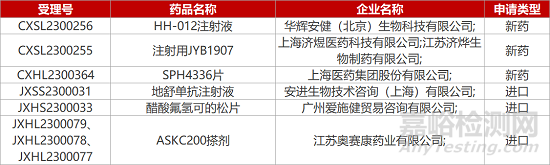
1. CDE新药受理情况(04月13日)
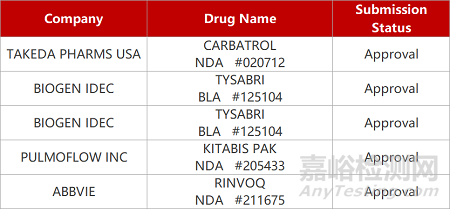
2. FDA新药获批情况(北美04月11日)