今日头条
海思科长效DPP-4抑制剂降糖临床积极。海思科二肽基肽酶-4(DPP-4)超长效抑制剂HSK7653片在ADA年会上公布单药治疗2型糖尿病(T2DM)的Ⅲ期临床积极结果。与安慰剂相比,HSK7653(10mg和25mg)组用药24周后患者HbA1c较基线降幅显著更大,有更多的患者HbA1c控制在<7.0%或<6.5%;两组不良事件发生率相似。此外,海思科也在会议上公布了治疗糖尿病周围神经痛(DPNP)的“思美宁HSK16149”胶囊的Ⅲ期临床积极结果。
国内药讯
1.艾伯维IL-23抑制剂中国报产。艾伯维IL-23抑制剂利生奇珠单抗(risankizumab,曾用名瑞莎珠单抗)注射液及其皮下注射剂型的上市申请获国家药监局受理。Rrisankizumab旨在通过与IL-23 p19亚基结合来选择性阻断IL-23,以治疗多种慢性免疫介导疾病。艾伯维已在国内登记7项临床研究,分别用于治疗活动性银屑病关节炎,中重度溃疡性结肠炎、克罗恩病。其中,用于治疗克罗恩病的两项III期研究已完成。
2.诺和诺德启动减肥复方中国III期研究。诺和诺德双重作用机制复方CagriSema登记启动一项III期临床(CTR20232030),拟评估在中国超重或肥胖受试者中Cagrilintide s.c. 2.4 mg联合Semaglutide s.c. 2.4 mg(CagriSema s.c.2.4 mg/2.4 mg)每周一次给药的有效性和安全性。该项试验的主要研究者由中国人民解放军总医院母义明博士担任。CagriSema由长效胰淀素类似物cagrilintide和GLP-1受体激动剂司美格鲁肽组成。
3.诺洁贝眼科AAV基因疗法报IND。苏州诺洁贝生物1类生物制品“NGGT001注射液”的临床试验申请获CDE受理。NGGT001是一款基于rAAV2的基因疗法,通过表达密码子优化的人CYP4V2,用于治疗罕见的结晶样视网膜变性(BCD)。在BCD相关细胞模型中,由NGGT001介导的CYP4V2表达有效地挽救了由CYP4V2突变引起的表型缺陷,显示出恢复自噬流活性,减少脂质积累和保持细胞活力的治疗潜力。
4.同源康EGFR/HER2抑制剂国内获批临床。同源康医药自主研发的新一代口服小分子EGFR/HER2酪氨酸激酶抑制剂(TKI) TY-4028获国家药监局临床许可,拟开发用于治疗携带EGFR或HER2 20号外显子插入突变的局部晚期或转移性非小细胞肺癌。TY-4028旨在通过抑制跨膜受体蛋白及其下游信号分子的磷酸化来调节肿瘤细胞的增殖和凋亡。今年4月,该新药已在美国获得临床批件。同源康医药计划在中美同步TY-4028的临床开发。
5.美德纳(中国)公司落户上海。Moderna在中国新注册的美德纳(中国)生物科技有限公司在上海与闵行区政府举行投资协议签约仪式。未来,Moderna将会在中国建厂并进行生产,生产的任何药物都将专门针对中国患者,而不会出口;在中国率先落地的产品将包括Moderna的呼吸道疫苗产品,例如呼吸道合胞病毒(RSV)疫苗和流感疫苗。根据协议,Moderna总投资规模有望达到10亿美元量级。
6.中生制药与武田达成合作许可协议。武田与中国生物制药全资附属公司invoX Pharma旗下F-star Therapeutics达成合作许可协议,利用后者专有的全人Fcab及四价mAb²平台,针对未披露的免疫肿瘤学靶点的新型Fcab结构域,合作开发新一代多特异性免疫候选疗法。根据协议,武田将支付一笔未披露金额的预付款,约10亿美元里程碑金额,以及一定比例的销售分成。F-star公司将保留研究、开发及商业化包含若干其他Fcab结构的抗体的权利。
国际药讯
1.莫德纳RSV疫苗递交全球监管申请。Moderna公司编码RSV融合前F糖蛋白的mRNA疫苗mRNA-1345已向欧洲药品管理局(EMA)、瑞士Swissmedic以及澳大利亚TGA提交了上市申请,用于60岁以上成人预防RSV相关的下呼吸道疾病(RSV-LRTD)和急性呼吸疾病(ARD)。在Ⅲ期临床ConquerRSV中,mRNA-1345预防出现两种或两种以上RSV-LRTD症状的效力达到83.7%。在美国,该疫苗已向FDA提交滚动BLA上市申请。
2.诺华CD20单抗治疗RMS长期疗效积极。诺华在EAN2023年会上公布其每月一次皮下注射给药的CD20单抗Kesimpta(奥法妥木单抗)治疗复发型多发性硬化症(RMS)的扩展研究(ALITHIOS)长期结果。数据显示,Kesimpta连续治疗长达5年,在降低复发率和显著抑制MRI病变活动方面均显示出持续的疗效,NEDA-3(无疾病活动证据)达标率逐年升高;从特立氟胺转换为使用奥法妥木单抗的患者,在五年治疗期间内年复发率显著降低。
3.安斯泰来Claudin 18.2抗体获优先审评资格。安斯泰来CLDN18.2单抗zolbetuximab的生物制品许可申请(BLA)获FDA受理,用于一线治疗CLDN18.2阳性局部晚期不可切除或转移性HER2阴性胃或胃食管结合部(GEJ)腺癌患者。FDA同时授予其优先审评资格,PDUFA日期为明年1月12日。在Ⅲ期试验(GLOW)中,与安慰剂联合CAPOX化疗相比,zolbetuximab与CAPOX联合治疗显著改善无进展生存期(8.21个月vs6.80个月)和总生存期(中位OS:14.39个月vs12.16个月)。
4.礼来启动2项三靶点激动剂III期临床。礼来在Clinicaltrials.gov网站上登记注册GLP-1R/GIPR/GCGR三靶点激动剂Retatrutide用于治疗肥胖/超重患者的两项国际III期临床(TRIUMPH-1和TRIUMPH-2)。TRIUMPH-1预计纳入2100例肥胖症/超重患者,患者亚组包括膝关节炎(OA)、睡眠呼吸阻塞(OSA)亚组;TRIUMPH-2针对合并肥胖/超重的2型糖尿病患者,预计纳入1000例患者,同样包含OSA亚组。两项研究开展地区都包含中国。
5.IL-36R单抗预防GPP的IIb期临床积极。勃林格殷格翰在WCD大会上公布IL-36R单抗spesolimab(佩索利单抗)用于预防泛发性脓疱型银屑病(GPP)急性发作的EFFISAYIL™ 2临床试验的最新数据。与安慰剂相比,佩索利单抗能显著降低GPP发作风险84%长达48周。临床中,佩索利单抗和安慰剂治疗的患者不良事件发生率相似。此前,佩索利单抗已分别获得FDA和NMPA授予的突破性疗法认定。
6.TAC-T细胞疗法早期临床积极。Triumvira公司在ESMO2023和ASCO2023大会上公布其TAC-T细胞疗法TAC01-HER2治疗HER2阳性实体肿瘤的I/II期临床最新结果。数据显示,TAC01-HER2在经DL 2-4化药预处理的胃癌/胃食管交界性腺癌/食道癌患者中,ORR为33%,DCR为83%。在最高剂量水平下观察到1例3级肺炎的DLT(剂量限制性毒性)和1例3级CRS,均通过标准护理措施解决;所有队列均未报告神经毒性。
医药热点
1.国自然放宽女性科研人员“杰青”年龄限制。近日,国家自然科学基金委员会党组召开会议,听取国家自然科学基金对女性科研人员支持情况汇报,审议通过进一步加强对女性科研人员支持的建议。会议明确,从2024年起,将女性科研人员申请国家杰出青年科学基金项目的年龄限制由45周岁放宽到48周岁。
2.全国疾控电话流调专用号码启用。6月26日,“95120”全国电话流调系统在全国各级疾控机构正式启用。该系统具有统一外呼号码、AI智能外呼、来电提醒和挂机短信、多终端应用等功能,可实现全时段、多场景开展电话流调,有效降低被流调人员拒接率和漏接率,减轻基层流调人员工作压力和强度,提升工作效率。
3.国家医保局就药品续约竞价征求意见。7月4日,国家医保局发布《谈判药品续约规则(2023年版征求意见稿)》《非独家药品竞价规则(征求意见稿)》。与2022年谈判药品续约规则相比,《谈判药品续约规则(2023年版征求意见稿)》明确纳入常规目录管理的条件有所增加,新增条件为:谈判进入目录且连续纳入目录“协议期内谈判药品部分”超过8年的药品(2017年版目录谈判药品自2018年起计算,2018年版目录谈判药品自2019年起计算,2019年及以后按目录执行年份计算)。
评审动态
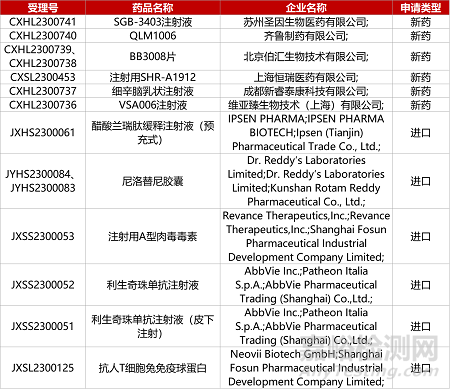
1. CDE新药受理情况(07月06日)
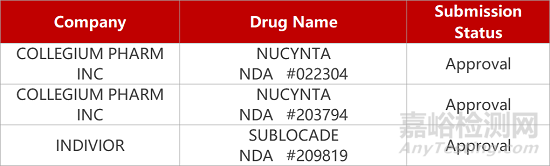
2. FDA新药获批情况(北美07月03日)