今日头条
蔼睦引进眼科新药获批AMD临床。蔼睦医疗从韩美制药引进的整合素(integrin)调节剂AM011注射液获国家药监局临床许可,拟开发用于治疗干性(非渗出性)年龄相关性黄斑变性(AMD)。AM011(risuteganib,又名Luminate)能够调节包括线粒体功能障碍在内氧化应激反应的多个通路,旨在通过多种途径以达到恢复视网膜稳态的治疗目的。今年5月,该新药已获FDA批准开展用于治疗干性AMD的Ⅱb/Ⅲ期临床。
国内药讯
1.深圳康泰狂犬病疫苗获批上市。康泰生物冻干人用狂犬病疫苗(人二倍体细胞)获国家药监局批准上市,用于预防狂犬病。该产品采用狂犬病病毒固定毒株(PM1503-3M)接种人二倍体细胞,无外源病毒和潜在致瘤风险。在临床研究中,这款疫苗具有良好的安全性、免疫原性和免疫持久性。目前,临床缺乏治疗狂犬病的有效方法。
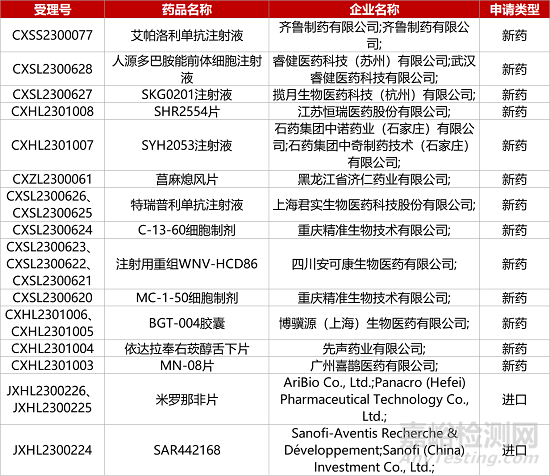
2.齐鲁PD-1抗体报产。齐鲁制药PD-1抗体1类新药艾帕洛利单抗注射液上市申请获CDE受理。8月12日,该公司研发的复方抗体制剂艾帕洛利单抗/托沃瑞利单抗(QL1706)注射液上市申请获CDE受理,为全球首个PD-1/CTLA-4组合抗体新药申报上市。QL1706可同时抑制PD-1和CTLA-4,并且CTLA-4抗体成分在体内具有更短的清除半衰期,因此该产品既有协同作用机制,又降低了CTLA-4抗体产生的毒性,拟开发用于宫颈癌、非小细胞肺癌和鼻咽癌等多项适应症的治疗。
3.恒瑞HER2-ADC启动III期临床。恒瑞医药HER2-ADC新药注射用SHR-A1811登记启动一项III期研究(SHR-A1811-307),评估单药或联合帕妥珠单抗对比曲妥珠单抗+帕妥珠单抗+多西他赛治疗HER2阳性复发或转移性乳腺癌的疗效与安全性。值得一提的是,该新药已有四项适应症被CDE纳入突破性治疗品种,涉及HER2低表达或HER2阳性的复发或转移性乳腺癌,HER2突变的晚期非小细胞肺癌和晚期结直肠癌。
4.BI双机制减重疗法中国报Ⅲ期临床。勃林格殷格翰与Zealand开发的GLP-1/GCG双重激动剂BI 456906(Survodutide)向CDE递交临床试验申请,拟开展用于超重或肥胖人群的Ⅲ期临床。今年8月,该新药针对这一适应症已登记启动三项注册Ⅲ期临床。Ⅱ期临床数据显示,完成46周治疗的BI 456906(4.8mg)组患者体重下降接近19%;两个最高剂量组中患者体重下降至少20%的比例高达40%(安慰剂组为0%)。
5.普祺JAK抑制剂凝胶Ⅱ期临床积极。普祺医药JAK抑制剂1类新药PG-011凝胶(普美昔替尼凝胶)在治疗结节性痒疹的Ⅱ期临床达到预期疗效指标。与安慰剂相比,普美昔替尼凝胶治疗组4周后达到临床意义瘙痒降低、以及结节面积明显缩小的受试者比例显著更高。此外,普美昔替尼凝胶显示出良好的全身和局部安全性及耐受性,系统入血量极少。
国际药讯
1.葛兰素史克创新JAK抑制剂获批上市。葛兰素史克JAK1/JAK2/ALK2抑制剂Ojjaara(momelotinib)获FDA批准上市,用于治疗中度或高风险骨髓纤维化,包括原发性骨髓纤维化或继发性骨髓纤维化(真性红细胞增多症后和原发性血小板增多症后)成人贫血患者。在Ⅲ期试验MOMENTUM中,与安慰剂相比,momelotinib治疗组24周时患者达到总体症状评分(TSS)较基线改善超过50%的比例更高(25%vs9%,p=0.0095)。
2.武田Entyvio皮下制剂报克罗恩病BLA。FDA受理武田维多珠单抗(Entyvio)皮下制剂的生物制品许可申请(BLA),用于中重度活动性克罗恩病(CD)成人患者在接受静脉注射Entyvio诱导治疗后的维持治疗。在Ⅲ期临床VISIBLE 2中,与安慰剂相比,Entyvio皮下注射剂用于维持治疗显著增加患者的临床缓解率(48.0%vs34.3%,p=0.008)。值得一提的是,Entyvio皮下注射治疗中重度活动性溃疡性结肠炎(UC)的申请也正接受FDA监管审查。
3.第一三共两款新药获欧盟CHMP推荐。第一三共FLT3抑制剂Quizartinib(Vanflyta)获欧洲药品管理局(EMA)人用药品委员会(CHMP)推荐批准,用于治疗初诊FLT3-ITD阳性的急性髓系白血病(AML)成人患者,该药物可联合标准治疗和阿糖胞苷巩固治疗,以及单药用于巩固后的持续治疗。CHMP同时也推荐批准该公司HER2-ADC新药Enhertu(注射用德曲妥珠单抗)新适应症,用于治疗无法切除或转移性HER2阳性非小细胞肺癌(NSCLC)经治患者。
4.罗氟司特乳膏向FDA报sNDA。Arcutis公司PDE4抑制剂改良型新药罗氟司特(0.15%)乳膏已在美国递交补充新药申请 (sNDA),用于治疗6岁及以上人群的轻中度特应性皮炎(AD)。在III期研究(INTEGUMENT-2)中,与安慰剂相比,罗氟司特(0.15%)乳膏治疗组第四周达到IGA评估为“清除”或“几乎清除”且相较基线改善2级以上的患者比例更高(28.9%vs12.0%,P<0.0001)。此前,该乳膏已获批用于斑块状银屑病的治疗。
5.σ1受体激动剂AD临床研究积极。Anavex公司σ1受体激动剂Anavex2-73(blarcamesine)治疗早期阿尔茨海默病(AD)引起的轻度认知障碍(MCI)的IIb/III研究Anavex2-73-AD-004最新结果积极。此前,该项研究已达到主要终点以及关键次要终点。新的分析数据显示,blarcamesine能够显著减缓患者AD相关认知功能下降。此外,患者血浆中病理性β淀粉样蛋白水平显著降低;MRI(磁共振成像)扫描的病理性脑萎缩率显著减缓。
6.艾伯维退回BCMA/CD3抗体许可权。艾伯维将终止与Harpoon公司关于三特异性T细胞激活疗法HPN217达成的全球独家许可协议,将HPN217的全球独家许可权益归还给Harpoon公司。HPN217是一款靶向BCMA的三特异性T细胞激活构建物(TriTAC),包含三个抗体衍生的结合域:结合多发性骨髓瘤细胞的BCMA、与T细胞结合的CD3和延长半衰期的白蛋白。此前HPN217已获得FDA快速通道指定和孤儿药资格。
医药热点
1.上海227家“互联网+”医疗服务纳入医保支付。上海市医保局日前发布“互联网+”医疗服务纳入医保支付范围定点医疗机构名单。根据名单,上海市已将227家定点医疗机构提供的“互联网+”医疗服务纳入基本医疗保险支付范围。其中,中医医院类别中,有上海中医药大学附属龙华医院、曙光医院、岳阳中西医结合医院等三甲医院,也有黄浦区香山中医医院、长宁区天山中医医院、上海泰坤堂中医医院等在区域内颇具特色的中医医疗机构。另外,全市16区上百家社区医疗机构均在名单上,方便市民根据自身情况便捷就医。
2.猴痘被纳入乙类传染病管理。国家卫健委日前发布公告,根据《中华人民共和国传染病防治法》相关规定,自2023年9月20日起将猴痘纳入乙类传染病进行管理,采取乙类传染病的预防、控制措施。2023年8月1日-31日,中国内地(不含港澳台)新增报告501例猴痘确诊病例,98.9%病例为男性,其中5例为女性。绝大多数病例临床表现典型,主要为发热、疱疹、淋巴结肿大等症状,无重症、死亡病例。
3.同济大学新增一所附属医院。近日,同济大学医学院发布公告,宣布新增一所附属医院,上海市眼科医院将挂牌“同济大学附属眼科医院(筹)”。上海市眼科医院是上海市唯一的市级公立眼科专科医院,是上海申康医院发展中心直属的三级医疗单位,同时也是复旦大学公共卫生学院教学科研基地以及上海健康医学院教学实习基地,建有“眼卫生学”和“眼公共卫生大数据与人工智能应用”重点学科。
评审动态
1. CDE新药受理情况(09月16日)
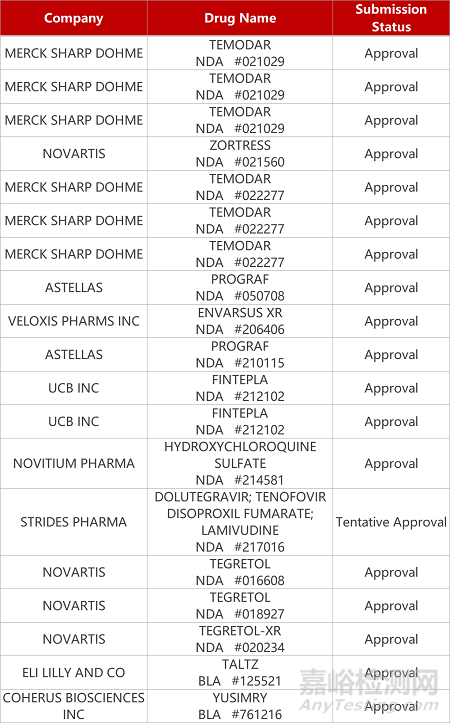
2. FDA新药获批情况(北美09月14日)