今日头条
和黄VEGFR抑制剂美国获批上市。和黄医药与武田联合开发的VEGFR抑制剂呋喹替尼获FDA批准上市,用于治疗既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者,包括既往接受过抗VEGF治疗或抗EGFR治疗的患者。在全球III期试验 (MRCT) FRESCO-2研究中,与安慰剂相比,呋喹替尼治疗组的mOS延长2.6个月,mPFS延长1.9个月。今年6月,该新药在欧盟提交新药上市申请并获EMA受理。
国内药讯
1.恒瑞JAK1抑制剂报皮炎NDA。恒瑞口服JAK1抑制剂SHR0302的新适应症上市申请获CDE受理,拟定适应症为“用于对局部外用治疗或其他系统性治疗应答不充分或不耐受的成人和12岁及以上青少年中重度特应性皮炎(AD)患者”。SHR0302可通过抑制JAK1信号传导发挥抗炎和抑制免疫的生物学效应。此前,SHR0302已向CDE递交用于治疗中重度AD和活动性强直性脊柱炎(AS)的两项新药申请。
2.宜明昂科CD47抑制剂获孤儿药资格。宜明昂科靶向CD47的SIRPαFc融合蛋白IMM01获FDA授予孤儿药资格,联合阿扎胞甘治疗慢性粒单核细胞白血病(CMML)。IMM01可特异性激活巨噬细胞,使其将肿瘤细胞的抗原传递给下游的T细胞,从而起到显著的肿瘤免疫治疗效果。在中国,IMM01已有多个适应症进入II期临床开发,涵盖血液肿瘤以及实体瘤。
3.百济神州CDK4抑制剂启动Ⅰ期临床。百济神州开发的CDK4选择性抑制剂BGB-43395在Clinicaltrials.gov网站上注册一项Ⅰ期临床试验,拟评估单药或联合氟维司群或来曲唑治疗HR+/HER 2-乳腺癌(BC)和其他晚期实体瘤的安全性与初步疗效。BGB-43395有最佳的CDK4/CDK6选择性,同时具有最强的CDK4活性,有望比CDK4/6抑制剂有更好的疗效与更低的毒性。日前,NMPA已受理BGB-43395片的临床试验申请。
4.康弘THR-β激动剂获批NASH临床。康弘药业自主研发的甲状腺激素β受体(THR-β)选择性激动剂KH629获FDA批准开展新药研究,拟开发用于治疗非酒精性脂肪性肝炎(NASH)。今年9月,CDE已受理这款1类化药递交的临床试验申请。前期已完成的研究结果显示,KH629片安全性较好,并具有良好的治疗NASH的潜力。
5.和誉FGFR4抑制剂获批临床。和誉医药FGFR4抑制剂ABSK012获FDA批准开展首次人体Ⅰ期临床,拟评估单药用于治疗晚期实体瘤患者的安全性与有效性。在临床前研究中,ABSK012在体外及细胞中均对野生型FGFR4及FGFR耐药突变体表现出良好的活性,并在FGF19驱动及FGFR4突变体模型中具有较好的体内功效。今年4月,该新药已获得FDA授予用于治疗软组织肉瘤(STS)的孤儿药资格。
国际药讯
1.礼来GLP-1R/GIPR激动剂获批用于减重。礼来制药GLP-1R/GIPR双靶点激动剂Zepbound(tirzepatide)获FDA批准新适应症,用于治疗肥胖或超重患者,减轻体重并保持体重稳定。在Ⅲ期临床SURMOUNT-1中,在饮食和运动辅助基础上,Zepbound(15mg)治疗组患者平均减重48磅(约43.5斤),三分之一的患者能够减轻超过58磅(约52.6斤),相当于体重减轻25%。此前,Tirzepatide(替尔泊肽)已获FDA批准治疗2型糖尿病。
2.大冢降血压医疗器械获批上市。FDA批准大冢医疗及其子公司Recor Medical开发的Paradise超声肾脏去神经支配(RDN)系统上市,用于药物不能充分控制血压的高血压患者的辅助治疗。Paradise RDN系统旨在通过抑制肾动脉周围的交感神经来降低血压,从而减少可能导致高血压的过度激活。在Ⅲ项临床中,与接受假治疗相比,RDN系统治疗显著降低患者的日间动态收缩压(dASBP),降低幅度更大。
3.礼来启动KRAS G12C抑制剂肺癌Ⅲ期临床。礼来新一代KRAS G12C抑制剂LY3537982在Clinicaltrials.gov网站上注册一项Ⅲ期临床,拟评估LY3537982联合PD-1抑制剂Keytruda加或不加化疗联合治疗非小细胞肺癌(NSCLC)有效性和安全性。该项临床计划入组1016例患者,预计2026年10月初步完成。公布于AACR2023会议上的早期数据显示,LY3537982单药治疗NSCLC初治患者的疾病控制率DCR为88%,在经治患者中的DCR为64%。
4.儿童PGHD口服药长期疗效积极。Lumos Pharma公司生长激素促分泌素受体(GHSR)激动剂LUM-201(ibutamoren)治疗儿童生长激素缺乏症(PGHD)的Ⅱ期试验OraGrowtH210达到所有主要和次要终点。在治疗第六个月和第12个月时,LUM-201(1.6mg/kg)的年化身高速度(AHV)分别为8.2cm/年和8.0cm/年,与重组生长激素(rhGH)相比达到非劣效性标准,而且疗效维持长达两年。研究中,未发现新的安全性问题。
5.CD38抗体获自免病突破性疗法认定。HI-Bio公司差异化CD38抗体菲泽妥单抗(TJ202/MOR202)获FDA授予突破性疗法认定,用于治疗原发性膜性肾病(PMN)。MOR202旨在通过抗体依赖性细胞毒性和抗体依赖性细胞吞噬作用杀伤表达CD38的肿瘤细胞,具有治疗多发性骨髓瘤及自身免疫性疾病的潜力。天境生物拥有菲泽妥单抗在大中华地区所有适应症的独家开发和商业化权益。
6.诺华1.03亿美元收购一张FDA优先审评劵。蓝鸟生物日前透露,已与诺华达成一项转让协议,在其一次性基因疗法lovo-cel用于治疗镰状细胞病(SCD)的生物制品许可申请(BLA)正式获得FDA批准后,将以1.03亿美元的价格向诺华转让一张FDA优先审评券(PRV)。今年4月,lovo-cel已向FDA提交BLA申请并获得受理,PDUFA日期为2023年12月20日。这将是蓝鸟生物今年第三次出售PRV。
医药热点
1.重庆大学新增一所附属医院。11月8日,重庆市人民医院正式挂牌“重庆大学附属人民医院”。这是重庆市卫健委和重庆大学合作共建项目,旨在促进校院双方资源共享、优势互补,将临床和教学有效结合,有力提升重庆市人民医院区域辐射能力,推动落实“人才兴院”战略目标,旨在打造西部一流、全国有影响力的医学科学平台。未来,双方将探索高校附属医院建设新模式,增强高层次人才集聚效应,助力推动重庆建设成为全国医学高地。
2.天津市眼科专科联盟成立。11月4日,由天津市眼科医院牵头组建的天津市眼科专科联盟正式成立。该联盟的成立,旨在联合来自天津、河北、福建、甘肃、新疆、陕西、黑龙江等7省市29家成员单位,促进眼科优质资源的下沉和均衡布局、成员单位之间的合作与交流,整合各成员单位的资源,共同推进眼科医疗技术的创新和发展。
3.安徽省卫健委两名新领导上任。近日,据安徽省卫健委官网“领导分工”一栏更新显示,刘志荣任安徽省疾病预防控制局党组书记、局长,省卫生健康委员会党组成员、副主任(兼);孙云任安徽省卫生健康委党组成员、省纪委监委驻省卫生健康委纪检监察组组长、二级高级监察官。
评审动态
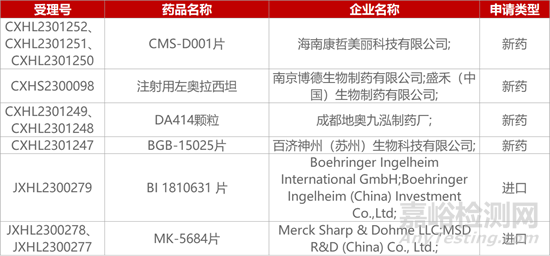
1. CDE新药受理情况(11月09日)
2. FDA新药获批情况(北美11月08日)