您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-04-26 08:11
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
常山生化GLP-1R激动剂报产。河北常山生化药业旗下常山凯捷健生物提交的艾本那肽注射液上市申请获CDE受理,拟用于在饮食控制和运动基础上改善2型糖尿病患者的血糖控制。艾本那肽注射液是一款长效GLP-1受体激动剂,此前已在中国2型糖尿病患者中开展的III期临床研究中达到了主要终点和关键次要终点。患者接受艾本那肽注射液治疗24周后,其血糖水平显著降低,且疗效维持长达52周。
国内药讯
1.君实PD-1单抗在香港报产。君实生物PD-1抑制剂特瑞普利单抗向香港卫生署药物办公室(DO)提交上市申请并获得受理,拟联合顺铂/吉西他滨一线治疗转移性或复发性局部晚期鼻咽癌成人患者,以及单药治疗复发性、不可切除或转移性鼻咽癌。在Ⅲ期临床JUPITER-02中,特瑞普利单抗联合化疗使患者的疾病进展或死亡风险降低48%,死亡风险降低37%。
2.科伦博泰ADC亮相ASCO。科伦博泰宣布将在ASCO2024年会上口头报告Trop2 ADC新药SKB264两项临床研究的最新数据。这两项临床分别为:SKB264用于治疗局部复发性或转移性三阴乳腺癌经治患者的Ⅲ期临床OptiTROP-Breast01;SKB264联合PD-L1单抗KL-A167一线治疗晚期非小细胞肺癌患者的Ⅱ期临床OptiTROP-Lung01。SKB264是科伦博泰采用专有毒素-连接子策略研发的一款创新ADC,抗体药物偶联比(DAR)平均值高达7.4。
3.和誉肝癌新药获孤儿药资格。和誉医药自主研发的小分子FGFR4抑制剂依帕戈替尼(irpagratinib/ABSK011)获FDA授予孤儿药资格,用于治疗肝细胞癌(HCC)。在具有过表达FGF19的HCC细胞中,ABSK011可以通过抑制FGFR4的自身磷酸化并阻断FGFR4向下游通路活化的信号转导,最终抑制HCC患者的肿瘤。临床数据显示,ABSK011(每日两次)治疗的客观缓解率(ORR)达40.7%。
4.康方双抗实体瘤早期临床积极。康方生物PD-1/VEGF双抗依沃西(AK112/SMT112)在治疗晚期实体瘤(包括卵巢浆液性癌、MSS结直肠癌和其他癌症)的Ⅰa期临床中获积极结果。中位随访为12.8个月时,依沃西在这类被认为对单药免疫治疗缺乏响应的肿瘤患者中达到了25.5%的客观缓解率(ORR),疾病控制率(DCR)为63.8%,且具有良好的安全性。详细数据已发表于《癌症免疫治疗杂志》(JITC)期刊上。
5.通化东宝双靶点减肥药获批临床。通化东宝1类化药注射用THDBH120获国家药监局临床试验默示许可,拟开发用于超重/肥胖患者的长期体重管理。THDBH120是一款GLP-1/GIP双靶点激动剂,通过分子设计将GLP-1和GIP这两种促胰岛素的作用整合至一个多肽分子中,同时提高了代谢稳定性,从而改善血糖控制。去年年底,该新药已获批开展用于治疗2型糖尿病的临床研究。
6.迈诺威病理性瘢痕新药获批IND。迈诺威医药拟用于预防和治疗病理性瘢痕的创新药MI151凝胶获FDA临床许可。MI151可抑制成纤维细胞增殖和TGF-β1的产生,同时可以影响TNF-α、IL-1β等炎症细胞因子和粘附分子的产生以及基质重塑因子的表达,有望通过抗炎和抗纤维化的双重作用来治疗瘢痕。在临床前研究中,MI151已显示出积极治疗效果;且具有良好的安全性。
7.蓝纳成生物完成3亿元B+轮融资。东诚药业宣布,旗下蓝纳成生物已完成B+轮融资金额3亿元,将适时开展IPO融资上市。蓝纳成由东诚药业与国际分子影像及纳米医学领域专家陈小元教授联合创立。目前,该公司多个用于癌症的1类诊疗一体化创新药物已进入临床阶段,包括:靶向PSMA的放射性体内治疗药物177Lu-LNC1003注射液、用于前列腺癌诊断的1类创新核药氟[18F]思睿肽注射液、伴随诊断试剂68Ga-FAPI-46注射液、靶向FAP的放射性体内诊断药物氟[18F]纤抑素注射液、靶向FAP的放射性体内治疗药物177Lu-LNC1004注射液等。
国际药讯
1.Utility公司创新抗生素获批上市。Utility公司口服β-内酰胺抗生素pivmecillinam(商品名为Pivya)获FDA批准上市,用于治疗由大肠杆菌、奇异变形杆菌和腐生葡萄球菌引起的非复杂性尿路感染(UTIs)。Pivmecillinam是mecilinam的前体化合物,它通过干扰细菌细胞壁的合成来杀死细菌。在临床试验中,Pivya治疗相比安慰剂提高了患者的综合反应率(62%vs10%);与布洛芬相比,Pivya组患者的综合反应率也显著提高(66%vs22%)。
2.诺华放射性配体疗法获批用于儿童。诺华放射性配体疗法Lutathera(Lu 177 dotatate)获FDA批准扩展适用范围,用于治疗生长抑素受体阳性(SSTR+)胃肠胰神经内分泌肿瘤(GEP-NET)的儿童(12-18岁)患者。Lutathera是首款FDA批准的放射性配体疗法,能结合肿瘤细胞表面的生长抑素受体进入细胞,通过放射性对肿瘤细胞造成损伤。2018年,FDA已批准该药物用于治疗经治SSTR阳性的GEP-NET患者。
3.安斯泰来前列腺癌新药获批新适应症。安斯泰来AR抑制剂恩扎卢胺(enzalutamide)获欧盟委员会(EC)批准新适应症,单药或与雄激素剥夺治疗(ADT)联合,用于不适合挽救性放疗的高风险生化复发性(BCR)、非转移性激素敏感性前列腺癌(nmHSPC)成年男性。在Ⅲ期EMBARK试验中,与亮丙瑞林相比,恩扎卢胺单药或与亮丙瑞林联合用药分别降低了36.9%和57.6%的癌症扩散或死亡的风险。
4.Endeavor公司融资开发肺纤维化新药。Endeavor公司宣布完成1.325亿美元的C轮融资,以用于加速其小分子抑制剂ENV-101以及HER3靶向抗体偶联药物(ADC)ENV-501的临床开发。ENV-101旨在通过抑制过度激活的Hedgehog(Hh)信号通路来提高患者的肺功能,并逆转特发性肺纤维化(IPF)和进行性肺纤维化(PPF)患者肺部的纤维化,该新药目前已处于Ⅱ期临床阶段。此外,Endeavor也计划在今年启动ENV-501的Ⅰ/Ⅱ期临床试验。
5.癌症小分子药物公司Flindr完成A轮融资。Flindr Therapeutics宣布完成2000万欧元的A轮融资,主要用于加速其靶向RNF31的潜在“first-in-class”小分子抑制剂的开发,应用于实体瘤和血液恶性肿瘤的治疗。在临床前研究中,该候选药物已在卵巢癌和B细胞淋巴瘤模型中显示出抗肿瘤活性,并识别相关生物标记。此轮融资还将用于该公司使用ImmunoGram药物发现引擎拓宽其产品管线。
6.罕见皮肤病创新基因疗法被FDA拒批。Abeona公司基因疗法prademagene zamikeracel(pz-cel)用于治疗隐性营养不良性大疱性表皮松解症(RDEB)的上市申请收到FDA发出的完整回复函(CRL)。FDA要求Abeona必须在申请获得批准之前,“令人满意地解决”CMC问题,提供额外CMC信息。pz-cel是一款自体、COL7A1基因校正表皮片,利用逆转录病毒载体将产生胶原蛋白的功能性COL7A1基因送入患者自身的皮肤细胞。
医药热点
1.湘雅二医院将建设国家紧急医学救援基地。4月24日,国家卫健委官网发布了关于中南大学湘雅二医院国家紧急医学救援基地建设工程可行性研究报告的批复。国家卫健委原则同意中南大学湘雅二医院国家紧急医学救援基地建设工程可行性研究报告。据批复,该院主要建设内容为批量伤员救治、立体救治转运、应急指挥、培训演练、物资仓储等紧急医学救援相关业务用房及配套设施,建筑面积为81470平方米。其中,地上建筑面积55470平方米,地下建筑面积26000平方米。
2.苏大附一院日间手术中心启用。近日,苏州大学附属第一医院正式启用日间手术中心。日间手术设有普外科的疝气胆囊专科、眼科、介入科、骨科、妇产科、耳鼻喉科、甲乳外科、超声科等多个学科领域,眼科的斜视矫正术、介入科的大隐静脉曲张手术、血透中心的动静脉造瘘术、妇科的宫腔镜手术等均能在日间手术中心完成。患者在入院前完成术前检查、麻醉评估、手术预约,手术当天办理住院;术后经过严密观察,当天或24小时后患者即可出院回家。
3.今年北京市将新建10所社区医院。近日,北京市卫健委、市中医局联合发布《北京市“优质服务基层行”活动和社区医院建设三年行动方案》,北京市将着力改善基层医疗卫生机构中医药服务条件,今年将新建成10所社区医院。到2025年,社区卫生服务中心(乡镇卫生院)将全部设置中医馆、配备中医医师,能够规范开展10项以上中医药适宜技术。
评审动态
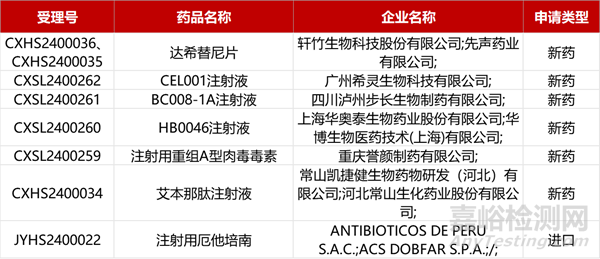
1. CDE新药受理情况(04月25日)
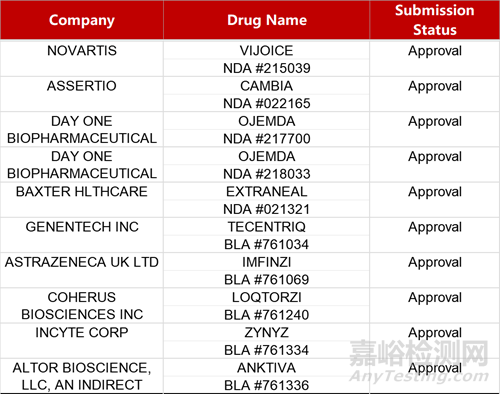
2. FDA新药获批情况(北美04月24日)

来源:药研发


