您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-09 08:22
近年来,环糊精及其衍生物用于降低ADC聚集,促进生物制品稳定的研究热度逐渐高涨,前两年的新冠网红药物瑞德西韦则让环糊精增溶这一“老”功能再次闯入大众视野。迄今为止,全球已有约130款上市药品处方中使用了环糊精及其衍生物,主要的功能正是增溶。剖析其处方组成可见,其应用技术难点为提高包合效率,避免产品稳定性差、生物利用度低下、制剂单位重量/体积过大等问题;酸、碱、盐、水溶性聚合物以及潜溶剂等辅料的使用,通过不同的机制提高包合效率,成为环糊精处方筛选和优化的重要策略。
一、环糊精在药物中的应用现状
环糊精是由D-(+)-吡喃葡萄糖单元通过1,4-糖苷键首尾相连形成的,具有疏水环状空腔的化合物,药物的整个分子或部分基团可以进入该环状空腔内形成“包合物”。这种包合物形成的驱动力主要由氢键、范德华力、主客体之间的疏水相互作用力等提供[1];环糊精表面亲水而空腔内疏水,更容易包合疏水性药物/基团,在已上市药品中常以增溶难溶性药物的目的。含有6、7、8个葡萄糖单元的环糊精分别为α-、β-和γ-环糊精(即α-CD、β-CD和γ-CD),通过对其不同基团的取代可获得不同性质的衍生物,常用的有羟丙基取代的β-CD(即HP-β-CD),磺丁基取代的β-CD(即SBE-β-CD)等。
环糊精的发现迄今已有超过100年的历史,其最早的授权专利出现在1953年 [2],早期受限于行业技术水平,其研发和应用成本高昂,直到1976年,使用了α-环糊精的前列腺素E1在日本上市,才标志着其作为药用辅料的产业化应用开始。
随着发酵、合成、纯化等技术的发展,环糊精及其衍生物的生产工艺得到优化、成本得以降低;同时,随着制剂、分析技术的发展,其包合理论的研究也逐渐深入,当前环糊精包合技术已逐渐经成为新药开发中提高难溶性药物溶解度和生物利用度的常用手段[3]。当前已有超过130款应用了该技术的制剂产品获批上市[4]。如表1所示。
表1:处方中采用环糊精的已上市产品
从表1可见,含有β-环糊精及其衍生物药品最多,约占所有产品的90%;由于α-环糊精的空腔体积较小,只能容纳低分子量的脂肪族侧链等化合物;γ-环糊精空腔体积大,适合大环和类固醇等分子;而β-环糊精空腔大小适中,适合芳香族、杂环、以及非极性羧基等常见化合物基团的包合,应用最广[2]。进一步观察已上市的采用了环糊精包合技术的产品处方组成,如表2所示。
表2 部分已上市的含环糊精药物处方组成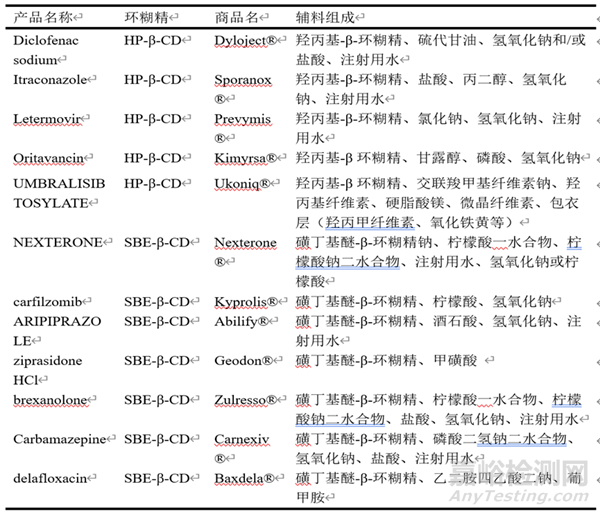
如表2所示,采用了环糊精及其衍生物的产品,其制剂处方组成具有一定的共性:除环糊精及其衍生物外,处方中通常还含有高分子材料、酸、碱、有机溶剂、缓冲盐等辅料中的一种和几种。口服制剂大多含有聚维酮、羟丙甲纤维素等高分子材料,该类辅料在口服制剂中常作为粘合剂使用,在环糊精制剂中还具有提高包合效率,维持包合物在胃肠道的过饱和状态等作用,最终达到促进吸收的效果;在环糊精包合物的注射剂中大多含有酸、碱、有机溶剂等辅料,该类辅料作为注射剂中pH调节剂等功能的同时,还有提高包合效率的作用。
二、提高包合效率的策略
包合效率(complexation efficiency,CE)能反应环糊精主分子和被包和药物客分子之间作用力的大小,比如,通常在溶液中的包合效率CE很少大于1.5,平均值约0.3,这表明平均每4个环糊精分子中只有一个与药物分子形成了包合物[5]。在采用环糊精包合技术时,通过处方优化和筛选增大其包和效率CE具有重要的意义:①能减少制剂中环糊精的用量,避免制剂单位重量(如单次服用片重、单次服用体积等)过高的问题;②能提高药物-环糊精摩尔比,进而提高生物利用度;③能促进包合物的稳定,减缓包合物溶液或包合物固体溶解后的解离与沉淀析出等问题。
药物与环糊精及其衍生物可以按不同的比例进行包合,但在水性溶液中,最常见包合类型为1:1的包合物[6]。此时,包合效率取决于药物本身的溶解度和包合稳定常数Kc[7],如图1所示。
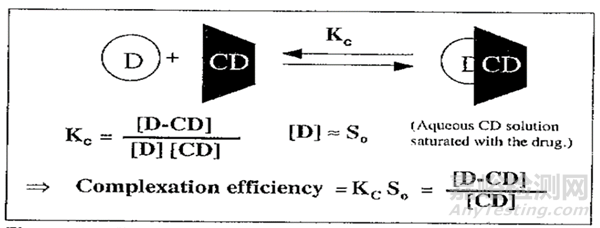
图1:包合效率的定义
(上图中,S0为药物本身溶解度;Kc为包合物表观稳定常数)
从图1可见,可以通过提高药物本身的溶解度S0和/或提高包合稳定常数Kc来提高包合效率,在已上市制剂中常用的提高包合效率的方法如表3所示[5] [8]。

表3:提高环糊精包合物包合效率的策略
1、增加药物溶解度S0
如上文所述,可以通过改善药物本身的溶解度S0来提高其包合效率,可以通过改变药物的晶型来改善其溶解度,包括将药物开发为无定形、共晶、其他易溶晶型等方式,例如,将伊曲康唑开发为无定形,可以增加其溶解度,进而提高其环糊精包合的包合效率。也可以使用有机溶剂(潜溶剂)的来提高药物溶解度S0,但需注意的是,有机溶剂也可能因为降低了体系极性等原因导致包合表观稳定常数Kc下降,当对S0的提高效果大于了其对Kc的降低效果时,才会表现为包合效率的提高。
酸、碱等pH调节剂和盐的作用效果与之较为相似,合适的酸/碱/盐可以促进药物的电离,从而提高溶解度S0;但是,药物电离程度的增强也降低了其本身的非极性,进而使药物与环糊精结合的驱动力受到影响,降低包合物稳定常数Kc,因此,只有在对S0提高的效果大于了对Kc降低的效果时,才能观察到包合效率提高的实验结果[5]。
以齐拉西酮的开发为例,在辉瑞的研究文献中透露了其齐拉西酮Geodon®为的盐型和处方筛选历程[9],该产品原料是游离碱(pKa为6.5),水中溶解度仅0.3µg/ml,而目标溶解度为20mg/mL。对原料的游离碱、盐酸盐、甲磺酸盐等不同盐型在水、HP-β-CD、SBE-β-CD中的溶解度进行了考察和对比,如表4所示。
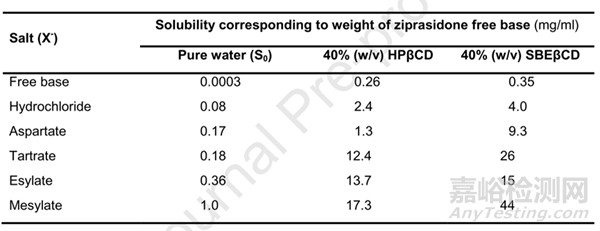
表4:齐拉西酮在纯水、HP-β-CD和SBE-β-CD水溶液中的溶解度[6]
溶解度考察结果显示,不同的环糊精衍生物对本品的增溶效果不同,游离碱在SBE-β-CD中的溶解度高于在HP-β-CE中的溶解度,该现象是由于药物本身解离后带正电,与带负电的SBE-β-CD间有电荷相互作用所致;不同盐型中,乙磺酸和甲磺酸盐溶解度最高;进一步对这不同盐在SBE-β-CD溶液中的相溶解度进行了考察,见图1.
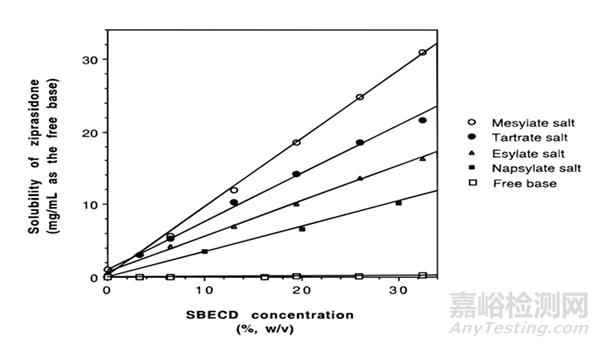
图1 不同盐型齐拉西酮在SBE-β-CD中的相溶解度图[9]
如上图所示,相溶解度图的结果显示甲磺酸的齐拉西酮的增溶效果最好,为优选盐型。最终上市的Geodon®注射液和口服液正是甲磺酸盐齐拉西酮的SBE-β-CD包合物。
此外,也有研究显示,在某些情况下,缓冲盐、有机溶剂都可能直接参与到复合物的形成,即形成药物-环糊精及其衍生物-盐或有机溶剂的三元包合物[10];而一些羟基酸,如柠檬酸、酒石酸等还可能参与到包合物间自组装络合成为纳米聚集体/胶束团的过程[11]。
2、提高包合物表观稳定常数K
在溶液状态下的包合物,包括采用了环糊精及其衍生物的液体制剂,或其固体制剂在胃肠道内溶解后的状态下,包合物还可以形成非包合的聚集体或胶束样结构,通常是自组装的20~100nm的结构,如图2所示[12][5]。
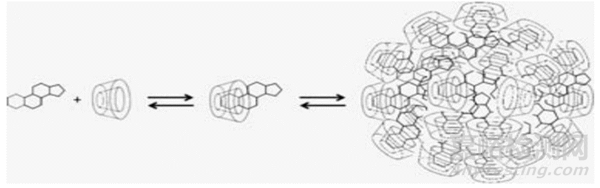
图2:环糊精及其衍生物包合药物后自组装成聚集体示意图[5]
这种聚集体的形成,可以通过非包合的作用增溶难溶性药物,也能使包合物的表观稳定常数Kc更高,从而提高包合效率。一些盐、有机酸/碱、和水溶性聚合物分子等不仅能促进包合物的自组装聚集,还能促进药物-环糊精-小分子辅料的三元复合物形成,这些作用均能提高包合表观稳定常数KC,提高包合效率CE[5][12][13]。
通常认为,加入少量的水溶性高分子材料(一般0.1%~1%)可以提高包合效率。例如,在非洛地平的β-CD包合物和HP-β-CD包合物中,加入了HPMC、PVP和PEG6000等高分子材料后,包合稳定常数KC显著增加,包合效率CE也明显提高,如表5所示。
表5 水溶性聚合物对非洛地平包合稳定常数和包合效率的提高[14]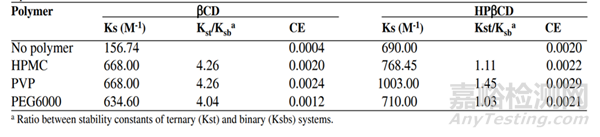
如上表所示,在加入水溶性聚合物后,β-CD和HP-β-CD对非洛地平的表观包合常数Kc及包合效率CE均有提高。有文献综述了超过30种难溶性药物的包合研究,结果显示,与环糊精及其衍生物-药物的二元体系相比,加入少量(0.1~0.25%)水溶性聚合物后的三元体系中,难溶性药物的溶解度可以再提高约70%[13]。此外,
3、同时提高药物溶解度S0和包合物表观稳定常数Kc
更多时候,需要综合应用多种辅料同时提高药物溶解度和包合物表观稳定常数,一些酸、碱、盐、金属离子等物质在调节药物本身电离程度,提高其溶解度S0的同时,还可能通过参与形成三元复合物、促进包合物形成纳米聚集体等方式提高表观稳定常数Kc;以上述非洛地平的包合物开发为例。水溶性聚合物除了提高非洛地平包合物表观稳定常数K1:1的效果外,其本身还具有提高该药物溶解度的效果,如图3所示。
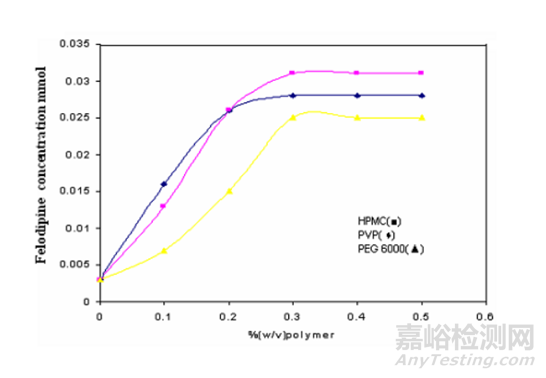
图3 不同聚合物对非洛地的增溶效果
如图3和表5所示,水溶性聚合物不仅可以通过形成三元包合体系、促进包合物聚集体形成等方式,提高包合物表观稳定常数Kc,还同时具有一定的提高非洛地平溶解度S0的效果,最终对包和效率CE的提高较为明显。
再如,羟基丁二酸在增加益康唑本身溶解度的同时,通过氢键和盐桥等作用,促进了益康唑-α-CD包合物形成纳米聚集体,进一步促进了益康唑的溶解[15]。
三、小结
从环糊精问世以来,其应用一直是研究的热点之一,但从当前全球已上市的药品来看,在使用了环糊精在及其衍生物的药品中,该辅料应用的主要目的仍然以提高难溶性药物溶解度为主。理论上讲,环糊精独特的结构,使其在解决新药开发中候选分子难溶性等问题上具有极大的应用价值,当前阻碍其应用的主要障碍即是包合效率不够高,导致制剂单位重量/体积过大,生物利用度不够高,液体状态下不稳定等。通过酸、碱、盐、水溶性聚合物以及潜溶剂等常规辅料的巧妙使用,从不同的机制出发提高包合效率,成为环糊精及其衍生物制剂中处方筛选优化的重要策略。
参考文献:
1. Salústio PJ, Feio G, Figueirinhas JL, Pinto JF, Cabral Marques HM (2009) The influence of the preparation methods on the inclusion of model drugs in a β-cyclodextrin cavity. Eur J Pharm Biopharm 71:377–386
2. Jambhekar S.S., Breen P. Cyclodextrins in Pharmaceutical Formulations I: Structure and Physicochemical Properties, Formation of Complexes, and Types of Complex. Drug Discov. Today. 2016;21:356–362.
3. Zane P, Gieschen H, Kersten E, Mathias N, Ollier C, Johansson P, Van den Bergh A, Van Hemelryck S, Reichel A, Rotgeri A, Schäfer K, Müllertz A, Langguth P. In vivo Models and Decision Trees for Formulation Development in Early Drug Development: A Review of Current Practices and Recommendations for Biopharmaceutical Development. Eur J Pharm Biopharm. 2019 Jun 21. pii: S0939-6411(17)31379-6.
4. Puskás I., Szente L., Szőcs L., Fenyvesi É. Recent List of Cyclodextrin-Containing Drug Products. Period. Polytech. Chem. Eng. 2023;67:11–17.
5. Loftsson, T.; Brewster Marcus, E. Cyclodextrins as functional excipients: Methods to enhance complexation efficiency. J. Pharm. Sci. 2012, 101, 3019–3032
6. Loftsson, T. Cyclodextrins in Parenteral Formulations. J. Pharm. Sci. 2021, 110, 654–664.
7. Loftsson, T., Masson, M., Sigurj ´ onsd ´ ottir, J.F., 1999. Methods to ´ enhance the complexation efficiency of cyclodextrins. S.T.P. Pharma Sci. 9, 237–242
8. Phennapha Saokham, Chutimon Muankaew, Phatsawee Jansook, et al. Solubility of Cyclodextrins and Drug/Cyclodextrin Complexes. Molecules. 2018, Vol.23, No.5, p.1161.
9. Yesook Kim, Darlene A. Oksanen, Jr.Walter Massefski, James F. Blake, Erin M. Duffy, Boris Chrunyk. Inclusion complexation of ziprasidone mesylate with β-cyclodextrin sulfobutyl ether. Journal of Pharmaceutical Sciences 1998, 87 (12) , 1560-1567.
10.Mura, P., Maestrelli, F., Cirri, M., 2003. Ternary systems of naproxen with hydroxypropyl--cyclodextrin and aminoacids. Int. J. Pharm. 260, 293–302.
11. Redenti, E., Szente, L., Szejtli, J., 2000. Drug/cyclodextrin/hydroxy acid multicom-ponent systems. Properties and pharmaceutical applications. J. Pharm. Sci. 89,1–8.
12. Martin Messner, Sergey V. Kurkov, Phatsawee Jansook, Thorsteinn Loftsson. Self-assembled cyclodextrin aggregates and nanoparticles. International Journal of Pharmaceutics 2010, 387 (1-2) , 199-208.
13. Loftsson, T., Másson, M., 2004. The effects of water-soluble polymers on cyclodex-
trins and cyclodextrin solubilization of drugs. J. Drug Del. Sci. Tech. 14, 35–43.
14. Kuchekar BS, Narkhede M. The effect of water soluble polymers on felodipine aqueous solubility and complexing abilities with natural and modified β-cyclodextrin. Indian J Pharm Sci 2007;2:197-202.
15.Mura P, Franchi G, Faucci MT, Manderioli A, Bramanti G. 1999. Improvement of econazole solubility in multicomponent systems with cyclodextrins and acids. In: Proceedings of the 9th international symposium on cyclodextrins. Dordrecht: Kluwer Academic Publishers. p 375–378.

来源:药事纵横


