您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-22 08:11
前言
在开展临床前整体动物实验时,如何合理地设计动物实验从而科学有效地阐释实验结果是至关重要的。笔者将从自身的一些实践经验与感受并结合相关的指导原则角度出发进行总结与讨论。希望在此能对大家起到抛砖引玉的作用。由于本文内容受限于笔者的经验和能力,如果有什么不妥的地方欢迎各位前辈同行们批评指正,也欢迎大家踊跃留言与我交流讨论。
动物种属的选择
在刚开始设计动物实验时,可能很多人都会有这样的疑问:在进行临床前的研究过程中我们究竟该如何选择实验动物的种属呢?鉴于此,我主要从常见动物类型、毒理学评估、药物非临床药代动力学(PK)、毒代动力学(TK)和药理学这几个方面逐一进行说明。
(一)常见动物类型
首先,我们需要了解几个基本概念,如表1所示。
表1 实验动物常见类别
接下来要搞清楚常见的动物品系有那些,比如有常规大鼠、常规小鼠、杂交系小鼠、免疫缺陷鼠、疾病模型鼠、地鼠、豚鼠、兔、狗、猴等,详细内容如表2所示。
表2 常见实验动物品系汇总表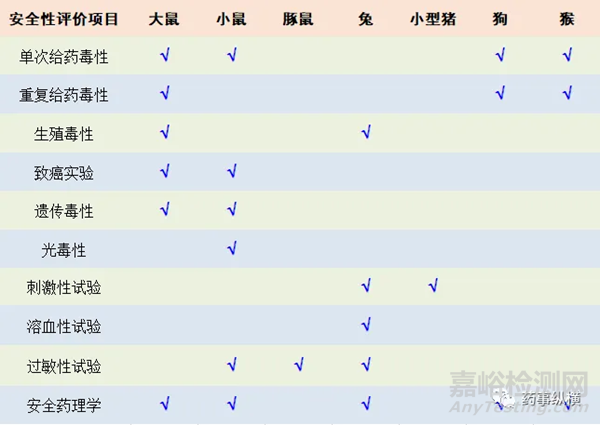
(二)毒理学评估
对于临床前候选药物的安全性评估,主要包括啮齿类和非啮齿类动物在服用不同剂量药物后的毒理学评估。这个阶段的目的是确定系统和局部暴露,探索剂量与暴露的相关性。通过单个和多个递增剂量的研究,可以评估药物在体内的蓄积、诱导和毒性。
不同品系的小鼠(C57BL、BALB/c、KM和ICR等)、大鼠(如SD、Wistar和Fischer等)都可以在该研究中使用。Beagle犬通常用于非啮齿类实验。非人类灵长类动物,如猕猴、恒河猴或狨猴也会被用到。其中,非人类灵长类动物常用来评估大分子药物的免疫原性,当狗的药物代谢特征明显不同于人类时也会使用它们。如药物代谢酶如乙醛氧化酶,在物种间可能有明显的差异,为了确保所有代谢产物安全性的良好覆盖,我们可以选择与人类代谢特征相近的动物。因为不同物种的代谢特征不同时,代谢介导的毒性可导致一个物种相对于其他物种对药物更敏感。
即便在进入临床后,临床前动物毒理研究还会继续。主要是毒理动物进行更长周期的安全性评价。药物单次和重复给药毒性试验指导原则均有提及种属(啮齿和非啮齿类)、性别(雌雄各半)、年龄、数量和体重(同性体重控制在20%以内)等要求。指出理想的动物应具有以下特点:对受试物的代谢与人体相近;对受试物敏感;已有大量历史对照数据,来源、品系、遗传背景清楚。在重复给药毒性试验前应采用合适的试验方法对实验动物种属或品系进行选择。常见的毒理评价动物的选择,如表3所示。
表3 常见毒理评价动物种属选择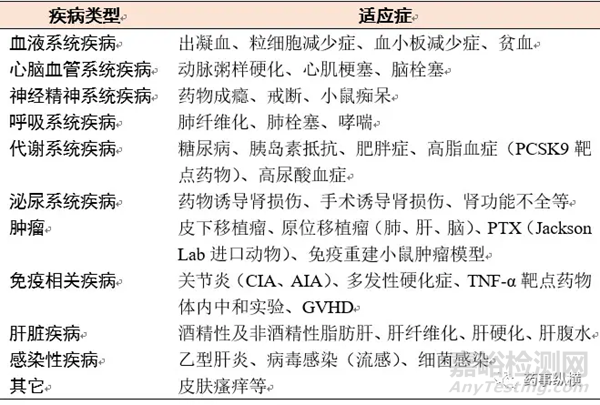
(二)药物非临床药代动力学(PK)研究
根据药物非临床药代动力学研究技术指导原则,该原则中对试验动物也有相应的要求。PK试验中一般采用成年和健康的动物。常用动物有小鼠、大鼠、兔、豚鼠、犬、小型猪和猴等。动物选择的一般原则如下:
(1)首选动物:在考虑与人体药代动力学性质相关性的前提下,尽可能选择与毒理学和药效学研究相同的动物。
(2)尽量在动物清醒状态下进行试验,最好从同一动物多次采样获取药代动力学参数。
(3)创新性药物应选用两种或两种以上的动物,其中一种为啮齿类动物;另一种为非啮齿类动物(如犬、小型猪或猴等)。其他药物,可选用一种动物,建议首选非啮齿类动物。
(4)在动物选择上,建议采用体外模型比较动物与人代谢的种属差异性,包括代谢反应类型的差异和代谢产物种类及量的差异。通过比较,选取与人代谢性质相近的动物进行非临床药代评价;同时尽可能明确药物代谢的研究对象(如:原形药物、原形药物与代谢产物、或几个代谢产物同时作为药代动力学研究观察的对象)。
(5)经口给药不宜选用兔等食草类动物。
PK试验中动物数量一般建议每组不少于5只动物,以血药浓度-时间曲线的每个采样点一般不少于5个数据。同时,建议受试动物采用雌雄各半。对于单一性别用药,可选择与临床用药一致的性别。
此外值得注意的是:对于口服给药试验一般在给药前应禁食12小时以上,以排除食物对药物吸收的影响。另外在试验中应注意根据具体情况统一给药后禁食时间,以避免由此带来的数据波动及食物的影响。
1、药物吸收试验研究
如其他血管外给药的药物及某些改变剂型的药物,应根据立题目的,提供绝对生物利用度或相对生物利用度。建议采用非啮齿类动物(如:犬或猴等)自身交叉试验设计,用同一受试动物比较生物利用度。
2、组织分布试验研究
一般选用大鼠或小鼠进行组织分布试验,但必要时也可在非啮齿类动物(如犬)中进行。参考血药浓度-时间曲线的变化趋势,选择至少3个时间点分别代表吸收相、平衡相和消除相的药物分布。若某组织的药物或代谢产物浓度较高,应增加观测点,进一步研究该组织中药物消除的情况。每个时间点,一般应有6个动物(雌雄各半)的数据。
3、药物排泄试验研究
建议同时提供啮齿类和非啮齿类动物的排泄数据,啮齿类(大鼠、小鼠等)每个性别3只动物,非啮齿类(如犬)每个性别2~3只动物。根据药物特性,也可选择单一性别动物,但需说明。每个样品采集时间段至少保证有5只动物的试验数据。
4、药物与血浆蛋白结合率试验研究
建议根据药理毒理研究所采用的动物种属,进行动物与人血浆蛋白结合率比较试验,以预测和解释动物与人在药效和毒性反应方面的相关性。
5、生物转化试验研究
应尽早考察药效和毒性试验所用的实验动物与人体代谢的差异(体现在量或质上)。我们可以进行药物体外代谢试验,比如动物和人肝组织匀浆、原代肝细胞、肝S9、肝微粒体等试验预测动物与人体体内代谢有无差异。
临床前药代动力学研究中动物选择的恰当与否是项目研究价值大小的关键。应尽量选择适宜的动物来进行研究,如口服给药的药物不宜选择食草类动物或与人胃肠道情况差异较大的动物,以免由于吸收的差异造成试验结果不能充分提示临床。对于创新性的药物,可利用体外药代动力学手段预先对动物种属进行筛选,以选择药物动力学特点与人体最接近的动物,提高试验结果的临床预测价值。由此也可为毒性试验选择合适的动物种属提供依据,并对毒性试验与人体的相关性做出判断。
(三)毒代动力学(TK)研究
毒代动力学研究所用动物数量应保证能获得足够的毒代动力学数据。由于毒性试验中通常采用两种性别动物,暴露测定也应包括两种性别的动物,如果选择单性别动物时应说明理由。毒性试验中应采用合适的动物数和剂量组数对全身暴露量进行估计。一般情况下,建议受试物的每个剂量组至少每性别4只动物。若有证据提示受试物在性别间有明显毒性差异,试验中可选择敏感性别的动物。
(四)药理学或药效学研究
对于基因治疗药物、抗体药物、细胞因子和蛋白质类药物及化学药物在体内有效性的评价,涉及到的动物主要为正常动物或病理模型动物。其中,选择模型动物的依据也是基于受试药物在临床上的适应症,同时实验模型必须能反映药理作用的本质,如果有些新药确实无法满足上述动物模型要求,应该充分说明改用其它模型的理由。常见动物模型如表4所示。
表4 常见的模型动物类型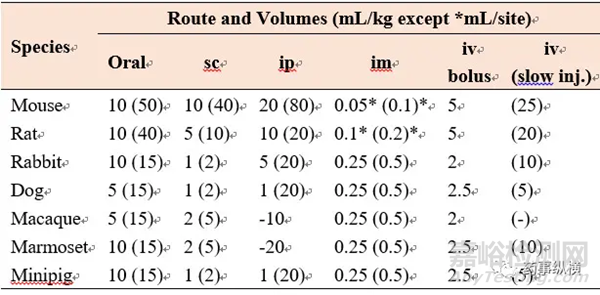
总之,不同动物模型对药效评选的不同结果给新药评价工作带来不小的困难。而对于仿制药品的药效评价更多是基于原研或参比制剂质量标准或/并以原研作为对照,药效评价相对较易。动物模型应根据人体发病机制来建立,一定要在体内和体外、动物和人体的各方面效应之间不断验证。一个药效评价往往需要几个模型,且在评价工作的不同阶段反复进行,切忌单凭个别动物指标就做出是与否的结论。
动物给药方式的选择
动物给药方式有很多,我们一般选择与临床给药方式一致,有些情况下可以选择与临床给药接近的方式。根据EFPIA(欧洲联盟欧洲制药工业协会联合会)和ECVAM(欧洲替代方法验证中心)在2001年联合发布的关于动物给药和最大体积的指导原则,其为我们提供了动物实验设计依据以及最大限度保护动物的权益。实验室常用实验动物给药途径及给药体积,如下表5所示。
表5 实验动物常规给药途径下推荐的给药体积
注:a.(-)无数据
b. 肌肉内注射时每天不能超过2次。
c. 皮下注射时每天限制在2~3次。
d. 皮下注射时,不包括弗氏佐剂的使用。
e. 每一栏内有两组数字,左边的数字代表的是指导原则中适用于单次或多次给药时的给药体积。右边括号内的数字代表的是可能的最大给药体积。如果超过这个给药体积那么将会导致动物权益与实验的科学性之间产生矛盾。在某些情况下,给药体积要与药典的要求相适应。
值得注意的是:我们在实际给药的过程中应该充分保证给药剂量的准确性,应对给药前的受试药物进行剂量确证。常用HPLC或LC/MS等方法进行定量,计算出实际给药前的药物剂量。同时,需注意取样方式,受试药物在助溶/助悬剂中的状态(如溶液、混悬液等)以及药物制剂的类型(如口服片剂/溶液、冻干粉剂等)而定,因为这些特性直接决定了剂量配制和给药过程的准确性。提前充分的了解,可有助于减少动物给药操作过程中带来的人为误差。
采样方式的选择
(一)抗凝剂的选择
常见的抗凝剂有乙二胺四乙酸(EDTA)是一种可以和钠、二钾或者三钾等很多种不同的拮抗离子来组合制备抗凝剂的人工合成小分子。EDTA通过与任何形式的钙络合来防止血液凝结,进而通过抑制凝血反应来抑制纤维蛋白的产生。
肝素(heparin)钠或锂是最常用的肝素盐。肝素可以抑制凝血酶原转化为凝血酶,抑制纤维蛋白原纤维化,另一方面肝素通过和抗凝血酶III结合并加速反应来改变其分子结构,引起抗凝血的作用,同时增强对凝血因子Xa、IX和凝血反应的抑制,一次防止纤维蛋白原形成纤维蛋白。其余的抗凝剂如草酸盐、柠檬酸盐、氟化物等均有抗凝血的作用。抗凝剂类型的选择是需要结合自身实验而定。比如在检测血液粘度/抗凝血时间时,在选择抗凝剂上需慎重考虑,以免造成对实验结果产生影响。
(二)生物样品的收集
生物样本收集的方式需要根据试验目的而定。
1、全血、血浆和血清样品的收集
全血、血浆和血清制备量约等于1:0.5:0.2,即1mL全血可以制备得到约0.5 mL血浆或0.2mL的血清。常规血浆在1500~2500 g条件下离心10~15min即可。离心后取出样品转移至新的样品管中,分装成更小体积(如果有需要复测)。一般来说,如果可以使用不同抗凝剂采血管,应首选可以减少发生任何潜在问题的抗凝管,依次为柠檬酸、EDTA、肝素、氟化物、血清管。减少凝血块产生的一个技巧是快速将样品冷冻和储存到-80 °C。如果样品是冷冻在-20 °C,然后经过冷冻-解冻这个过程,就会增加凝血的可能性。血浆样品最好是全血采集后立即离心,可以减少溶血现象的发生。如果分析物不稳定,用血浆较血清为佳因为我们可以快速得到血浆样品,立即进行冷冻保存。
血液总量取决于物种、性别、年龄、健康及营养状况。对于同一种物种,较大动物单位体重的总血量比较小的动物要少,老龄和肥胖动物单位体重含总血量少于年轻和正常体重的动物。一般情况下,总循环血量为55~77mL/kg体重,安全性评价研究中常用的不同种属动物的循环血量以及在毒理学研究中极为常用的狨猴和小型猪的数据如表6所示。
表6 实验动物循环血量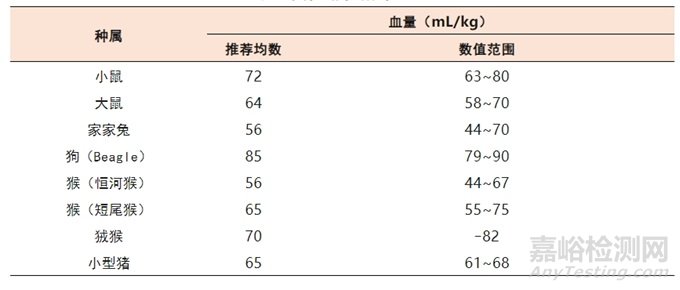
关于动物采血后健康状况的关键性指标如心率、呼吸、激素水平及行为学改变的文献数据不多,但是通过血液学参数可以间接判断,如血前后的红细胞计数(RBC),血红蛋白浓度(HB),红细胞压积(HCT),红细胞平均容积(MCV)及红细胞分布范围(RDW)。表7推荐的多次取样后的恢复时间,是所有大鼠采血后血量均恢复至采血前的正常水平加减10%的时间,而多次少量取样则不会产生这样的急性反应。
表7 取血体积的限制及恢复周期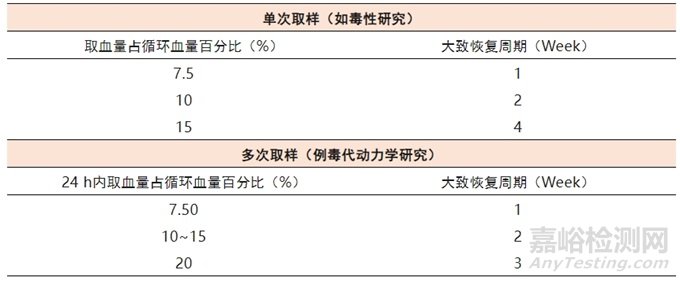
注:a.毒理实验中血液学指标的变化非常重要,多次采血会对这些指标发生影响,应特别注意多次采血后的恢复时间
b. 药动学研究时大量采血(如20%)会引起血液动力学变化,或许会对半衰期等参数产生影响。如果在24h内处死动物,可以评价消除半衰期。暂不认同补充血量的方法。
那么,具体我们在实际操作中如何控制采血量呢?在药物非临床药代动力学研究技术指导原则中指出:采血途径和整个试验周期的采血总量不影响动物的正常生理功能和血液动力学,一般不超过动物总血量的15~20%。例如,每只大鼠24 h内采血总量不宜超过2 mL。在采血方式上,同时也要兼顾动物福利。又在EFPIA和ECVAM联合发布的关于动物采血体积指导原则中指出:单次采血(如常规毒理研究)不超过动物总血量的15%时,可在3~4周后重复采血。长期多次采血每24 h不应超过总血量的1%。采集次数和(或)采血量过多则引起贫血,并列出了较为方便的参考数据,是对动物正常生理没有显著干扰的最大采血体积(表8)。
表8 给出体重的各种不同种属的实验动物的总血量及推荐的最大采血量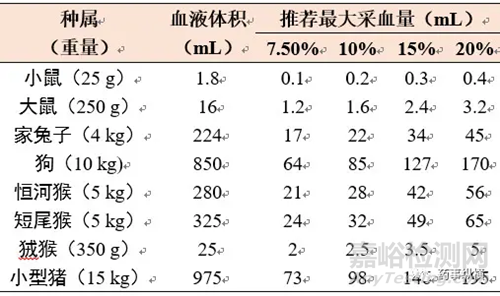
2、其它样品的收集
进行组织分布研究则需要通常需要收集动物的心、肝、脾、肺、肾、胃肠道、生殖腺、脑、体脂、骨骼肌等组织,以了解药物在体内的主要分布组织和器官。当组织或器官从机体移除以后,需要立即浸入含盐的溶液中,以洗去组织表面和血管中的残渣和血液。然后,组织器官中的血液不可能完全清洗掉,残留是不可避免的。随后,组织可被匀浆处理或冻存。其中,机械匀浆是常用的匀浆方式,此外若分析物稳定性允许,酶解法和酸解法也是可以采用的。
尿液样品的采集面临的挑战也较血液样品多。首先,我们需要考察待测物在尿液中的稳定性问题;其次,由于尿液中蛋白质和脂类含量极少,分析物对容器表面的非特异性结合十分常见。粪便样品通常只在必要情况下才需要采集,如当胆汁排泄是某种药物的主要排泄途径,或者当药物主要被运输到肠道,以致粪便中的药物浓度能反映出药物释放的程度。
(三)采血方式的选择
在毒代动力学研究中,大鼠采血可采用:尾静脉、趾脉管系、全麻下心脏穿刺、全麻下颈外静脉和颈总动脉插管。兔和豚鼠可用耳缘静脉、颈静脉或隐静脉。较大动物的采血可从浅表静脉进行(隐静脉、头静脉、颈静脉)。EFPIA和ECVAM联合发布的指导原则中列出了关于动物推荐采血部位,如表9所示。
表9 各种不同采血方式的血样的利弊的概述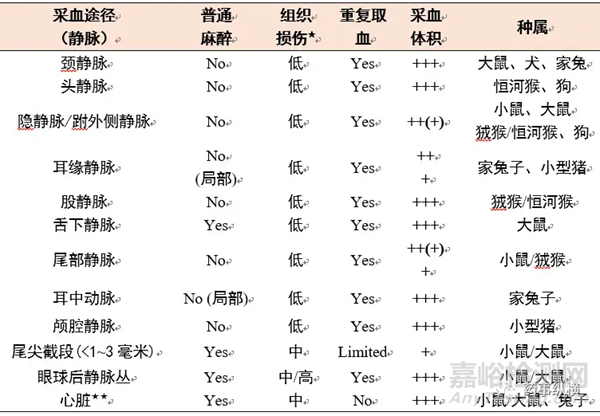
注:a. «组织损伤发生的可能性是基于其发生的几率和并发症的严重程度,如炎症反应,组织学损伤;
b. *,**只适用于在全麻时采用的致死性的操作(只适用在全麻时临终阶段操作)。
对大、小鼠如采血量不超过0.1mL 时,常用尾尖采血法。眼窦后静脉丛穿刺通常适用于无尾动物如仓鼠。当尾静脉不能满足较大的采血量时,大、小鼠也可用此技术。一般要求在麻醉下操作。只有当没有别的方法的特殊情况下,2周后才能考虑在已恢复正常的动物的眼眶静脉丛再次取血。这项技术应由训练良好的工作人员来操作,而且只能用动物的一只眼睛。不赞成在无麻醉条件下,用眼球摘除法取血。
但值得一提的是眼窦后静脉丛采血法(俗称的眼眶采血),之前的研究经常会使用眼窦后静脉丛采血的方法,但近来研究表明它会产生一些不良反应。由于这些不良反应及其可能产生的严重后果的原因,该方法已引起了人们的担忧。近来已形成的其他一些即可满足科研需要,又可保证动物福利的采血方法。然而,有的专业技术人士认为,同那些新采血方法相比,眼球后静脉丛采血法的利弊仍是值得回顾和评论的。比如,眼眶采血很难完全避免不同时间点之样品的交叉污染问题,特别是在采血点比较密集的时候。
我们需要注意的是穿刺采血的频率,即是进行最少次数的穿刺。对于插管法的手术操作必须要保证在无菌条件下进行,以避免交叉感染的发生;需定期疏通导管,避免管内凝血而发生堵塞;要避免大鼠咬到套管,应对置管动物进行隔离饲养和适当固定。
最后补充说明一下,有些采血方式需要麻醉,需要注意的是麻醉可以使得进行采取血样较为容易,但其同时增加了已采血点处发生出血的几率,所以应格外关注这一点以确保止血成功。此外,只有在其他的采血途径不能使用时方可考虑动物的眼窦后静脉丛采血;心脏采血只有在动物全麻的临终阶段方可使用。
时间的选择
(一)采样点或采血时间的选择
药代动力学研究中采样时间点的设计应兼顾药物的吸收相、平衡相(峰浓度附近)和消除相。对于吸收快的血管外给药药物,应尽量避免第一个点是峰浓度(Cmax);在Cmax附近需要3个时间点,尽可能保证Cmax的真实性。整个采样时间应持续到3~5个半衰期,或持续到血药浓度为Cmax的1/10~1/20。为保证最佳采样点,建议在正式试验前进行预试验,然后根据预试验的结果,审核并修正原设计的采样点。
对于组织分布试验的采样点的选择,一般是参考血药浓度-时间曲线的变化趋势,选择至少3个时间点分别代表吸收相、平衡相和消除相的药物分布。若某组织的药物或代谢产物浓度较高,应增加观测点,进一步研究该组织中药物消除的情况。此外,尿液样本是在一定时间间隔内进行采集的。典型的采样时间为服药前( -6 ~ 0 h ),以及服药后 0 ~ 6 h 、 6 ~ 12 h、12 ~ 24 h 和24 ~ 48 h。
(二)给药时间间隔的选择
多次给药试验时,一般可选用一个剂量(有效剂量)。根据单次给药药代动力学试验结果求得的消除半衰期,并参考药效学数据,确定药物剂量、给药间隔和连续给药的天(次)数。
最后,需要引起重视的是(1)在样品采集和处理时还应考虑样品采集的时间及从全血样品制备血浆样品所需的时间。例如,如果血浆样品制备时间为15min,而下一个采血点是5 min以后,那么是否能够在有限时间里完成所有血浆样品的制备?(2)在样品采集时间点比较密集(如需连续采集0,5 min, 15 min, 30 min, 1 h点),样品组数又较多时,需要全面考虑时间安排问题,确保有能力遵守采样时间。
生物样品的储存和运输
(一)样品采集临时存放条件
如果没有相关样品稳定性数据,我们建议将化合物全部视为在全血里面不稳定。采集的样品应该立即放在冰浴上,且随后所有操作也保证在冰浴上操作。如康宁公司的热传导模块CoolRack系列,将该模块放置于湿冰或干冰等条件下可以快速降温并保证每个样品孔在恒定的低温下,每个放置样品的孔温波动范围在±0.1 °C。此外,湿冰条件下存放时,还需密切关注冰的融化速度,及时补充湿冰。最后,样品管应有用不褪色笔标注的样品标签,且样品标签在浸湿情况下不会脱落或变得模糊不清。尽量避免手写标签,实验室用的标签打印机可以满足需求。
(二)生物样品储存容器
在选择样品储存容器是应该进行全面的考虑,包括他们可能会遇到的问题。样品管盖是否可以承受-80或-196 °C低温?样品管高速离心是否会变形?
聚丙烯(PP)和聚乙烯(PE)是在采血和储存全血、血浆及血清过程中最常用的材料,他们与分析物之间的相互作用也最少。聚苯乙烯(PS)材料的塑料管经常用于临床试验的尿样采集,但是在使用时须小心,因为PP和PE材料的样品采集管相比,PS材料对样品更容易产生非特异性吸附。
(三)生物样品长期储存条件
FDA和EMA在关于生物分析方法验证的指导文件里都频繁提到了对样品采集及储存过程中稳定性的评估。即QC样品应当与测试样品储存在相同的温度条件下,并且储存时间至少相同。对于小分子药物,如已验证样品在-70 °C和-20°C的稳定性,那么就没必要对这两个温度之间的其他温度的稳定性进行评估。但是对于大分子(如多肽和蛋白质),样品储存的各个温度条件的稳定性都需要进行评估。一般情况下,我们都默认为小分子样品放置在-80 °C冰箱,可以储存至少3个月以上。
(四)生物样品的运输
应将样品放置于干冰里运输,最好全程实时动态监控样品运输途中的温度。也就是说样品在运输前需加入足量的干冰,以保证干冰的持续作用时间常于样品的运输时间。同时,样品最好能在周一寄出,这样保证样品可以在周末前送到目的地。
小结
本文未涉及动物实验设计中关于剂量选择和实验分组等问题,主要原因是笔者考虑到该部分设计需实际问题实际分析,考虑的方面也较多,如需要综合考虑受试药物的PK(TK)或/和PD、半数有效量(ED50)、半数致死量(LD50)、最大耐受量(MTD)和最大给药量(MFD)等参数,从而较为合理地调整给药的剂量。这些都可以单独拿出来作为一个主题进行讨论,故在本文中未提及。
总之,选择动物时应尽可能选用与人在生物学上接近,在机体解剖、生理功能相类似的动物,应选用敏感动物品系,选用靶器官高效应实验动物。同时,注意动物的年龄、性别、遗传、营养、环境等因素。对于不同种属动物的采血方式和采血量,在最大程度保护动物权益的前提下,基于相应的基本原则,我们可以自行选择与调整。对于生物样品的收集、储存和运输操作中,应最大程度保护样品的真实状态。
最后,特别需要强调的是,我们在涉及动物的所有试验操作中,人员应具备全面的理论知识储备、动手操作能力和严格的SOP文件体系是保证动物实验结果真实性和可重复性的关键,同时也是保障实验动物健康和权益的根本所在。
参考资料
(一) 书籍
(1)李文魁等,液相色谱-液质(LC-MS)生物分析手册:最佳实践、实验方案及相关法规[M].科学出版社,2017
(2)章金涛. 医学实验动物学[M]. 郑州大学出版社, 2014.
(二) 指导原则
(3)CDE, 药物重复给药毒性研究技术指导原则,2014.
(4)CDE, 药物单次给药毒性研究技术指导原则,2014.
(5) CDE, 药物刺激性、过敏性和溶血性研究技术指导原则, 2014.
(6) CDE, 药物安全药理学研究技术指导原则, 2014.
(7)CDE, 药物遗传毒性研究技术指导原则,2018.
(8)ICH, S5. 药品的生殖毒性和雄性生育力毒性检测,2000.
(9)ICH, S1B. 药物致癌试验,1997.
(10)CDE, 药物非临床药代动力学研究技术指导原则, 2014.
(11)CDE, 药物毒代动力学研究技术指导原则,2014.
(三)文献
(12)Diehl K, Hull R, Morton D, et al. Agood practice guide to the administration of substances and removal of blood,including routes and volumes[J]. Journal of Applied Toxicology, 2001, 21(1):15.

来源:Internet


