您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2024-09-08 11:07
摘 要 / Abstract
世界卫生组织资格预认证(WHO PQ)是WHO 向联合国儿童基金会提供的一项服务,用于评估候选疫苗的可接受性,为基金会购买符合一定标准的疫苗提供建议。目前已经涵盖4 类产品,即疫苗、药品、体外诊断产品及病媒控制产品,其中体外诊断产品资格预认证(PQDx)是针对体外诊断产品的审评机制,为采购合适的诊断试剂提供科学依据。本文重点介绍了WHO PQDx 的历史与发展现状,并以此探讨我国体外诊断制造商申请WHO PQDx 的机遇与挑战。
The World Health Organization Prequalification (WHO PQ) program, a service provided by the WHO to the United Nations Children's Fund (UNICEF), assesses the acceptability of candidate vaccines and provides recommendations for purchasing vaccines that meet specific criteria. This program currently encompasses four categories of products: vaccines, medicines, in vitro diagnostics, and vector control products. The prequalification of in vitro diagnostic product (PQDx) is a review mechanism specific to in vitro diagnostic products, providing a scientific foundation for the procurement of suitable diagnostic reagents. This article focuses on the history and current status of WHO PQDx, and discusses the opportunities and challenges faced by China’s in vitro diagnostic manufacturers in applying for WHO PQDx.
关 键 词 / Key words
世界卫生组织;资格预认证;体外诊断产品;历史;发展现状
World Health Organization; prequalification; in vitro diagnostics; history; development status
1、世界卫生组织体外诊断产品资格预认证的发展历程
1.1 PQDx的启动恰逢其时
世界卫生组织(World Health Organization,WHO)资格预认证(prequalification,PQ),通常用于相关产品正式采购前将公开招标的潜在供应商控制在一定范围和数量内。WHOPQ 诞生之初, 是WHO向联合国儿童基金会提供的一项服务, 用于评估候选疫苗的可接受性, 为联合国儿童基金会购买符合一定标准的疫苗提供建议[1]。现在WHO PQ 已经覆盖4 类产品,即疫苗、药品、体外诊断及病媒控制产品,其中体外诊断(in vitro diagnostics,IVD)产品相关项目最早可追溯至1988 年。WHO 启动了 “ 检测试剂盒性能评估计划(test kit evaluation program)”,初衷是应对在非洲地区人群中使用的人类免疫缺陷病毒(human immunodeficiency virus,HIV)诊断试剂在性能上与适用于欧洲和美国等国家和地区人群的方法存在差异的问题。该计划系统评估了HIV 诊断试剂在不同地区和人群中的性能,为非洲地区采购合适的HIV 诊断试剂提供科学依据。2010 年,WHO 正式推出了更为全面、严谨的体外诊断资格预认证(prequalification of in vitro diagnostics,PQDx)项目,取代了此前的“检测试剂盒性能评估计划”[2],该举措标志着一个更为完善的IVD 产品审评机制的建立。
PQDx 的启动正值全球HIV传播趋势有效控制、抗逆转录病毒普及率大幅提高之际。全球艾滋病防控面临着在资源有限地区迫切需要更经济、简便的诊断方法的新挑战。为强调应对该挑战的重要性,2012 年WHO 和国际药品采购机制(UNITAID)宣布未来10 年为“诊断十年”。在这种背景下,WHO PQ 发挥了重要作用,其建立的PQDx 审评机制采用了类似于严格监管机构的程序,确保包括HIV 诊断产品在内的重点IVD 产品符合国际统一的质量、安全和有效性标准,从而使得国际资助机构能够采购和分发有质量保障的HIV 诊断产品。据统计数据显示,2012 年主要利益相关方采购的5870 万份检测产品中,带有“WHO PQ”标签的HIV 快检测产品占85%。2011~2023 年,累计通过WHOPQ 的HIV 相关检测产品数量达71 款,占所有PQDx 产品的55%。
1.2 WHO PQDx 致力于推进全球可持续发展目标的实现
2015 年9 月, 联合国通过以17 个可持续发展目标为核心的2030 年可持续发展议程,致力于在2030 年前消除贫困、促进平等和应对气候变化等,其中第3 个目标:确保各年龄段人群有健康的生活方式,以促进全人类福祉。在这个背景下,WHOPQDx 致力于推进所有人都获得优质、安全和有效的IVD 产品机会,并通过制定战略来推动实现该发展目标。
WHO 网站的IVD 概述页面中介绍了当前WHO PQDx 战略。该战略着重于2 个关键方面:①采用国际公认的标准和最佳实践经验;②全面评估制造商提交的产品信息,确定产品是否符合WHO PQDx 的要求。若IVD 产品的审评结果达到WHO PQDx标准, 该产品将被列入WHOPQDx 产品清单,并在WHO 网站进行公示。WHO PQDx 清单详细展示了产品的PQ 编号、产品名称、制造商信息和生产地址,为联合国相关机构、WHO 会员国等提供采购依据,保障供应的IVD 产品具备高质量、安全性、有效性,以及适用于当地需求。
1.3 WHO PQDx 的标准化审评流程和内容
WHO PQDx 与疫苗和药品的PQ 有相似的审评流程,且同时存在2 种审评路径:全面资格预审评估(full prequalification assessment,以下简称全面审评)和简略资格预审评估(abridged prequalification assessment,以下简称简略审评),其中简略审评路径仅适用于已在严格监管机构(stringent regulatory authority,SRA)注册的产品(或申请产品与严格监管产品无实质区别)。与全面审评路径(图1)相比,简略审评路径省略了对产品文档的技术审评[3]。
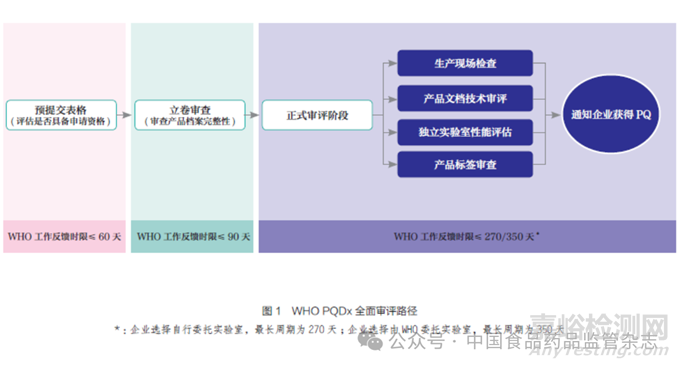
全面审评路径主要包括4 个审评阶段。
(1) 审查预提交表格( 文档)是否满足标准。制造商申请WHO PQDx 时,首先需填写预提交表格,提供产品、监管和制造商信息,然后通过电子邮件递交申请, 供WHO 评估申请产品是否符合预认证资格。此阶段WHO 的最长审评周期为60 天。符合资格后,WHO 以书面形式告知其适用的审评路径(全面审评或简略审评),并要求制造商提供协议书和费用支付证明。上述流程完成后,制造商将被邀请提交产品文档,以推动审评进程。
(2)审查文档是否具备完整性。该阶段旨在确保产品文档的所有必需部分均已提交,不涉及技术审评。如果WHO 发现产品文档不完整,将要求制造商补充所需信息,并规定需在期限内提交补充文件。制造商将有2 次机会提交缺失信息,倘若最终文件仍不符合要求,WHO 将以产品文档不完整为由拒绝继续审查,并取消申请。在确保产品文档完整的前提下,WHO 将继续进行产品的全面技术审评。该阶段的最长审评周期为90 天。
(3)全面技术审评。全面技术审评主要包括4 项内容:产品文档的技术审评、独立实验室性能评估、生产现场检查和产品标签审评。这4 项审评内容是并行进行的,审评费用为12 000 美元。对于实施简略审评路径的产品,审评费用为8000 美元。
产品文档的技术审评。WHO从以下3 个方面对制造商提交的产品文档进行审评:①评估产品性能;② 评估产品的制造过程;③确定制造商的质量管理体系是否达到对制造现场进行检查的标准。产品文档应当涵盖产品信息、设计和制造信息、产品性能规范、相关验证和确认研究信息、标签信息、商业历史、监管历史以及有关质量管理体系的信息等。在产品文档审评过程中,WHO 发现的任何问题都将以书面形式通知制造商。此时,制造商有权提供最多2 项纠正措施计划。PQDx 审评程序将因此暂停,直至制造商提交的纠正措施计划被WHO 接受。制造商还可选择与WHO 进行磋商,证明与解释在产品文档审查期间发现的问题,在此期间,WHO 会为制造商提供技术指导和规范,以协助其符合WHO 的技术审评要求。
独立实验室性能评估。尽管产品文档的技术审评已包含制造商对产品性能的研究, 但是WHO 仍额外设置了独立实验室性能评估流程。此项评估由WHO 认可和合作的实验室执行,方案由WHO 与相关专家共同制定。该项评估通常涵盖临床性能(灵敏度、特异性等)及分析性能(分析灵敏度、精密度、批次间差异等)的验证,同时还会考虑产品操作特性和易用性,为基础设施有限环境中产品是否适用提供信息。此环节制造商有两种选择:①选择由WHO 委托和协调指定合作的实验室进行性能评估,此种选择可能会延长一定的时间周期;②直接委托和协调WHO 合作的实验室完成,但制造商需负责实验室性能评估的全部费用。上述灵活选择机制能更好满足制造商的特定需求和资源情况。
生产现场检查。目的在于评估制造商是否符合质量管理标准ISO 13485:2016《医疗器械质量管理体系 用于法规的要求》(Medical Devices-Quality Management Systems-Requirements for Regulatory Purposes),并重点关注所实施的流程和程序是否适合向WHO 会员国提供可靠的供应产品。
产品标签审评。产品标签将作为预提交表格、产品文档、独立实验室性能评估和生产场地检查的一部分进行审查。WHO 审查产品说明书的清晰度、正确性、与产品技术文件中提交信息的一致性,是否符合国际标准化组织相关指南和要求,以及对WHO会员国目标用户群体的适用性。产品标签审查的总体反馈将在所有评估部分完成后提供给制造商。如果WHO 要求,制造商必须在产品通过资格预审之前修改标签。
WHO 全面技术审评总时间包括档案审查、生产现场检查、绩效评估、标签审查以及通知制造商列入清单的决定的总时间。技术审评总时间与企业选择如何进行独立实验室性能评估有关,如果企业选择自行委托实验室完成性能评估,最长周期为270 天;如果企业选择由WHO 委托实验室完成性能评估,最长周期为350 天。
(4)通知审评结果。基于上述所有信息,WHO 将决定产品是否符合PQDx 要求,如果产品不符合申请将被取消。对于符合PQDx 要求的产品,将被添加到WHO PQDx 清单中,并有资格获得WHO 会员国和联合国相关机构的采购。
1.4 WHO PQDx 产品上市后监督
产品列入WHO PQDx 产品清单后,为了保持产品的PQ 状态,制造商必须继续履行WHOPQDx 的承诺、报告与产品相关的变更、提交产品的年度报告、履行上市后监管义务等,开放生产场地以进行例行复检,以及确保产品持续符合WHO 资格预审的技术规范。对列入WHO PQDx 清单的产品,WHO 会征收4000 美元的年费,未能在商定的期限内履行上述要求将导致该产品从WHOPQDx 清单中移除。
2、WHO PQDx 的相关进展
自2010 年以来,WHO 持续拓展PQDx 的产品范围, 以满足WHO 会员国和联合国相关机构不断变化的需求。最近一次变化发生在2023 年7 月,WHO 关闭了新型冠状病毒抗原及核酸检测产品的紧急使用清单(emergency use listing,EUL)程序,同时将该类产品转移至WHO PQDx 的审评程序。该变化能够更好地适应当下公众的卫生需求,同时确保相关产品在全球范围内获得高质量保障。
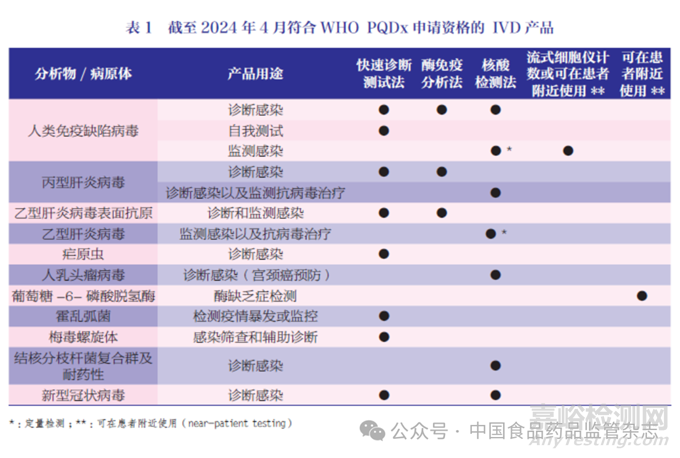
截至2024 年4 月,WHOPQDx 纳入了传染病、肿瘤和遗传性疾病相关检测,涵盖艾滋病、疟疾、乙肝、丙肝、结核病、梅毒、霍乱、新冠肺炎、宫颈癌、 葡萄糖-6- 磷酸脱氢酶(G-6-PD)缺乏症等 [4],见表1。
2.1 已通过WHO PQDx和正在审评的 IVD 产品
截至2023 年12 月底, 已有11 种疾病相关的诊断试剂被纳入PQDx 审评的范围, 128 款诊断试剂通过了WHO PQ。这128 款诊断试剂中占比最多的是HIV 诊断试剂,共计71 款(包含3 款HIV/ 梅毒联合检测诊断试剂),其次分别是疟疾诊断试剂26 款、丙型肝炎诊断试剂18款、乙型肝炎诊断试剂7 款、人乳头瘤病毒(human papilloma virus,HPV)诊断试剂4 款以及梅毒诊断试剂2 款,如图2 所示。其中有15 款产品由于制造商停产、产品变更、主动撤回、未能持续通过验证等情况被陆续从清单中移除。
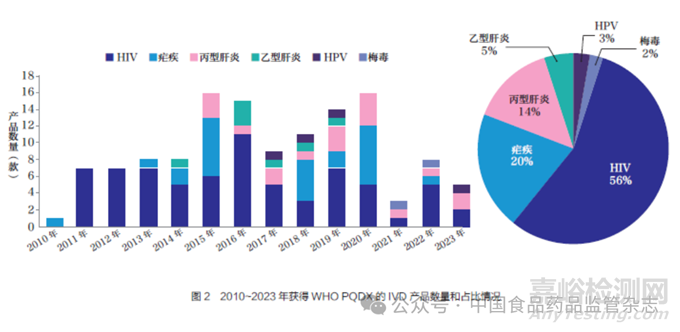
目前处于WHO PQDx 不同审评阶段的IVD 产品共有39 款,排名第一的是疟疾相关产品12款,其次是HIV 诊断试剂10 款、结核分枝杆菌复合群及耐药性检测试剂7 款、HPV 诊断试剂4 款、丙型肝炎诊断试剂3 款、梅毒诊断试剂1 款、霍乱诊断试剂1 款以及G-6-PD 酶缺乏症诊断试剂1 款。
2.2 WHO PQDx 促进国际公立采购市场的发展
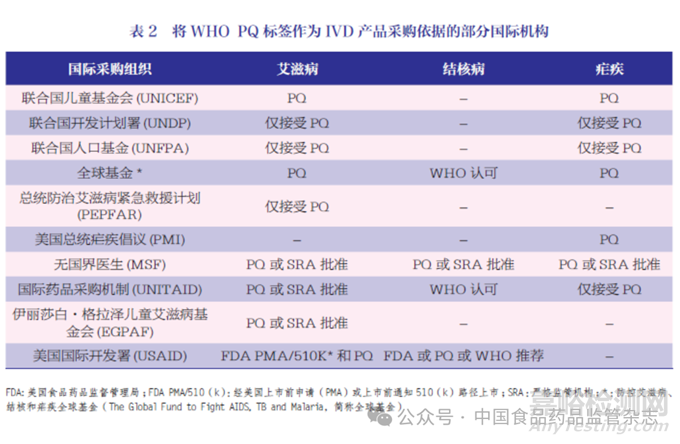
尽管WHO PQDx 项目运行时间尚短,但根据其主要捐助者UNITAID 发起的影响评估报告显示[5],WHO PQDx 项目的运行已经对国际公共采购市场产生了积极影响。有数据表明,由WHO PQDx 促成的IVD 捐赠资助的国际公立采购市场在2016年达到了约3 亿美元的规模,这一数字未包括政府采购和私人采购市场。目前,大部分国际采购机构将WHO PQDx 作为质量保证的要求, 根据2023 年WHO公布的一份报告[6],当前至少10个主要国际捐助机构包括联合国儿童基金会、联合国开发计划署和联合国人口基金等在采购HIV和疟疾等诊断产品时,将WHOPQDx 作为强制要求或优先标准,见表2。
2.3 WHO 的注册协作程序助力IVD 产品快速进入市场
2019 年,WHO 启动IVD的注册协作程序(collaborative registration procedure,CRP)。CRP 允许相关国家和地区监管机构共享WHO PQDx 审评的产品信息,以减少重复性的监管工作,加速质量可靠的IVD产品更快获得相关国家和地区注册,并进入当地市场。相关国家和地区监管机构承诺在收到评估信息后,90 天内加速做出是否注册的决定。
2019~2023 年,签署CRP协议的国家和地区数量显著增加, 已有26 个国家和地区的监管机构与WHO 合作并签署了CRP 协议。所有通过WHOPQDx 审评程序的IVD 产品,均能参与WHO C RP 协议国家和地区的加速注册程序,目前已有5 个国家和地区使用此途径注册了IVD 产品。
3、WHO PQDx 工作规划
3.1 缩短WHO PQDx审评时间
上文所述简略审评是2014年WHO PQDx 工作小组增加的流程, 简略审评路径相比全面审评路径能够节约至少80 天的时间。根据2015 年 WHO PQ年度报告[7],2015 年进行全面审评的中位时间为314 天, 如果纳入2014 年之前的数据,则中位数为454 天。对于IVD 产品的制造商而言, 接受这个时间表仍然存在挑战。随着近些年IVD 技术的快速发展,企业必须加快进入市场,因为迭代的新技术很可能在5 年内出现,部分产品可能因WHO PQDx 审评时限而导致诊断技术过时,进而被市场淘汰。为应对上述问题,WHO 于2023 年9 月上线了电子资格预认证系统(electronic WHO prequalification system,ePQS)。该系统从2023 年1 月1 日开始,允许申请人提交电子通用技术文档(eCTD),从而高效管理产品相关文档的生命周期;同时将 WHO PQ 部门的核心工作纳入一个集中平台,以简化工作流程,提高工作效率,有望缩短审评时间。
3.2 进一步扩展PQDx产品范围
2019 年WHO 收集了会员国和采购机构等利益相关方的需求, 制定了PQDx 产品范围扩展计划,并于2020 年1 月发布于WHO 网站[8]。该项计划公布了未来3 年优先纳入PQDx 审评管线的疾病(分析物),共涉及13 个品种。由于新冠疫情突然而至,WHO 启动EUL 程序,该计划被推迟,13 个品种中仅有结核病相关IVD 产品在2022年9 月开放了PQDx 审评程序,比原计划推迟约2 年[9-10]。2023 年10 月16 日在WHOPQDx 工作小组举办的全球网络研讨会上,宣布了扩展计划的时间表将重新进行调整和发布。值得关注的是,本次调整后PQDx的范围将扩展到新的领域,包括非传染性疾病。
3.3 进一步宣贯指导文件,加速上市
2019 年WHO 启动的IVD产品CRP, 被认为是加速IVD产品进入各国和地区的强大工具。但在实际工作中,仍面临一些挑战和困难。例如,许多国家和地区的监管机构缺乏对CRP 的了解,需要更多的宣传活动;部分国家和地区的监管机构不能严格遵守90 天的目标注册时间,可能与其缺乏充分的指导文件相关。
3.4 提高特定产品性能评估实验室的评估数量和能力
性能评估实验室在WHOPQDx 中扮演重要的合作伙伴角色,其评估结果直接影响WHO评估IVD 产品在资源有限的环境中使用的有效性和安全性[11]。从WHO 网站性能评估实验室页面上,可以看到目前对于HPV 分子检测、G-6-PD 缺乏症、结核病分子检测这3 类检测产品的性能评估缺乏足够的合作实验室选择,正处于开放申请中[12]。
4、我国IVD 企业参与WHO PQDx 的现状和机遇
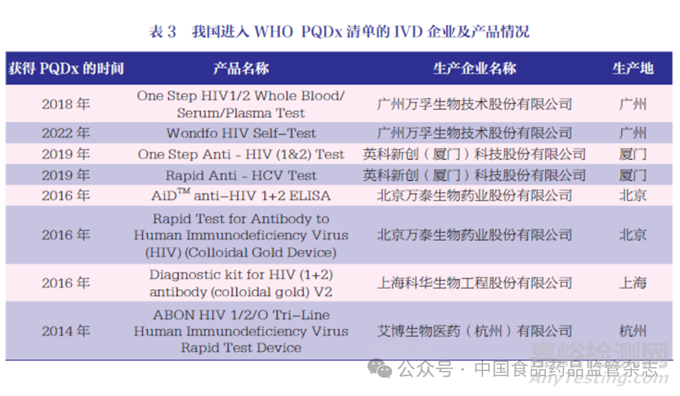
当前WHO PQDx 清单中有113 款IVD 产品, 其中约70%来自雅培、罗氏、丹纳赫3 家跨国企业;有8 款产品由我国本土企业生产,来自广州万孚生物技术股份有限公司、英科新创(厦门)科技股份有限公司、北京万泰生物药业股份有限公司、上海科华生物工程股份有限公司和艾博生物医药(杭州)有限公司,获得WHO PQDx 的IVD 产品为HIV和丙型肝炎病毒检测,见表3。
国际公共采购是全球贸易的重要组成部分,在过去的几十年,我国IVD 行业经历了年复合增长率15%~20% 的高速发展。新冠疫情之后,我国IVD 行业不仅拥有强大的产能,更具备了领先全球的成本优势,我国IVD 产品在国际公共采购市场上具备巨大的出口潜力。随着WHO PQDx 在国际公共采购市场的影响日渐显著,建议我国IVD 企业提前布局,以获得走出国门新的发展机遇。
另一方面,我国IVD 企业参与WHO PQDx 审评过程, 能够提升产品生产制造能力、促进产品质量达到国际标准;又能推动企业更好地适应国际市场需求,提升产品国际竞争力。当前环境下,我国IVD 企业积极参与WHO PQDx 项目不仅有助于提升企业自身实力,更重要的是可以在全球IVD 领域探索更广泛的市场机会。
5、结 语
由于IVD 产品通常不被人体直接摄入,因此一般不被认为具有潜在的生命危险,其国际和国家监管框架较药品监管体系的完善度略差。在建立WHO PQDx机制前,大部分国际捐助者都依赖防控艾滋病、结核和疟疾全球基金、联合国儿童基金会等各自发布的IVD 产品质量保证政策,而且许多欠发达国家和地区的IVD 产品监管相对薄弱,导致市场上部分IVD 产品质量低下或缺乏质量保证。
WHO PQDx 虽实施不足15 年,但发展迅速。截至2023年12 月底,已有10 种疾病被列入WHO PQDx 的审评范围,累计128 款相关IVD 产品通过了WHO PQDx。由于WHO PQDx的实施,符合国际质量标准的IVD产品能够通过集中采购,持续引入医药资源匮乏的国家和地区,进一步帮助中低收入国家和地区获得优质诊断产品的机会,并形成正反馈,促进国际公共采购市场的发展。
近些年,我国IVD 企业在国际市场上取得了较大突破,其中参与WHO PQDx 已经成为我国IVD 企业走出国门的重要策略和选择。目前,我国已有5 家企业进入WHO PQDx 清单,预计会有更多IVD 企业走入国际公共采购市场,旨在帮助更多目标人群获得优质的IVD 产品。
引用本文
胡晋君,麻婷婷,刘东来,宋爱京,许四宏,张河战*,张辉*.世界卫生组织体外诊断产品资格预认证项目发展历程及现状[J].中国食品药品监管,2024(8):12-21.

来源:中国食品药品监管杂志


