您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2024-12-22 10:03
摘要:目的 为加快构建新发展格局,保障人民健康优先发展战略,全方位了解我国放射性药品发展的现状,分析制约放射性药品生产和使用的主要问题。方法 深入我国放射性药品产业集中的地区,从药品检验机构、生产单位和医疗机构的角度,采用实地走访、查阅文献、对比研究等方法开展研究。结果与结论 建议加快修订《放射性药品管理办法》,规范放射性药品医疗器械审批管理,强化放射性药品检验机构建设和能力提升,加强放射性药品研发指导,加大政策引导,推进我国放射性药品产业健康快速发展的建议,以满足我国人民用药需求,促进我国放射性药品产业高质量发展。
放射性药品(简称“放药”)在恶性肿瘤、心脑血管疾病等诊断和治疗方面具有特殊的作用[1-3]。近年来,国家多部门出台相关政策,促进了产业快速发展,我国放药产业迎来了新发展机遇。
我国1956年开始放射性同位素和核医学研究工作[4],经过近70年的发展,取得了长足进步。目前我国批准了35种放药,但相较于美国批准的59种数量仍较少,仅2011年至2022年美国食品药品监督管理局批准了18种放药[5]。我国在核素供应[6]、靶点开发[7]、药学研究[8]、检验技术[9]、监督管理[10]等方面仍有必要开展深入研究。
本课题组深入了解我国现阶段核素生产、放药研发、临床使用、检验检测、监督管理等方面的现实情况,剖析制约发展因素,提出发展建议,以期为我国放药产业高质量发展提供参考。
1、 我国放药发展现状
1.1 政策利好带动放药研发高潮
2021年6月国家八部委联合发布《医用同位素中长期发展规划(2021-2035年)》[11]指导“十四五”和今后一段时间内我国医用同位素发展。2023年4月,为满足临床需求,鼓励放药研发,国家药品监督管理局(简称“国家药监局”)发布《关于改革完善放射性药品审评审批管理体系的意见》[12]。四川省,以及烟台市结合现有基础,及时发布《四川省人民政府关于促进核医疗产业高质量发展的意见》和《烟台市医用同位素健康产业发展规划(2022-2025年)》地方性文件,鼓励产业发展[13-14]。
1.2 我国放药产业规模增加迅速
根据国家药监局信息显示,目前我国放药生产企业已增长至74家,主要集中在北京、广东、江苏和四川等21个省、自治区和直辖市。2021年中国放药市场规模达50亿元人民币,2022年融资9亿元人民币,市场潜能较大,产业规模增加迅速[4, 15]。
1.3 放药产业局部聚集新型核素研发增多
我国放药生产研发企业较为集中,主要分布在北京地区、华东地区(广东、上海、江苏、湖北等)及西南地区(四川)[16]。其他省份散发而在,未形成产业聚集优势。目前,我国有35种放药及12个配套药盒获批上市,涉及11种核素,详见表1,以锝[99mTc]、碘[125I]、碘[131I]相关药物为主。走访了解到企业研发新品种使用到的核素种类主要包括氟[18F]、锝[99mTc]、碘[131I]、镥[177Lu]、钇[90Y]、镓[68Ga]、钯[103Pd]、锗[68Ge]等,涉及多种新型单抗、多肽、蛋白类放射性核素偶联药物(RDC药物),其中已有3款药品处在上市申请阶段(NDA),28款药品处在临床前阶段,40款处在临床试验阶段。NDA前阶段药品占比共计96%,2023至2029年计划有34款放药申报上市(图1)。
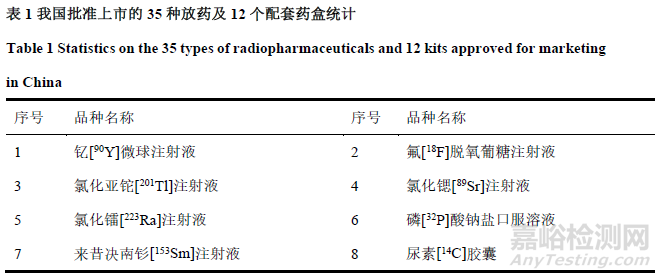

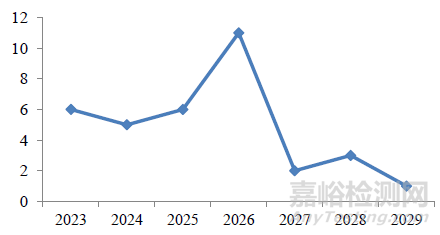
图1 2023-2029 年我国放药生产企业计划申报上市趋势
Figure 1 China 's radioactive drug manufacturers plan to declare the trend of listing from2023 to 2029
1.4 检验机构情况
1.4.1 中国食品药品检定研究院放药检验能力情况
中国食品药品检定研究院(简称“中检院”)是经国家药监局授权可全面承担放药检验的法定机构,放药实验室组建于1961年,是我国最早开展放药检验的实验室。主要承担放药的注册检验工作,负责安全监管所需的相关复验和技术仲裁等工作,同时承担放药质量标准的制修订以及相关技术复核工作[17]。另根据《关于进一步加强即时标记放射性药品生产企业管理的通知》和《医疗机构制备正电子类放射性药品管理规定》,授权中检院负责放药生产许可检验和医疗机构正电子类放药备案检验工作[18]。已通过中国合格评定国家认可委员会(CNAS)认证的放药相关检验资质8项,能够满足放药检验所需的技术要求。
1.4.2 上海市食品药品检验研究院放药检验能力情况
上海市食品药品检验研究院(简称“上海院”)于1965年在中国药品生物制品检定所的指导下,设立了放药的专业检验科室[17]。1982年开始承担放药监督检验和新药审核任务,具有环保许可的乙级非密封放射性工作场所,通过CNAS认证的放药相关检验资质5项。
2、 我国放药发展面临的主要挑战
2.1 放药法规发展相对滞后
《放射性药品管理办法》自1989年颁布以来未进行本质性修订,随着新产品不断投入市场,已难以匹配市场需求和监管需要。《医疗机构制备正电子类放射性药品管理规定》和《关于做好放射性药品生产经营企业审批和监管工作的通知》[19]放药生产、经营企业审批权限由省级药品监督管理部门和省级国防科技工业管理部门执行,加快了放药的审批速度,进一步激发了市场主体的活力[20],但各省执行尺度不一致,部分放药未能备案,仅能以临床试验途径使用的现象较为普遍[21-24]。
放药生产存在注册审批、生产许可和备案多种管理模式[17],不同机构生产同一种放药的管理方式不同。以氟[18F]脱氧葡糖注射液为例,生产企业需先采用注册制获得文号方可生产,再可采用生产许可的方式进行委托生产[25],而医疗机构采用备案方式生产[18]。
2.2 放药研发基础较弱
我国放药的发展起步较晚[4],受多方面影响研发基础和能力较弱。核素供应方面,我国放射性核素自给率低,存在“卡脖子”难题[26],我国仅在北京和四川有5 座研究堆可用于医用核素的生产,且仅能供应满足国内20%的碘[131I]和锶[89Sr]以及5%的镥[177Lu][11],同时缺乏放药研发使用的核素标准源。目前使用的发生器主要依赖进口,如锝[99mTc]标记类药物生产厂家多且应用广泛,但制备用的国产99Mo/99mTc 发生器仅有6 个批准文号,68Ge/68Ga 发生器则完全依赖进口,医用回旋加速器大部分为国外制造供应。
2.2.1 生产建设
放药生产企业的建设成本高,加之检验用仪器设备昂贵,为了降低成本规避风险,创新公司普遍不购置全套仪器,不具备检验产品质量的能力。无菌检验对环境洁净要求较高,投入成本较大,医疗机构普遍不具备自检能力。22 个省、自治区、直辖市的47家医疗机构,仅1 家医疗机构的相关科室具备全检能力,自检能力较低。
2.2.2 人才建设
放药的研发通常需要药学、核物理及核技术等多学科交叉的复合人才,且应具备一定的药品研发经验,但我国相关专业技术人才和经验较少[4, 10, 26],研发能力不足。在实际工作中发现,存在企业对未知杂质峰的鉴别仅靠照搬国外资料,没有利用标准物质进行确认研究,放射性核纯度验证未进行完整的技术开发和方法验证的情况。
2.2.3 药学技术
我国原创靶点开发能力还不足,在核医学领域前列腺特异膜抗原(prostate specific membrane antigen,PSMA)、成纤维细胞激活蛋白抑制剂(fibroblast activation protein inhibitor,FAPI)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)、D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽(D-Phe1-Tyr3-Thr8-octreotide,TATE)、神经内分泌肿瘤(SSTR)等热门靶点[27-31],以及1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid,DOTA)、PSMA-617、PSMA-11 等热门络合剂和配体研发的同质化情况较为严重[32-36],对配体和靶点的构效关系研究还不够深入,多以仿制和跟随为主。
2.3 放药检验机构稀缺
从 1961 年至今,我国仅有中检院和上海院承担全国的放药检验工作,检验人员稀缺,目前我国医用回旋加速器已超过120 台[37],加之生产单位的增多,检验人员与检验任务不匹配的问题将逐步显现,特别是当特殊情况无法及时到达现场时,将延长药品的研发和备案用时。
随着新的治疗用放射性药物研发的增多,对药品检验机构辐射工作场所的承载能力提出了更高要求。以镥[177Lu]为例,1 瓶镥[177Lu]-PSMA-617 的出厂规格为7.5×109~1.25×1010Bq [38],现有检验机构受放射性核素日等效最大操作量和年最大使用量的限制,较难及时接收相应样品开展检验工作,对未来服务创新放药的检验工作带来了较大挑战。
2.4 含放射性源类产品管理属性存在交叉
按照《放射性药品管理办法》中放药的定义[39],现有放射性核素发挥作用实现临床诊断或治疗的医疗产品全部按照药品管理,而在实际生产和使用中,生产企业和医疗机构对含放射性核素的粒子、微球、放射免疫分析药盒以及发生器的管理属性存在交叉[1]。
2019 年,我国首款90Y 树脂微球产品被分类界定为以药为主的药械组合产品,并按药品注册上市。有专家认为微球进入人体后放射性物质可能溶出或脱附,在一定程度上参与了体内代谢,应按药品进行管理。放射性籽源是将放射性核素密封在钛金属壳内,采用介入手段直接植入到肿瘤内部[40],以物理治疗方式发挥治疗作用,不参与人体代谢,国内7 家企业已按药品进行注册,未影响产品上市和产业发展。放射免疫分析药盒在我国同样按照药品管理并被《中华人民共和国药典》(2020 年版)收载,本质上与其他按照医疗器械管理的试剂盒相似,但改变管理属性将对上市产品和生产企业带来困扰,同时也不利于监管。国外药品监管机构多按医疗器械或辐射源管理,按器械管理有利于与国际接轨,在一定程度上可以促进产业的发展。对于核素发生器,淋洗99Mo/99mTc 发生器制得的高锝酸钠注射液可直接作为药品使用,专家认为可按药品进行管理,而淋洗68Ge/68Ga 发生器得到的68Ga 盐酸盐,需经处理后再标记使用,可按原料药管理。
2.5 放药生产使用管理较严
放药的生产使用受到环保、交通、公安、市场等多部门的监督管理。放药生产和使用单位每年会接受环保、公安、卫生等部门的监督检查,同时对于放药从业人员,需每5 年通过国家环保部门辐射安全与防护相关专业知识考核,部分地区卫生健康部门每年会组织开展职业健康培训考核,与环保部门培训考核内容相近。根据《放射性物品道路运输管理规定》[41],道路运输放药的车辆要求为企业自有的5 辆厢式或封闭货车,并配有行驶记录仪功能的卫星定位系统等要求,成本较高。医疗机构普遍表示放药在临床使用中限制较多,为符合环保要求,需建设大体积衰变池收集患者排泄物,而现有条件无法满足改造要求,只能放弃研发使用一些放药,难以满足患者诊疗需求。
3、 我国放药发展建议
3.1 加快修订《放射性药品管理办法》
《放射性药品管理办法》作为国务院颁布的专门针对放药的行政法规,对放药产业的发展具有决定性的引领作用,但随着技术的进步,已出现滞后于产业发展的现象。建议加快修订《放射性药品管理办法》,坚持以人民为中心的发展思想,广泛听取业界意见,研究符合市场需求和监管需求的放药定义,强化企业主体责任,加强上市后监管,从根基上完善放药监督管理制度,带动《医疗机构制备正电子类放射性药品管理规定》和《关于进一步加强即时标记放射性药品生产企业管理的通知》等相关文件开展制修订工作,助力放药产业发展。
3.2 规范放药医疗器械审批管理
放射性粒子、微球、放射免疫分析药盒和发生器等产品既符合放药的定义,也符合医疗器械的定义,但无论按药品或按医疗器械管理,国家层面监管部门都已具备相应能力。建议借鉴国际经验,结合我国监管实际,顺应产业发展,进一步加强省级监管能力,建立保证产品质量和使用安全的科学管理制度体系。属性的界定既要以法律规定为依据,又要兼顾其本质属性和作用机制,以确保产品安全、质量可控为基础,以保障市场稳定、患者正常使用为前提,进行管理调整,保障人民用药用械安全稳定可及。
规范生产企业和医疗机构放药审批管理。建议根据《中华人民共和国药品管理法》和《放射性药品管理办法》等上位法规定,将医疗机构配置和使用的放药纳入院内制剂管理,由国家药监局出台相应的注册制度和申报材料要求,明晰注册途径和工作程序,进一步完善即时标记类放药生产和文号管理规定,激发市场创新活力。
3.3 强化放药检验机构建设和能力提升
目前,我国放药检验机构少,建设经验不足,建议有意愿的机构按照《国家药监局锝标记及正电子类放射性药品检验机构评定程序》[42]加快建设并提升检验能力。中检院瞄准国际前沿,完备新型放药检验仪器,加强人才和技术储备,研制放射性标准源,开展放药标准和药品监管科学研究,进一步提升我国放药检验能力,促进临床急需放药研发生产。未来几年我国将迎来放药注册检验的高潮,但放药检验机构辐射安全许可等级较低的现状,将难以满足新核素新品种的检验工作,同时根据新品种生物分布检验项目,亦需扩增动物实验场所辐射安全许可。建议国家生态环境主管部门指导药品检验机构提升建设辐射安全等级,并支持放药动物实验相关项目场地建设,将人民健康放在优先发展战略地位,满足人民用药迫切需求。
3.4 加强放药研发指导
目前,生产单位的药品注册申报材料质量普遍不高,难以一次性开发形成符合药品注册要求的技术资料,将极大地浪费检验资源,延后药品上市时间。建议技术审评和检验部门早期介入,靠前服务,主动沟通了解品种信息,帮助企业同步研发,指导企业完善药品标准,提质增效完成注册检验,指导医疗机构建立检验方法,做好药品质量监控,切实保障人民群众用药安全,健全放药相关指导原则和药学资料要求,优化审评审批程序,增订更多放药进入《中华人民共和国药典》,优化提高放药检验方法,指导企业研发生产,全面加强放药监管能力建设,提升我国放药研发和应用水平,加速新药获批上市,让患者尽早获益。
3.5 加大政策引导推进我国放药产业健康快速发展
现阶段,我国放药产业发展已经进入快车道,呈现出“围绕核素,集群发展”的特点,头部企业布局全国供应常用放药,创新公司积极开发新型放药。建议国家和地方政府加大政策扶持,统筹环保、交通、公安、国防科工、市场、卫生等部门,按照“ 讲政治、强监管、保安全、促发展、惠民生”的工作思路,建立完善跨部门、跨区域、跨层级的综合监管机制,强化监管协同,构建全方位、多层次、立体化的监管体系,形成齐抓共管监管合力。聚焦产业反应突出的问题,充分听取两院院士、资深专家意见,加快制定解决措施,出台有“特”药味道的政策文件,为产业松绑,为企业减负,加强宣传指导,积极做好产业发展后续服务工作,“一体式”推进我国放药产业健康快速发展。
参考文献






来源:中国药物警戒 2024-12-17


