您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-05-15 11:52
前言:
缝合是外科手术中必不可少且非常重要的环节。说到手术缝合,你的脑海里可能会出现医生一针一线缝合伤口的画面。的确,如今很多手术依然需要医生运用高超的“缝纫”技巧对伤口或器官组织进行缝合。但有时他们也能够借助一种医学“订书机”——吻合器,通过机械化的操作方式让手术缝合更加高效,并让许多困难复杂的手术变得简便,且大幅降低了手术并发症发生率。
吻合器虽然方便,但在安全性方面一直存在一些争议。2017年热播的电视剧《外科风云》中,医生和患者家属就在吻合器的使用问题上产生了分歧,这些问题涉及:医生的使用习惯、医生对于器械的信任程度、手术费用、病人耐受力等。可见吻合器虽然快速、便捷,但也存在着一些不容忽视的问题。
近年来,吻合器的普及和野蛮生长造成了严重的后果,其中包括:上万例故障、近万起严重伤害事件及上百起死亡案例。鉴于此,FDA于今年4月23日发表声明,提议将外科缝合器重新归类为高风险医疗器械,并且需要对器械进行上市前审查以及性能效果研究。未来,所有的外科组织装订设备可能都会被列为II类设备,这意味着需要在上市前审查和批准上市前通知。
一、吻合器起源于欧洲,兴盛于美国
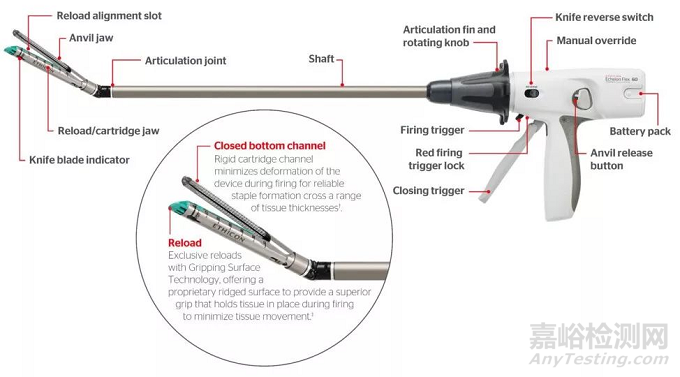
吻合器是手术中使用的替代手工缝合的设备,工作原理是利用钛钉对组织进行离断或吻合,类似于订书机。相对于传统的手工缝合,器械缝合有以下优势:缝合快速,操作简便,节省手术时间;一次性使用,避免交叉感染;利用钛钉或不锈钢钉,缝合严密、松紧合适;副作用少和手术并发症少等优点,还使得过去无法切除的肿瘤手术得以病兆切除,很受外科医生的青睐。
1. 公元前14世纪,“巨蚁吻合器”
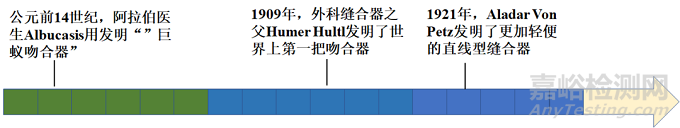
最早的吻合器概念要追溯到公元前14世纪,阿拉伯医生Albucasis用巨蚁缝口。将巨蚁放在对合好的伤口边缘,使巨蚁咬住伤口,然后去除巨蚁的身体,留下头部使伤口缝合,可以说这是最早的缝合器。
2. 1909年,首个真正意义上的吻合器诞生

“外科缝合器之父”——Humer Hultl
(图片来源:网络)
20世纪初期、病患的预后推动了手术器械的革新。为了能避免组织污染、缩短手术时间、用最为简单可靠的方法关闭组织,1909年,世界上第一把吻合器(Humer Hultl, 匈牙利)应运而生。它由各种金属部件组装而成,重达8磅,装配费时达2个小时,但其双排缝合钉遵循的“B”原则与现代缝合器相同。因此Hultl被誉为“外科缝合器之父”。
3. 1921年,更轻便的现代吻合器登场
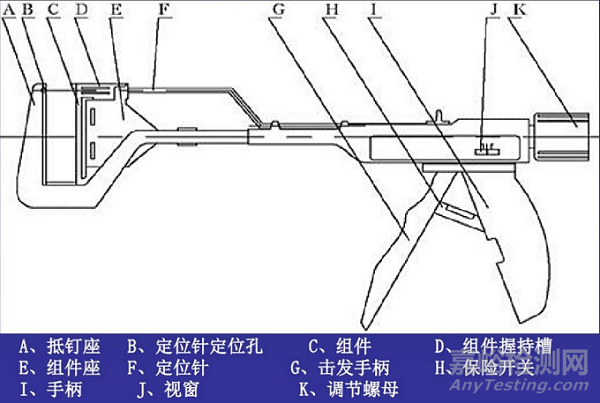
直线型缝合器基本结构
(图片来源:网络)
1921年直线型缝合器问世 (Aladar Von Petz, 匈牙利),简化了吻合器的设计,用镍银合金代替金属丝,并且可以重复填装缝钉,使得吻合器更加轻便。1934年德国的H. Friederich和Neuffer对缝合器作了改进,加装了可更换钉仓;1951年前苏联的实验外科器械研究所对缝合器进行了系统的研究,并在此领域处于领先水平;
4. 1958年,吻合器在美国获得关键性改良
1958年美国学者Ravitch在前苏联实验外科器械研究所参观后,将缝合器技术引进美国。1967年美国外科公司Auto Suture的创始人Locn Hirsch以及他的工程师们根本解决了装配缝钉费时的问题,生产出一种可以方便应用于临床手术的吻合器;
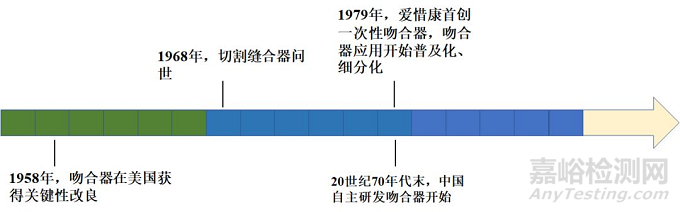
5. 1968年,切割缝合器问世
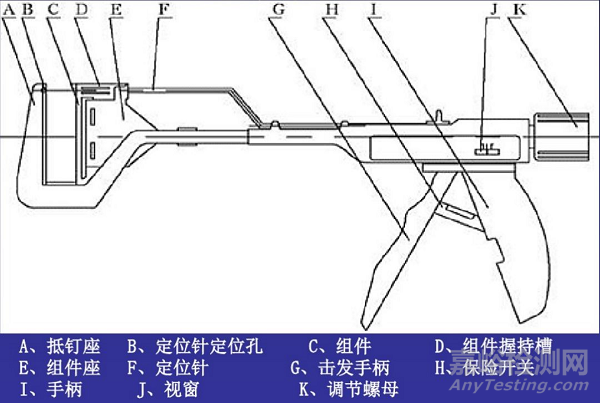
直线型切割吻合器基本结构
(图片来源:网络)
美国一家外科手术器械公司推出具有双组双排缝钉及刀片的吻合器,在缝合的同时可以进行组织切割,多用于胃肠组织的离断,或胃肠、肠肠的内翻吻合。1978年,美国外科公司又发明了管型端端吻合器(EEA,具有双排环形缝钉及刀片,刀片用于吻合时切断缝钉内侧的组织,使之形成端端吻合口,用于不同直径腔道的环状吻合)。
6. 1979年,爱惜康首创一次性吻合器,吻合器应用开始普及化、细分化
1979年美国Ethicon公司,研制和发展了多种缝合器和吻合器,并生产出全球第一把完全一次性、单病人使用的机械吻合器。一次性吻合器减少了器械消毒带来的患者交叉感染的几率,降低了患者术后并发症发生的概率,也使吻合器的大批生产和广泛应用又上了一个台阶。此后,各类用于不同组织的缝合器陆续问世,为外科医生们提供了手术用的有力武器。
7. 20世纪70年代末,中国自主研发吻合器开始
中国研制吻合器始于1976年,先后研制成功了用于胃肠吻合、结肠直肠吻合的器械并成功应用于临床,但这些器械的使用方法和维护仍比较复杂。
经历了一个多世纪的发展,目前吻合器主要可分为线性吻合器、环形吻合器、线性切割吻合器、荷包吻合器、皮肤筋膜吻合器和腹腔镜专用吻合器等。

从左至右依次为:DST TA(闭合吻合器)、DST GIA(切割吻合器)、DST EEA(端端吻合器)和DST Hemorrhoid(痔吻合器)(图片来源:网络)
二、北美、欧洲医械巨头领跑吻合器全球市场
全球外科吻合器市场主要参与者
(资料来源:Marketsandmarkets报告)
全球外科吻合器市场两大巨头:Ethicon(爱惜康,强生子公司,美国)和Covidien(柯惠医疗,美敦力子公司,美国)。
除此以外,CONMED(康美。美国),Smith&Nephew(史乐辉,英国),Purple Surgical(英国),Intuitive Surgical(直觉外科,美国),Welfare Medical(英国),Reach surgical(瑞奇外科,中国),Meril Life Science Pvt有限公司(印度),Grena,Ltd.(英国),B.Braun Melsungen AG(贝朗,德国),Dextera Surgical(美国),Frankenman International(法兰克曼,中国)和Becton,Dickinson and Company(碧迪,美国)等公司也占有市场一席之地。
三、国产开放吻合器一定程度实现进口替代,腔镜吻合器发展迟缓
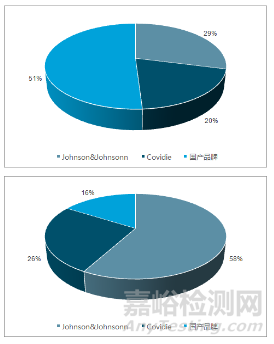
中国开放吻合器(左)及腔镜吻合器(右)市场竞争格局(资料来源:《2017-2023年中国吻合器市场分析预测及发展趋势研究报告》)
吻合器产品一般分为传统开放手术器械和腔镜手术器械,不同的吻合器市场竞争格局略有不同。
在传统开放手术器械上,国产品牌近年来不断涌现,对占主导地位的进口品牌发起挑战,逐渐缩短技术差距,在开放手术器械市场上获得近半市场份额。
而腔镜吻合器由于技术要求较高,形成了外资主导、内资为辅的竞争格局,其中美国强生爱惜康(Ethicon)占比58%,柯惠医疗(covidien)占比26%,国产品牌在腔镜吻合器市场只有 16%的市场占有率。
按地域分布,国内吻合器厂商主要分布在江苏,上海和北京。
江苏常州是国产吻合器的重镇,常州智业、常州新能源、常州康迪是国内最早生产吻合器的三家公司。品种规格齐全,产品出口国外,市场竞争力不断增强。
苏州的法兰克曼、贝诺、天臣国际三家走中高端路线。法兰克曼的市场表现非常好,是占有国内市场份额最高的企业。苏州天臣国际的产品有特色,走高端路线。苏州贝诺定位于中端品牌,在市场上遇到常州派的激烈竞争。
北京的瑞奇外科,国内市场占有率1.5%(2015年统计结果),市场份额并不大,主要定位在高端市场。成立于2005年,是美国ReachSurgical, Inc.在华投资的外商独资企业。集研发、生产、销售于一体的专业化外科医疗器械设备提供商。该公司产品技术立足高端产品平台,全线产品获得CE认证,RCS系列端端吻合器取得FDA认证。目前在美国Cincinnati、北京和上海设有三个研发中心。
四、普及不代表安全,“滥用”提高风险
吻合器与手动缝合相比,更便于外科手术操作并且可缩短外科手术时间,在手术环境中的益处不言而喻。一个世纪以来,吻合器的种类和功能不断增加和完善,销量也在直线上升。但是,这类看似简单方便的外科器械,“不知不觉”间已经造成了上万起医疗事故。归因于使用习惯的养成以及庞大的利益关系,人们选择性的忽视了这些已经发生、现在仍在发生的重大安全性事故。
自1988年以来,外科缝合器一直被归类为I类设备,作为FDA规定的低风险、“一般用途的手动手术器械”的一部分。宽松的审查制度导致质量参差不齐的吻合器进入市场,到达医务工作者手中。同时器械生产商对医院的售后培训不足,医师水平不一,也大大增加了这类器械的使用风险。
据FDA统计,从2011年1月1日到2018年3月31日,设备共涉及发生了超过32,000起故障、9,000多起严重伤害、366起与外科缝合器有关的死亡案例。这其中包括无法吻合和设备故障,以及伤口中的缝合钉出现畸形或吻合后的伤口重新开放。此外,报告还涉及了部分医师操作错误,例如在吻合程序期间选择了错误的缝合尺寸。
美国食品药品监督管理局(FDA)于2019年4月23日发表声明,提议将外科缝合器重新归类为高风险医疗器械,并且需要对器械进行上市前审查以及性能效果研究。未来,所有的外科组织装订设备可能都会被列为II类设备,这意味着需要在上市前审查和批准上市前通知。
五、增强医疗器械的审查、监管和维护是一个永不过时的话题
吻合器普及所带来的重大问题,为所有医疗器械敲响了警钟。对于所有准备上市或正在使用的医疗器械,都需要加强以下几个方面的管理,减少伤害事件的发生:
1. 增强医疗器械审查,将危险器械扼杀在摇篮里
吻合器此前被归类为I类设备,正是宽松的审查制度导致质量参差不齐的吻合器进入市场。在审查成本允许、合理的条件下,加强对医疗器械的审查及安全性评估是降低风险的最有效措施。
2. 给医疗器械一张“身份证”——杜绝高风险、二手器械

UDI代码结构(图片来源:网络)
美国FDA建立了“特殊医疗器械的识别系统”——医疗器械唯一标识(Unique Device Identification,UDI),对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”。医疗器械进入从生产、加工到流通、配送、使用全流程可溯源、全过程监管时代。
该系统正逐步在世界范围内被接纳,美国、欧盟已经落地实施,土耳其、韩国、印度等,已将UDI法规的制定提上日程。
近日,中国国家药监局召开医疗器械唯一标识系统试点工作研讨会,拟在全国范围内建立起以唯一器械标识(UDI)为手段的统一追溯体系。彻底杜绝高风险、二手及不合格的医疗器械。
3. 售后培训和维护是保证器械使用性和安全性重要环节
现代医疗设备的功能越来越丰富,科技水平越来越尖端,精密程度越来越高,设备操作复杂度和维修难度也越来越大,任何小偏差都可能让正在临床诊疗过程中运行的医疗设备出现故障,导致危及患者安全的不良事件发生。
医院普遍反映很多厂家不能提供良好的售后服务,尤其是对于“厂家的现场维修”、“对医院的售后培训”、“厂商热线电话服务”等方面的满意度很差。
总结:
吻合器是手术中使用的替代手工缝合的设备,工作原理是利用钛钉对组织进行离断或吻合,类似于订书机。通过机械化的操作方式让手术缝合更加高效,并让许多困难复杂的手术变得简便,且大幅降低了手术并发症发生率。
经过了一个多世纪的发展,吻合器种类多样,普及率广。北美、欧洲医械巨头(强生、美敦力等)领跑吻合器全球市场。中国于20世纪70年代末,开始自主研发吻合器。目前国内吻合器厂商主要分布在江苏,上海和北京。国产开放吻合器一定程度实现进口替代,腔镜吻合器还有很大提升空间。
但是,较为宽松的审查监管环境导致了严重的后果,数年间引起了上万例故障、近万起严重伤害事件及上百起死亡案例。FDA于4月23日发表声明,提议将外科缝合器重新归类为高风险医疗器械,并且需要对器械进行上市前审查以及性能效果研究。这也为其它正在蓬勃发展的医疗器械敲响了警钟,保证产品安全性、实现全程监管,保证售后培训和维修服务是确保企业和产品长远发展的必要条件

来源:思宇医械观察


