您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-27 09:11
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.石药二甲双胍缓释片通过一致性评价。石药集团旗下注射用谷胱甘肽(0.3克)和盐酸二甲双胍缓释片(0.75克,0.5克)已获国家药监局核发的药品注册批件。其中,盐酸二甲双胍缓释片两个规格均视同通过一致性评价。该产品为中美双报品种,于2016年5月已获FDA批准上市。谷胱甘肽为含巯基(SH)的三肽,用于化疗患者、放射治疗患者、各种低氧血症、肝脏疾病、有机磷或硝基化合物中毒的辅助治疗及解药物毒性。二甲双胍为降血糖药,主要用于改善2型糖尿病患者的糖耐量状况,不仅降低基础血糖,也降低餐后血糖。
2.恒瑞PD-1新药两项新适应症有望加速获批。恒瑞医药PD-1抗体卡瑞利珠单抗的两项新适应症上市申请拟纳入优先审评。这两项新适应症分别为:卡瑞利珠单抗单药二线治疗晚期食管鳞癌、卡瑞利珠单抗联合培美曲塞加卡铂一线治疗晚期或转移性非鳞癌非小细胞肺癌。卡瑞利珠单抗已于今年5月获国家药监局批准上市,是国内第三款国产PD-1抗体新药,用于复发/难治性经典型霍奇金淋巴瘤(cHL)患者的治疗。
3.华润双鹤非那雄胺片通过一致性评价。华润双鹤药业旗下非那雄胺片(5mg)获药品补充申请批件,该药品通过一致性评价。非那雄胺主要用于治疗已有症状的良性前列腺增生症(BPH)。主要剂型包括片剂、胶囊剂等。该药原研药由默沙东开发,商品名为保列治,1992年首次在英国获批上市,1994年获批进口中国。目前国内已获批上市的非那雄胺片剂生产企业有28家。2018年该品种国内销售额为13.7亿元人民币。
4.科济生物CAR-T产品在欧盟被纳入优先药物计划。科济生物在研嵌合抗原受体修饰的T细胞(CAR-T)产品CT053被欧洲药品管理局(EMA)纳入优先药物(PRIME)计划。继此次获PRIME认定后,科济生物将启动欧洲的注册临床试验。CT053是一种全人源抗BCMA的CAR-T细胞产品,用于治疗多发性骨髓瘤。一项Ⅰ期探索性临床研究结果显示。截至2019年6月30日,共有24例难治/复发多发性骨髓瘤患者接受CT053治疗,总缓解率(ORR)达87.5%,完全缓解率(CR/sCR)达79.2%;未观察到3级及以上的细胞因子释放综合征(CRS)。
5.索元生物ENGINE国际Ⅲ期临床新进展。在2019年CSCO年会上,索元生物公布其全球多中心ENGINE研究的新进展。ENGINE研究是在中美两国同步进行的Ⅲ期关键性临床试验,以索元生物发现的独特生物标记物DGM1为指导,进行精准医疗的实际应用。该研究在CD20阳性的弥漫大B细胞淋巴瘤患者中评估R-CHOP加DB102(enzastaurin)或R-CHOP加安慰剂的疗效。在联合用药期,所有患者都将接受长达6个周期的治疗。DB102组的患者如果达到完全缓解或部分缓解将有机会进入单药治疗期。目前,ENGINE研究进展顺利,患者入组已过半。
6.维眸生物完成新一轮融资。维眸生物完成人民币6500万元的C轮融资。本轮融资由贝达生物医药产业基金领投,资金将用于支持该公司自主研发的干眼症创新药项目VVN001的美国临床研究。维眸生物成立于2016年,致力于眼科疾病创新药的研发,目前已建立了领先的产品研发管线,并组建了国际一流眼科药研发团队。该公司创始人沈旺博士曾在雅培、安进等著名药企从事创新药研发20多年,期间领导团队成功开发了两款上市药物,包括一款被FDA批准的干眼症靶向治疗药物Lifitegrast以及抗癌药Venetoclax。
国际药讯
1.武田新型抗炎药Entyvio III期临床VARSITY结果积极。武田肠道选择性新型抗炎药Entyvio(vedolizumab)治疗溃疡性结肠炎的III期临床VARSITY 结果积极。该研究旨在评估Entyvio静脉注射(IV)与Humira皮下注射(SC)治疗中重度活动性UC患者的疗效和安全性。结果显示研究达主要终点和次要终点,与Humira组相比,Entyvio组在第52周临床缓解率方面具优越性(31.3% vs 22.5%,p=0.006);探索性分析显示Entyvio在抗TNFα初治患者亚组(34.2% vs 24.3%)和抗TNFα经治患者亚组(20.3% vs 16.0%)取得更高的临床缓解率;Entyvio组在第52周内镜下黏膜愈合率方面具显著提高(39.7% vs 27.7%;p<0.001)。详细结果已发表于《新英格兰医学杂志》。
2.Zealand创新疗法治疗儿童低血糖III期临床成功。Zealand公司评估dasiglucagon治疗糖尿病严重低血糖的儿科III期临床结果积极。Dasiglucagon是一种潜在首创的可溶性胰高血糖素类似物,目前正被开发用于即用型HypoPal急救笔。该研究在接受胰岛素治疗的1型糖尿病儿童患者中评估dasiglucagon作为严重低血糖的一种抢救疗法相对于安慰剂和GlucaGen的疗效。结果显示,dasiglucagon治疗组血糖恢复时间的中位数为10分钟,优于安慰剂组(中位数为30分钟,p<0.001)。GlucaGen治疗组的中位恢复时间为10分钟。研究结果也支持了在成人和儿童中使用相同剂量的dasiglucagon。Zealand计划在2020年初向FDA提交dasiglucagon的新药申请。
3.降胆固醇RNAi疗法inclisiran两项Ⅲ期临床结果积极。The Medicines Company在研降低胆固醇的RNAi疗法inclisiran在治疗杂合子家族性高胆固醇血症(HeFH)的Ⅲ期试验ORION-9,以及治疗动脉粥样硬化性心血管病(ASCVD)的Ⅲ期试验ORION-10中,达到所有主要和次要终点。同时,还表现出良好的安全性和耐受性。这两项关键性试验的详细数据将在未来的美国心脏协会(AHA)科学论坛上公布。该公司预计在年底向FDA递交新药申请,并在明年初向欧盟递交监管审查。
4.Incyte公司ruxolitinib乳膏剂III期首例患者给药。Incyte公司JAK1/JAK2抑制剂ruxolitinib乳膏剂治疗白癜风的III期临床TRuE-V试验完成首例患者给药。该项目包括2项III期研究TRuE-V1(NCT04052425)和TRuE-V2(NCT04057573),在12岁及以上青少年和成人白癜风患者中开展评估ruxolitinib乳膏剂单药疗法的疗效和安全性。ruxolitinib乳膏剂目前正处于III期临床开发:(1)用于治疗轻度至中度特应性皮炎(TRuE-AD项目)患者,预计2020年上半年取得初步结果;(2)用于治疗青少年和成人白癜风(TRuE-V项目)。Incyte拥有开发和商业化ruxolitinib乳膏剂的全球权利。
5.Achillion靶向创新疗法获突破性疗法认定。Achillion公司特异性靶向抑制补体因子D在研疗法danicopan获FDA授予突破性疗法认定,与C5补体抑制剂联用,治疗对C5抑制剂治疗反应不佳的阵发性睡眠性血红蛋白尿症(PNH)患者。2017年FDA已授予该药孤儿药资格。据悉,Danicopan通过靶向抑制补体因子D来调节补体的替代通路,阻断C3转化酶的产生。与C5抑制剂不同的是,danicopan阻止C3b片段在患者RBC上的沉积,控制PNH患者红细胞分解,以及血管外溶血,进而改善患者的治疗效果。
医药热点
1.北京试运行“智慧健康处方”。北京市“智慧健康处方”试运行正式启动。该项目由北京社区健康促进会牵头研发。其以社区常见病、慢性病的三级预防和重点人群健康管理为切入点,将药物使用指导处方、营养膳食处方等8个方面内容融为一体,为居民提供个性化、智能化的综合健康指导服务。目前,“智慧健康处方”已覆盖糖尿病、高血压、骨关节病等100种社区常见病、慢性病,匹配上千种相关影响因素,基本可用于北京市社区70%以上人群的健康管理。
2.电子化医疗注册信息核查年底要完成。国家卫健委发布《关于进一步加强医疗机构、医师、护士电子化注册信息核查和管理工作的通知》,明确到2019年12月31日,全面完成电子化注册信息核查核实工作。《通知》指出,对于医疗机构核查核实信息,须与《医疗机构执业许可证》核准内容一致,名称、诊疗科目使用规范全称。对于医师、护士核查核实信息,必须做到个人信息与有效身份信息一致、补录信息与原始人事档案信息一致、补录信息与补录申请材料内容一致。
3.国家医保局:2019年上半年17种抗癌药累计报销金额逾19亿元。国家医保局发布消息称,2019年上半年17种国家医保谈判抗癌药累计报销31.82万人次,报销金额19.63亿元人民币。据悉,17种谈判抗癌药包括12个实体肿瘤药和5个血液肿瘤药,均为临床必需、疗效确切、参保人员需求迫切的肿瘤治疗药品。与平均零售价相比,谈判药品的支付标准平均降幅达56.7%。
【博晖创新】公司控股子公司大安制药的药品人凝血酶原复合物被国家药品监督管理局药品审评中心纳入优先审评品种公示名单,现公示期满,正式进入优先审评程序。
【贵州百灵】参股子公司重庆海扶将引入宁波梅山保税港区众力锐赢股权投资合伙企业(有限合伙)对重庆海扶增资。众力锐赢向重庆海扶投资5,000万元,本次增资后,众力锐赢持有重庆海扶757.34万股股份,占重庆海扶总股本比例为3.33%。
审评动向
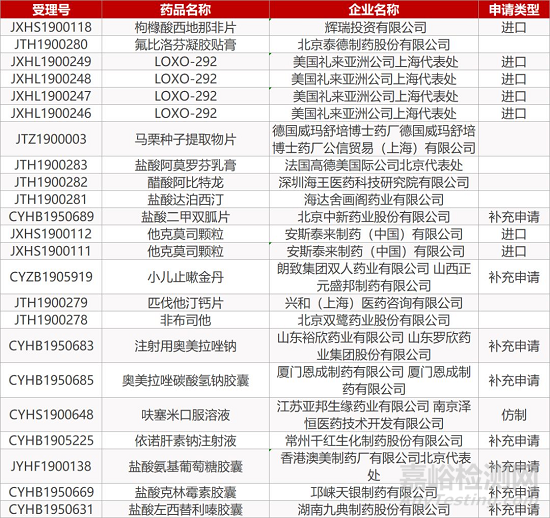
1. CDE最新受理情况(09月26日)
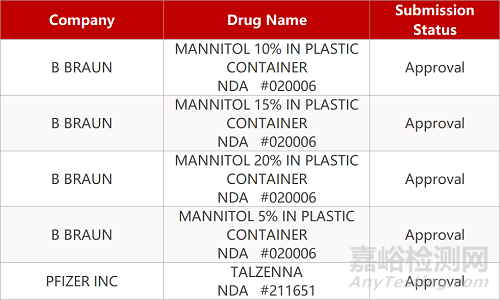
2. FDA最新获批情况(北美09月25日)

来源:药研发


