您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-11-29 19:27
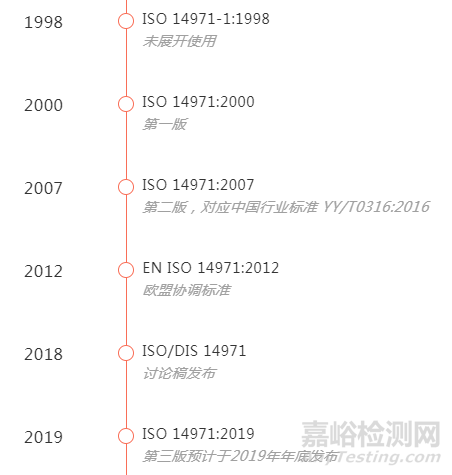
01、医疗器械风险管理的发展
02、ISO 14971:2007与EN ISO 14971:2012的区别
两部标准正文部分相同,EN ISO 14971:2012是欧盟的协调标准,其中附录Z描述了标准和MDD/AIMD/IVDD之间的关系
代表了医疗器械风险管理的最新技术方法(State-of-the-art)
列举了ISO 14971:2007和MDD 指令之间的七个差距(Deviations)
03、ISO 14971 范围
风险管理是一个过程,对医疗器械进行风险(危害)的识别、估计、评价,以及控制。可以覆盖医疗器械寿命(2000版)或生命周期的风险。风险管理不用于临床决策,可以是质量管理体系的一部分。
04、第三版ISO 14971新的定义
根据ISO/IEC Guide 63:20XX,增加“受益(Benefit)” 和“现有技术水平(state of the art)”等定义。更多的关注医疗器械使用阶段所期望的收益,以及现有或普遍公认的技术水平。
benefit 受益:使用医疗器械对个人健康的正面影响或期望的结果, 或对患者管理或公共健康的正面影响。
备注:受益可以包括对临床结果的正面影响、病人的生活质量、诊断有关的结果、与诊断器械对临床结果或公共卫生的正面影响。
state of the art 现有技术水平:根据相关科学、技术和经验的综合考虑,在特定时间内对产品、工艺和服务开发所应达到的技术能力水平。
备注:现有技术水平体现了当前和普遍接受的技术和医学的良好实践。现有技术并不一定意味着是最先进的技术和解决方案。这里描述的现有技术水平有时被称为“普遍公认的技术水平”。
reasonably foreseeable misuse 合理可预见的误用:没有按照制造商预期的方法使用一个产品或系统,但可以容易预期的使用行为。
注1:使用者包括一般人事和专业人事
注2:误用包括有意和无意
05、欧盟MDR对风险管理的要求
GSPR包括识别和告知剩余风险和非预期副作用
风险管理必须和临床评估关联,并在临床评估报告里体现,两者相互依靠并根据PMS及时更新
附录VII对公告机构的要求:公告机构要验证风险管理和临床及临床前的关联 Interface
公告机构审核临床评估时,必须确保满足GSPR,以及和风险管理相对应
公告机构需要验证临床评估的结论满足GSPR,并考虑了收益和风险的对比、风险管理、说明书、使用者培训,以及PMCF计划

来源:BSI


